全髋关节置换术后低蛋白血症的危险因素分析
柏光泽 李伟 任冬 杨正刚 严丹 王浩然
(成都市第六人民医院骨科,成都 610072)
全髋关节置换术(total hip arthroplasty,THA)是治疗终末期髋关节疾病的重要手段。但由于围手术期大量出血和禁饮、禁食,常常导致术后低蛋白血症[1]。有研究发现关节置换术后低蛋白血症发生率超过50%[2]。低蛋白血症会影响伤口愈合,增加伤口并发症发生率,延缓患者康复速度[3-5]。近年来,加速康复管理策略在关节外科发展迅速,越来越多的研究认为缩短术前禁饮、禁食时间(术前8 h 正常进食,术前6 h可进食液态蛋白质,术前2 h可饮含碳水化合物饮料,术后2~4 h 早期进食)是安全且有效的,此新型营养管理策略可有效降低THA围手术期低蛋白血症发生率,促进患者快速康复[6,7]。本研究拟探讨新型营养管理模式下初次单侧THA术后低蛋白血症的独立危险因素,为临床工作提供参考。
1 资料与方法
1.1 纳入与排除标准
纳入标准:年龄18~90 周岁,因髋关节退行性或者炎症性病变行初次单侧THA的患者。
排除标准:①营养不良的患者,术前白蛋白水平<35 g/L;②罹患易导致白蛋白水平降低的相关内科疾病,如肿瘤、消化系统疾病等;③明确的局部或者全身感染且感染尚未被控制,C 反应蛋白(C-reactive protein,CRP)水平超过正常值3 倍以上(>15 pg/ml);④肝肾功能紊乱,既往有糖尿病、神经精神系统疾病或未控制的心绞痛;⑤行髋关节翻修术、转子下截骨术或者双侧手术者;⑥相关资料缺失者。
本研究经成都市第六人民医院伦理委员会审批,并获得所有患者的知情同意。
1.2 研究对象
回顾性分析2017 年3 月至2019 年5 月成都市第六人民医院收治的因髋关节退行性或者炎症性病变行初次单侧THA 的237 例患者。其中男193 例,女44例,年龄38~90岁,平均年龄(66.0±8.2)岁。术后血清白蛋白水平<30 g/L 的患者定义为低蛋白血症,共计83 例(低蛋白血症组),其余154 例患者作为正常组。
1.3 手术方法及围手术期处理
患者全身麻醉后,采用髋关节后外侧入路,假体选择生物型假体。切皮前5~10 min予以氨甲环酸20 mg/kg 静脉滴注,术后3 h、6 h 再次应用氨甲环酸1 g抗纤溶,术中不放置引流管。
所有患者采用围手术期新型营养管理策略,即术前8 h 正常进食,术前6 h 可进食含蛋白质营养液,术前2 h 可补充碳水化合物营养液,术后2~4 h即可指导患者早期进食[6,7]。另外,所有患者均采用加速康复流程下的围手术期管理策略,包括术前宣教、疼痛管理、血液管理等[8]。术前、术后第1天和第3 天采集患者血液标本并检测血清白蛋白水平。由于临床工作中常常将血清白蛋白<30 g/L 作为静脉输注白蛋白的指征[9],因而,本研究根据患者术后第1 天或第3 天任意一天血清白蛋白水平低于30 g/L,即可判断为低蛋白血症。当患者出现低蛋白血症时,予以静脉输注白蛋白20 g提升白蛋白水平。
手术当天的补液方案:术前应用500 ml 生理盐水扩容(术前5~10 min若生理盐水仍未输完,不再输注,直接输注氨甲环酸),术前5~10 min 应用1%氨甲环酸(20 mg/kg),术后3 h、术后6 h再应用1%氨甲环酸2 g,即200 ml。术中静脉滴注生理盐水维持静脉通道的通畅。手术当天应用抗生素头孢西丁钠2 g(溶于100 ml 生理盐水中)2~3 次,即200~300 ml,应用泮托拉唑钠40 mg(溶于100 ml生理盐水中),即100 ml。术后根据患者的进食状况和精神状况酌情输注钠钾镁钙葡萄糖注射液和生理盐水补充水和电解质。
1.4 观察指标
1.4.1 一般情况:年龄、性别、体重指数(body mass index,BMI)、术前美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级、术前诊断结果等。
1.4.2 术前并存疾病:高血压等合并症。
1.4.3 血液指标:血容量、血细胞比容(hematocrit,HCT)、红细胞沉降率(erythrocyte sedimentation rate,ESR)及血红蛋白(hemoglobin,Hb)、白蛋白、CRP、白细胞介素6(interleukin,IL-6)水平等。
1.4.4 手术资料:手术时间、术中失血量、总失血量、手术当日输液量、手术当日尿量等,其中总失血量依据Gross和Nadel方程计算[10,11]。
1.4.5 术后住院时间及围手术期并发症等。
1.5 统计学方法
采用SPSS 22.0统计学软件进行统计学分析。计量资料经统计学分析符合正态分布,以表示。采用独立样本t检验比较两组患者计量资料。采用Pearsonχ2检验、连续校正χ2检验比较两组患者计数资料。采用Logistic 回归分析筛选初次单侧THA 后低蛋白血症的危险因素。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般临床资料比较
与正常组患者比较,低蛋白血症组患者罹患炎症性病变的比例更高,术前白蛋白水平更低,围手术期总失血量及手术当天输液量更多,且差异均有统计学意义,而其他指标差异均无统计学意义(表1)。
2.2 初次单侧THA术后低蛋白血症的危险因素
选取术前ASA分级、术前诊断结果、术前白蛋白及IL-6水平、围手术期总失血量及手术当天输液量6个可能的危险因素进行Logistic 回归分析。结果显示,初次单侧THA术后低蛋白血症的危险因素包括围手术期总失血量和手术当天输液量;术前白蛋白水平是术后低蛋白血症的保护性因素(表2)。
2.3 两组患者术后住院时间及围手术期并发症发生率比较
两组患者术后住院时间差异无统计学意义;低蛋白血症组患者伤口并发症发生率高于正常组患者,且差异有统计学意义,而下肢深静脉血栓、低钾血症、恶心呕吐等发生率差异均无统计学意义;两组患者均无肺栓塞发生(表3)。

表1 两组患者一般临床资料比较
3 讨论
THA 围手术期失血量较多,另外其患者多为高龄患者,术后罹患营养不良的风险很高[12]。THA 患者的营养状态,尤其是术后血清白蛋白水平,影响着患者的术后康复情况、医疗花费和再住院发生率等[13,14]。因而,分析初次单侧THA 术后低蛋白血症的危险因素,予以干预,降低其发生率,具有重要的临床意义。
本研究发现更多的围手术期失血量和手术当天输液量是THA术后低蛋白血症的独立风险因素。围手术期失血量更多,患者白蛋白损失更多,降低失血量是改善低蛋白血症的重要举措,这与前人的研究结果一致[15]。本研究发现术后当日补液量增多会增加术后低蛋白血症的风险,可能的原因是过多的补液量导致血液稀释,引起白蛋白水平降低。加速康复策略建议降低围手术期补液量,即限制性输液,降低患者水钠潴留、组织水肿等并发症风险,张少云等[16]发现关节置换围手术期补液量≤1500 ml是安全的,而本研究中手术当天补液量在1700 ml以上,仍有进一步下降的空间,可以使用口服药物代替静脉药物、个性化输液等[17,18]。
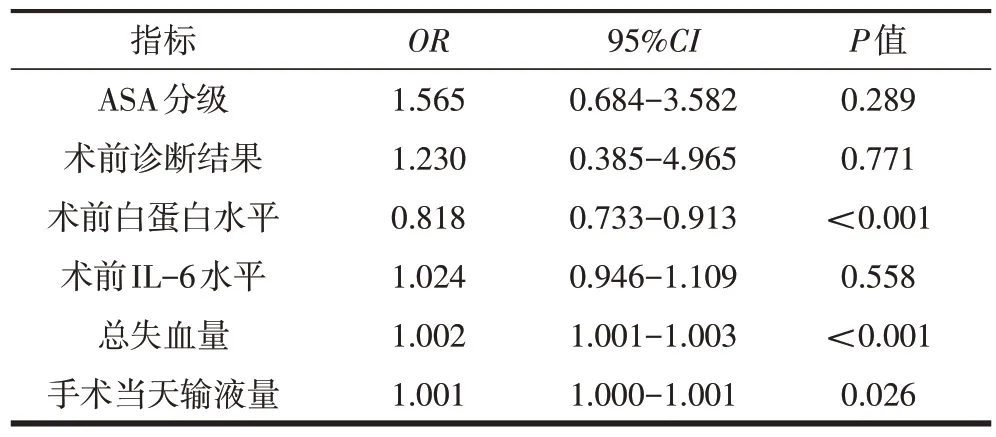
表2 初次单侧THA术后低蛋白血症的危险因素Logistic回归分析结果
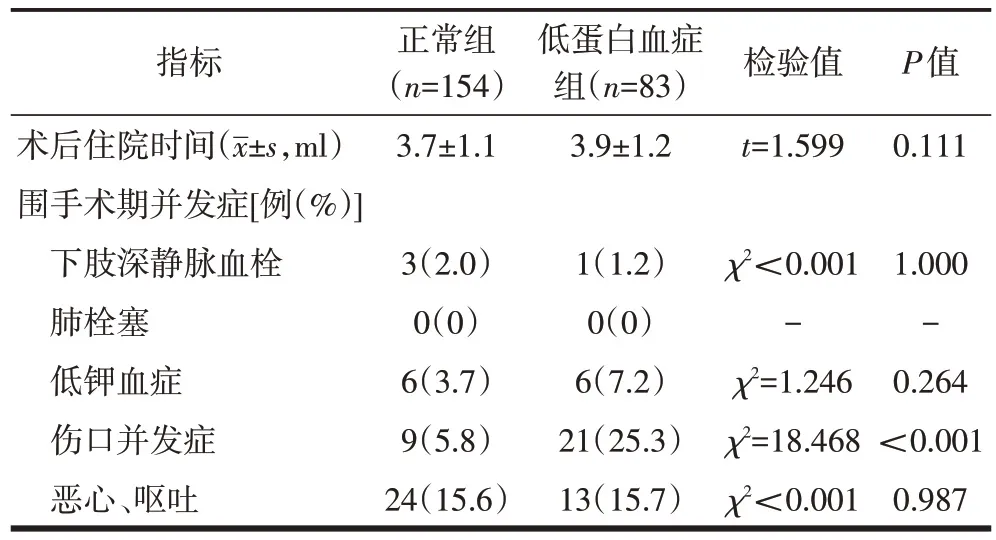
表3 两组患者术后住院时间及围手术期并发症比较
本研究的另一个重要发现是术前白蛋白水平增加是THA术后低蛋白血症的保护性因素。因而,纠正患者的营养状态,提升术前白蛋白水平至关重要,可鼓励患者术前进食鸡蛋、瘦肉、蛋白粉等高蛋白食物,合并营养相关疾病的患者应早期治疗[8]。加速康复外科推崇的新型营养管理策略旨在缩短术前禁饮、禁食时间,提高患者术前白蛋白水平,Cao等[6]发现该策略可降低初次单侧TKA患者术后低蛋白血症和电解质紊乱发生率,缩短术后住院时间。杨璐等[7]发现新型营养管理模式能够有效降低初次单侧THA 患者围手术期输蛋白率和输蛋白量,缩短住院时间,提升术后白蛋白水平,降低伤口并发症发生率。
本研究中低蛋白血症组患者伤口并发症的发生率更高,这与前人的研究一致。Roche等[19]发现血清白蛋白低于35 g/L 的TKA 患者罹患术后伤口并发症的风险是正常患者的2倍以上,血清白蛋白可以作为一个伤口并发症的预测因素。Alex等[20]认为血清白蛋白低于35 g/L会延缓关节置换术后的伤口愈合速度,增加伤口感染的发生率。因而,对于术后出现低蛋白血症的患者应高度重视,予以相关治疗策略,指导患者高蛋白饮食,必要时可静脉输注白蛋白等[21]。
本研究尚有一些不足之处。首先,这是一项回顾性研究,且随访时间仅1 个月,随访时间短,证据等级较低;其次,由于患者大多在术后第3 天出院,本研究仅统计了术后第1 天和第3 天的白蛋白水平,之后白蛋白水平可能会继续变化,因而计算的低蛋白血症发生率并不准确;最后,对于筛选出的风险因素,尚需要进一步的诊断实验。
综上所述,围手术期失血量和手术当天补液量增多会增加初次单侧THA 术后低蛋白血症的危险;术前白蛋白水平更高的患者,术后出现低蛋白血症的风险水平更低。

