组织工程骨中动静脉袢诱导轴向血管化的实验研究*
康宇翔 杨强 杨海云 赵栋
(天津市天津医院骨科,天津 300211)
目前,由于创伤、肿瘤、缺血性骨坏死或骨髓炎引起的大量骨缺损,仍然是临床面临的难题。自体骨移植是骨缺损替代治疗的金标准[1]。通常,在缺乏血液供应的情况下使用骨移植物不足以在缺损部位诱导足够的血管生成。带血供骨移植供体一般来自肢体未损伤部位,比如腓骨和肩胛骨。但这经常会导致供区并发症,例如长期疼痛、大血管损伤和器官功能减退等[2,3]。骨组织工程的出现解决了这一难题,通过将各种不同的骨替代物与成骨细胞和生长因子的结合,解决了由骨骼组织的骨移植引起的供体部位并发症的问题。但大量组织工程骨移植时经常出现血管化不足[4],早期缺少血供进而导致进行性骨流失。为解决这一难题,Erol 和Spira[5]在1979 年实验设计了动静脉袢模型,Mian[6]在2000 年将此模型发展并应用于组织工程方面。2009年Beier等[7]提出,在动物模型中,轴向型血液供应有利于受体部位血管化形成及生物物质向受体部位转运。但具体构建轴向血管化的方法仍是一大难题。本课题组通过利用组织工程骨植入动静脉袢的设计,促进骨修复材料的轴向血管化。现报道如下。
1 材料与方法
1.1 实验动物
选取10 周龄SPF 级SD 大鼠共42 只(天津医科大学实验动物中心,许可证号:SCXK2013-0049,实验动物合格证号:0002238),雌雄不限,体重280 g左右,平均(278.4±11.3)g,饲养条件:温度21~23℃,湿度60%~70%,12 h/12 h 昼夜光照循环。将大鼠适应性饲养1 周后准备实验。本研究经天津市天津医院伦理委员会批准。
1.2 人工骨材料的制备
胶原-羟基磷灰石(hydroxyapatite,HA)人工骨修复材料的制备:称取固定份数0.3g HA 粉末,称取相同份数29.4 g 胶原分散剂(固含量为1.02%)。向胶原分散剂中加入30.6 g 0.2 mmol/L 丙二酸溶液,并在4℃下以恒定速率搅拌。在搅拌的条件下加入HA,搅拌2 h,即得到1∶1胶原-HA分散剂。将60 g 上述胶原-HA 分散剂倒入100 ml 培养皿中,并冻干,得到孔隙直径为100~250 μm,孔隙率大于90%的未交联的胶原-HA 人造骨支架材料。将胶原-HA支架置于甲醛交联溶液中2 h。然后,用双蒸水反复洗涤10次,然后置于冷冻干燥器中进行第二次冷冻干燥。称取重组人骨形态发生蛋白2(recombinant human bone morphogenetic protein 2,rhBMP-2)(Sig⁃ma公司)1 mg,溶于10 ml 4 mol/L的盐酸胍中,0℃下静置30 min,形成浓度为0.01%的rhBMP-2 盐酸胍溶液。将胶原-HA人造骨支架切成0.5 cm×0.5 cm大小,将10 片各自浸入反应溶液中,并在0℃下静置60 min。移出支架并在干净的工作台中快速风干并无菌密封以构建胶原-HA人造骨。将人造骨置于聚乙烯薄膜袋中,密封并通过γ辐射灭菌(图1)。
1.3 实验动物分组及处理
将42只大鼠按照随机数字表法随机均分为实验组和对照组两组,每组各21只。
实验组大鼠麻醉成功后取仰卧位,将四肢固定,于两侧股部作纵行皮肤切口,使股部血管束充分暴露。显微镜下分离股动静脉束及其分支,并结扎离断腹壁浅动静脉及隐血管束。左侧用微型血管夹阻断股动静脉血流,在远端结扎剪断,肝素盐水冲洗邻近残端。从右侧股部血管切取长10 mm 的静脉移植段,按照最初血流方向插入至左侧股动静脉邻近的残端间,用无损伤缝线作端端吻合构建动静脉袢。将动静脉袢置于骨修复材料内(图2),用可吸收线将其固定于腹股沟。对照组大鼠未行动静脉袢置入,将骨修复材料直接固定于腹股沟。止血后关闭伤口,给予抗生素及抗凝治疗。术后第4、8、12周两组均各取7只大鼠取材进行观察。
1.4 观察指标
1.4.1 大体观察:大鼠给予麻醉后,沿原左侧切口入路,肉眼观察动静脉袢及骨修复材料的情况,行勒血实验检查血管是否通畅;光镜下观察毛细血管增生情况。
1.4.2 墨汁灌注组织学观察:术后第4、8 和12 周,大鼠全身麻醉下纵向剖腹,暴露主动脉,夹闭近端,远端插管,抗凝灌注后,通过导管缓慢注入10 ml复合油墨。低温放置24 h后,取出动静脉袢并在4%戊二醛溶液中固定7 d。常规切片,分别进行HE染色和CD31 染色,观察新生血管形成与动静脉袢之间的关系。每个标本取5张切片,每张切片于100倍光镜下,随机取5 个视野,使用Image-Pro Plus 6.0软件测量并记录各个视野中的微血管总面积、血管个数,计算微血管容积密度,计算公式为:微血管容积密度=血管总面积/视野总面积×100。

图1 胶原-羟基磷灰石人工骨修复材料

图2 动静脉袢植入胶原-HA人工骨修复材料
1.5 统计学方法
采用SPSS 22.0统计学软件进行统计学分析。微血管容积密度经统计学分析符合正态分布,以表示。采用t检验比较术后两组大鼠微血管容积密度。以P<0.05为差异有统计学意义。
2 结果
两组大鼠均存活直至实验完成,无感染、无血栓形成。所有大鼠均在手术后1~3 h 内被唤醒,并在24 h后自由移动、正常进食。
2.1 大体观察结果
术后第4、8 和12 周,实验组标本均为鲜红色。勒血实验提示血供良好,动脉搏动明显。光镜下显示,大量新毛细血管分布在纤维结缔组织和动静脉周围,毛细血管网密度在术后第12周最高。术后第4、8和12周,对照组大鼠标本均为暗红色。
2.2 墨汁灌注组织学观察结果
2.2.1 HE染色结果(图3):术后第4周,骨修复材料有少量微血管形成;至术后第8周,骨修复材料内已可见到纤维细胞结构,并有小血管形成,以实验组大鼠更为明显;术后第12周,血管形成进一步增多。
2.2.2 CD31 免疫荧光染色结果(图4):术后4、8 和12周,新生血管内皮细胞逐渐增加。
术后4周两组大鼠微血管容积密度差异无统计学意义;术后第8、12周实验组大鼠微血管容积密度均大于对照组大鼠,且差异均有统计学意义(表1)。
3 讨论
骨是仅次于血液的最常见的移植组织,骨移植是一种单独的或者与其他材料结合的移植,它通过其成骨、骨传导和骨诱导特性促进骨愈合。骨移植后的三个基本过程是移植物的血管化、成骨及骨端融合,其中血管化是关键环节[8],其作用贯穿于整个移植修复过程,对成骨和融合的方式及效果起决定性作用。组织工程骨的血管化是指血管长入并分布于人工材料的过程,它是维持人工骨活力、加速骨愈合的关键。当移植物植入体内后,成骨细胞距微血管超过100 μm后,它就不能通过渗透和扩散获得足够的营养[9],血管生长的速度和范围决定了新骨形成的有效性。国内外学者提出了多种血管化的策略来促进血管网的形成,包括在材料中加入促血管生长因子[10]、显微外科技术[11]等。
表1 两组大鼠术后微血管容积密度比较(,μm2/μm2)
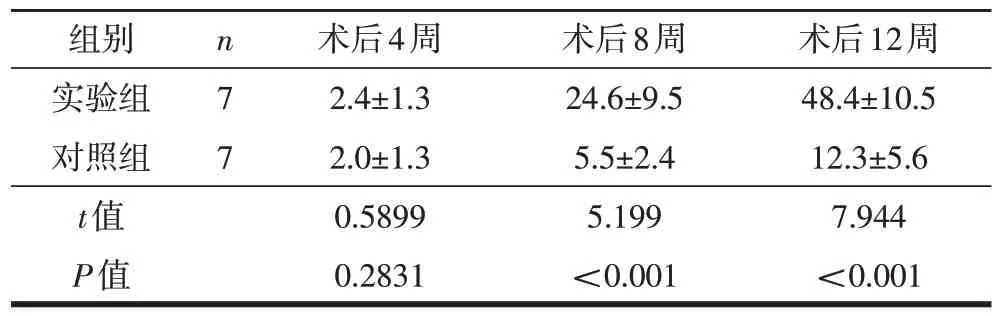
表1 两组大鼠术后微血管容积密度比较(,μm2/μm2)
近些年围绕促血管生成因子的研究主要包括:血管内皮生长因子[12]、成纤维细胞生长因子[13]、血管生成素、骨形态发生蛋白[14,15]、间充质干细胞[16]、血小板衍生生长因子[17]和乏氧诱导因子等[18-20]。Fong[21]发现在骨折愈合过程中乳酸含量增加了近5倍,这表明骨折愈合过程中乳酸含量的增加足以稳定乏氧诱导因子1α,诱导血管内皮生长因子的表达,促进血管生成。Bais 等[22]和Eyckmans 等[23]发现,BMP-2 对骨祖细胞具有分化诱导作用。Inoda等[24]发现,BMP-2 结合明胶海绵在严重骨缺损大鼠模型中使用6 周后,出现新骨形成,与对照组(同种异体或自体移植)相比,诱导12 周后出现骨桥,但临床应用价值均很有限,并且Jones 等[25]发现,BMP-2治疗骨缺损时存在新骨生成范围与周围组织损伤范围高度不相称的情况。
应用显微外科技术构建具有宏观血液循环的血管化组织工程骨[26],将轴向血管植入骨移植物中,此时骨移植物可以获得稳定灌注[27]。同时,中央轴向血管可促进周围血管生成[28,29]。王峰亮等[30]采用动静脉袢构建牛松质骨轴向血管化,发现去抗原牛松质骨支架有明显的血管形成。
本实验选取大鼠为实验对象,将股动静脉袢植入rhBMP-2-HA人工骨修复材料,4、8、12周后取材发现:大体观察结果显示,与对照组大鼠相比,实验组大鼠出现大量新生毛细血管,主要起源于股动静脉袢;光镜下显示,大量新生毛细血管分布在纤维结缔组织和动静脉周围的网络中,毛细血管密度在术后12周最高;HE染色及CD31免疫荧光染色结果显示,术后8 周实验组大鼠骨修复材料内已可明显见到纤维细胞结构,并有小血管形成,术后12周新生血管内皮细胞更多。对照组大鼠在观察期间仅有少量新血管形成。计算机图像分析测量结果显示,实验组大鼠微血管密度均大于对照组大鼠,提示植入动静脉袢可以明显增强该材料的血管化。Dong 等[31]通过兔股动静脉构建动静脉袢包绕组织工程骨,发现支架材料表面及中心部位均形成了致密的血管网络,且其血管网密度也显著高于对照组。分析其机制,可能是重建血供的手术导致了缺血再灌注损伤和伤口愈合反应,从而引发血管内皮生长因子和其他血管生长因子密集释放,为血管生长创造了有利条件。
本实验将动静脉袢植入人工骨修复材料中,为移植物提供血液供应,成功构建了组织工程骨轴向血管化模型,证明这种促进组织血管形成的方法是可行和有效的。与传统的骨移植相比,轴向血管化人工骨修复材料具有独立的血液供应,抗感染和生存能力更强。
将动静脉袢植入人工骨修复材料模型诱导轴向血管化,融合了组织工程学与显微外科技术,使组织工程骨较传统骨移植的优点得以在实际临床工作中实现,为大面积骨缺损的治疗带来希望。但本研究也有不足之处,更大体积的植骨材料对血管化的需求更大,今后的研究中将采用更大型的动物。

