施氏鲟促性腺激素α 亚基的克隆、序列分析及表达调控
高雪,吕伟华,马波,王念民,韩世成,张颖
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070;2.上海海洋大学农业部淡水种质资源重点实验室,上海 201306)
与其他脊椎动物一样,鱼类的生殖活动主要受下丘脑-垂体-性腺轴的调控,促性腺激素释放激素(GnRH)、促性腺激素(GtHs)和性腺类固醇激素在该过程中起着重要的调控作用[1]。GnRH 诱导垂体合成并释放GtHs,与细胞表面上的同源受体GtHRs 结合而协同参与体内重要的生理过程[2,3]。促黄体素释放激素类似物(LHRH-A)是哺乳类GnRH的类似物,可以刺激鲤Cyprinus carpio、鲫Carassius auratus 和草鱼Ctenopharyngodon idellus 垂体碎片中基础GtH 的释放[4]。GtHs 由垂体糖蛋白激素共有的α 亚基和每个GtH 独特的β 亚基组成。已在多种鱼类中确认,在鱼类的各个生长阶段和生殖循环过程中都有表达,各自发挥着不同的生理功能[5-7]。与哺乳动物一样,鱼类的α 亚基含有两个潜在的N-糖基化位点和10 个位于相同序列位置的保守半胱氨酸,形成五个分子内的二硫键,在鱼类中的氨基酸水平上最为保守[8]。硬骨鱼类GtH 的生理作用最先在鲑科鱼类中证实,它在卵子生成、发育、成熟、排精排卵以及类固醇激素信号传导方面发挥着重要作用[9,10]。目前,已经在条纹狼鲈Morone saxatilis[11]、日本鳗鲡Anjuilla japonica[12]、西伯利亚鲟Acipenser baeri[13]、大马哈鱼Oncorhynchus keta Walbaum[14]和抚仙金钱鲃Sinocyclocheilus tingi[15]等多种硬骨鱼中克隆得到GtHα 基因。
施氏鲟Acipenser schrenckii 隶属于鲟形目、鲟科、鲟属,在我国黑龙江、乌苏里江和松花江等地均有分布,是我国重要的养殖鲟[16]。施氏鲟肉质鲜美、生长迅速、抗病力强,具有很高的营养价值,尤其是鱼卵营养价值更高,有“黑色珍珠”的美誉[17]。施氏鲟性成熟晚,无副性征,研究其性腺发育调控,尤其是早期配子形成的分子调控机制,具有重要意义。施氏鲟的生殖活动受下丘脑-垂体-性腺轴(HPG轴)的调控,其中促性腺激素具有重要的作用,克隆GTHα 基因,研究其在施氏鲟早期性腺分化中的表达、分布及调控作用,掌握GTHα 基因的时空规律,为进一步阐明GTHα 的生理功能和分子机制和施氏鲟早期生殖调控提供了基础数据。
1 材料与方法
1.1 材料及样品采集
实验鱼由北京市水产科学研究院鲟鱼工程繁育中心提供。选取同一时期90 日龄的施氏鲟120尾,鱼体质量为38~55 g,体长201~266 mm。实验鱼随机分为4 组,每组30 尾,分别注射生理盐水(对照组)和1 μg/kg、3 μg/kg 和5 μg/kg 的LHRH-A,生理盐水为实验室自配。各组分别于注射后1 d、3 d、5 d 和7 d 采集施氏鲟的性腺和垂体,每次取9 尾,每3 尾混合成一个样,共三个平行,液氮迅速冷冻后转至-80 ℃冰箱保存备用。另取3 尾体质量为(4.8±2.23)kg 的施氏鲟,取其心、肝、肾、脾、肠、鳃、脑及卵巢等组织,液氮冷冻后置于-80 ℃冰箱保存备用。
1.2 总RNA 的提取和cDNA 合成
利用总RNA 提取试剂盒(Promega),按照说明书提取施氏鲟性腺、垂体等各组织中的总RNA。琼脂糖凝胶电泳检测其RNA 的完整性,超微量核酸蛋白测定仪(Thermo Scientific,美国)检测RNA 的质量和浓度,以施氏鲟总RNA 为模板,取1 μg 按照反转录试剂盒GoScriptTMReverse Transcription Mix,Oligo DT(Promega)的操作说明反转录合成cDNA 第一链,合成的cDNA 均稀释10 倍后于-20℃保存备用。
1.3 施氏鲟GtHα 基因全长克隆
采用同源克隆的方法,根据NCBI 已报道的中华鲟Acipenser sinensis GtHα 全长序列(登录号为EU656137.1)的保守区域内设计核心引物。引物由吉林库美生物技术公司合成(表1)。以施氏鲟性腺组织的cDNA 为模板,采用Ex Taq Version 2.0 plus dye(TaKaRa)进行PCR 扩增。反应程序为:98 ℃10 s,60 ℃30 s,72 ℃1 min,35 个循环,1.2%琼脂糖凝胶电泳进行PCR 产物检测(110V,25min)。用DNA琼脂糖凝胶纯化试剂盒(CWBIO)回收目的片段切胶,纯化片段连接到pMD18-T(TaKaRa)载体,转化至大肠杆菌DH5α 感受态细胞中,涂布于含Amp的LB 平板上37 ℃培养过夜。经菌落PCR 鉴定后挑选阳性克隆送吉林库美生物科技有限公司测序。根据已经获得的核心片段设计5'RACE 和3'RACE的特异性引物(表1)。以RACE cDNA 第一链为模板,用引物UPM 和GtHα 外侧引物进行第一轮扩增,随后以第一轮PCR 产物的稀释液为模板,用NUP 和GtHα 内侧引物进行第二轮扩增,按照SMARTer®RACE 5'/3'Ki(tTaKaRa,clontech)试剂盒的说明书进行操作,胶回收、连接、转化及测序步骤同上。
1.4 施氏鲟GtHα 基因的序列分析
将获得的GtHα 核心片段、3' RACE 和5'RACE 测序结果,用DNAMAN 8.0 进行拼接得到全长cDNA 序列,使用在线软件ORF Finder 查找其开放阅读框(ORF)并推导为相应的氨基酸序列,应用NCBI 中BLAST 程序对GtHα 基因序列进行比对。利用Mega 7.0 和Clustal X 软件,构建Neighbor-Joining 系统进化树。用TMHMM Server v.2.0 预测蛋白的跨膜区,用蛋白在线分析系统(Expert Protein Analysis System,Ex PASy)分析其基本物理化学参数、疏水性、信号肽、亚细胞定位、功能位点及二结构预测等信息。
1.5 实时荧光定量PCR
根据已得GtHα 的基因序列设计荧光定量引物和β-actin 基因设计内参引物(表1)。以cDNA 为模板,采用半定量RT-PCR 和荧光定量qRT-PCR方法,检测GtHα 基因mRNA 在施氏鲟各组织中的表达及LHRH-A 对GtHα mRNA 表达的影响。荧光定量PCR 仪型号为ABI 7500(Applied Biosystems,USA),荧光试剂使用SYBRGreen Ex Taq(Takara,Ⅱ中国大连),按照说明书进行程序设定。
1.6 数据处理
结果采用2-ΔΔCT方法计算GtHα 基因的相对表达量,数据用平均值±标准差(mean±SD)表示。为确保实验的准确性和可重复性,每个样品设3 次重复。用SPSS 进行单因素方差分析和Duncan 多重比较,显著性水平为P<0.05。
2 结果与分析
2.1 施氏鲟GtHα 的序列分析和蛋白质结构预测
施氏鲟GtHα cDNA 序列全长2 696 bp,包括5'端非编码区(5' UTR)54 bp,开放阅读框(ORF)348 bp 以及3'端非编码区(3'UTR)243 bp,在3'端非编码区内含有1 个加尾信号AAT AAA,共编码115 个氨基酸。Signal P 3.0 预测显示:第1~24 个氨基酸为信号肽,第25~115 个氨基酸为成熟肽。成熟肽序列中的第34、37、55、58、59、86、87、105、107 和110 氨基酸处为10 个较为保守的半胱氨酸Cys 残基;在第105 和107 Cys 残基中间间隔了1 个组氨酸His,形成CXC 型趋化因子的特殊结构(图1)。在GtHα 氨基酸序列中发现了2 个N-糖基化位点(NIT)和(NHT)(图3)。ExPASy 在线软件的蛋白质结构分析显示,施氏鲟GTHα 蛋白质分子式为C574H898N156O164S15,相对分子量为13.09Kda,理论PI值为8.83。蛋白质的二级结构中以α-螺旋占38.26%和无规则卷曲为42.61%为主(图2)。该序列中大多数氨基酸为亲水性氨基酸,所以认为GTHα属于亲水性蛋白质。
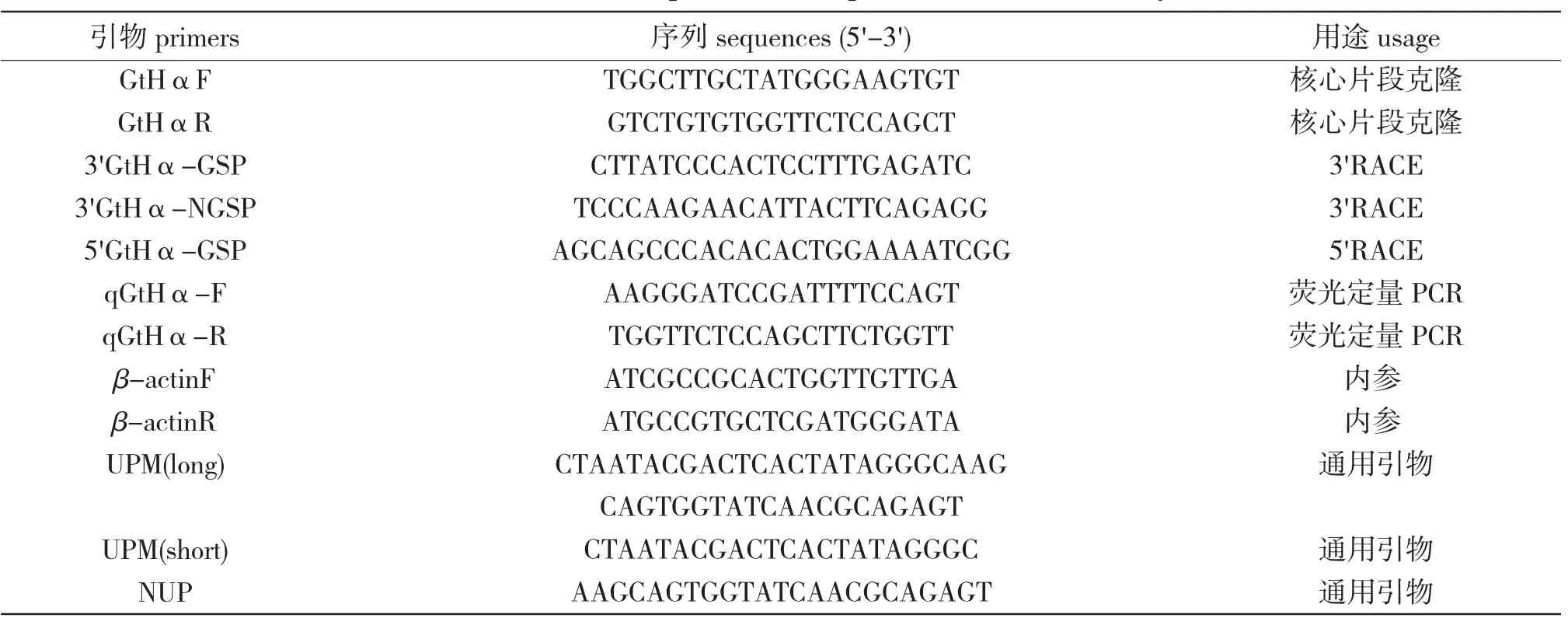
表1 实验所用引物及序列Tab.1 Names and sequences of the primers used in this study
2.2 施氏鲟GtHα 氨基酸同源性比较及系统进化分析
GtHα 的氨基酸序列与其他物种的比较表明:施氏鲟GtHα 与中华鲟Acipenser sinensis 的同源性最高(98%);其次是西伯利亚鲟Acipenser baeri(96%)和俄罗斯鲟Acipenser gueldenstaedtii(94%);与斑马鱼Danio rerio 同源性为76%;与其他脊椎动物GtHα 氨基酸序列的同源性在72%~80%,在进化中较为保守。用软件MEGA7.0 构建的施氏鲟GtHα 氨基酸序列的NJ 系统进化树表明:施氏鲟与鲟形目鱼类的亲缘关系较近,与中华鲟和西伯利亚鲟聚为1 个小分支,与非硬骨鱼类的其他脊椎动物构成一个大分支,推测与该物种的特殊性有关(图4)。
2.3 施氏鲟GtHα 在不同组织中的表达
以β-actin 基因为内参,采用实时定量PCR(RT-qPCR)法检测GtHα mRNA 在施氏鲟不同组织中的表达(图5)。结果表明:施氏鲟的促性腺激素α 亚基在心脏、肝、脾、垂体和性腺等10 种组织中均有表达,但表达量明显不同。GtHα mRNA 在垂体中表达量最高,其次为性腺和肾脏,相对于心、脾脏、肠道、肌肉、皮肤、鳃差异性显著(P<0.05),而在肌肉、皮肤、肌肉和心脏之间的表达差异不显著(P>0.05)。
2.4 LHRH-A 对施氏鲟GtHα mRNA 表达的影响
利用荧光定量PCR 法检测了施氏鲟在注射LHRH-A 后不同时间垂体和性腺中GtHα mRNA的相对表达水平。结果显示:不同注射剂量组垂体中GtHα mRNA 在各时间点的相对表达量均明显低于对照组(P<0.05)(图6),说明LHRH-A 抑制了施氏鲟垂体组织中GtHα 基因的表达;与垂体中GTHα 的表达模式不同,性腺组织中各浓度组的GtHα 基因则呈先升高后降低的表达趋势,但各浓度组GtHα 达到最高表达量的时间不同。注射剂量为3μg/kg 组的GTHα 表达量较高,在注射后第3 d达最高峰,表明LHRH-A 处理后GtHα 大量表达。1 μg/kg 组在第3 d 达峰值,5 μg/kg 组在第5 d 达峰值,均显著高于对照组(P<0.05)(图7)。
3 讨论
本研究克隆得到了施氏鲟促性腺激素α 亚基的全长cDNA 序列。序列分析发现,GtHα 成熟肽序列中含有10 个保守的半胱氨酸残基和2 个N-糖基化位点,在第58、59 和86、88 位的氨基酸上有2 对相邻的半胱氨,该结构与条石鲷Oplegnathidea fasciatu[18]的研究结果相似。在半滑舌鳎Cynoglossus semilaevis 和真鲷Pagrus major 的研究中也有类似的发现[19,20]。Milton[21]等将GtHα 归为蛋白质的“半胱氨酸结”超家族,包含由六种半胱氨酸形成的“半胱氨酸结基序”。这些半胱氨酸通过三个分子内二硫键以特定方式连接,推测可能与受体的结合有关。同源性分析发现,GtHα 氨基酸序列与中华鲟的相似度高达98%,可以确定其为施氏鲟GtHα。系统发育分析显示,施氏鲟与其他鲟形目的鱼类聚在1 个分支节点上,符合形态学上得出的分类进化地位。然而,在进化树分析中发现,施氏鲟、中华鲟等与哺乳类和爬行类动物聚为一大支,可能与鲟鱼为古老特殊的物种有关。
荧光定量PCR 结果表明,施氏鲟的GtHα 基因在性腺、垂体、肝脏、脾、肾脏和肌肉等组织中均有表达,但表达量不同。这种多组织表达特性暗示:GtHα 有更广泛的生理功能。GtHα 在垂体中表达量最高,表明垂体是主要的分泌部位。该结果与大多数硬骨鱼类相同[22]。该基因在性腺和肾脏中也有较高表达,而在肝脏、脾、肠道、肌肉和皮肤中仅微量表达,这在半滑舌鳎[20]和斑马鱼[23]中均有相似的发现,但在大西洋鳕Gadus morhus 的心、头肾、肌肉和肠中并未发现GtHα mRNA 的表达[24]。Parhar 等[25]和wahlstr 等[26]通过免疫细胞化学染色法证明了促性腺激素α 亚基在一些鱼类及哺乳动物(包括人类)垂体之外的组织中的表达。以上研究推断,施氏鲟的GtHα 基因在生殖中起重要调控作用,可能具有更广泛的垂体外生理功能。
LHRH-A 是人工合成GnRH 的高活性类似物,能够促进鱼类生殖活动。GnRH 在离体或在体内的情况下都可以刺激鱼类脑垂体产生和释放GtHs,促进鱼类的性腺发育[27]。Olivereau 等[28]研究表明,LHRH-A 能促使欧洲鳗鲡Anguilla anguilla GtHs 的分泌和性腺发育。在性腺分化早期,注射LHRH-A能一定程度提高鲇血清中GtH 水平[29]。Kumakura等[30]研究表明,单独施用GnRH 激动剂可以刺激真鲷Pagrus major 性腺早熟。本研究发现,给施氏鲟腹腔注射不同剂量LHRH-A 后,抑制了垂体中GtHα mRNA 的表达,表达量显著低于对照组(P<0.05)。与垂体的表达模式不同,不同剂量组中施氏鲟性腺GtHα mRNA 的表达量在均高于对照组(P<0.05),且呈先升高后降低的变化趋势,剂量为3 μg/kg 组在注射后的第3 d 达最高表达量。以上推测,LHRH-A 进入鱼体后,可能阻断了自身GnRH 的产生,从而抑制了垂体中GTHα 的分泌。垂体分泌的GtH 通过血液迁移到性腺中,GTHα 的高表达暗示外援性的LHRH-A 可能直接作用于性腺,促进GtHα 的分泌。谢嘉华等[31]研究发现,给金鲫投喂LHRH-A 0.01 mg/g 的饲料显著刺激了内源的GtH合成和分泌,促进性腺发育成熟,但过高的剂量反而表现出一定的抑制作用。本研究中,5 μg/kg 组性腺中GtHα 的表达量显著低于1 μg/kg 组和3 μg/kg 组,这与前人的研究结果相似。林浩然[32]等对金鱼的研究也证明了LHRH-A 存在自身增效和抑制作用。综上,揭示了LHRH-A 可通过调控GtHα的表达参与施氏鲟的早期性腺发育。

