杜仲梦尼夜蛾幼虫肠道可培养细菌的组成及其功能*
郭彤彤 朱铭强 李晋鹏 郭新荣 贺 虹
(1. 西北农林科技大学林学院 西部森林生物灾害治理国家林草局重点实验室 杨陵 712100; 2. 西北农林科技大学机械与电子工程学院 杨陵 712100)
杜仲(Eucomniaulmoides)是仅存于我国的第三纪孑遗植物,也是中国特有的重要经济树种,其树皮、叶、花及其次生代谢物均是重要的药用资源(张康健等, 2009)。同时,杜仲叶、树皮和种子中富含的白色丝状杜仲胶是一种天然高分子物质“反式聚异戊二烯”,具有热塑性、热弹性和高弹性,广泛应用于交通、通讯、医疗、电力、国防等领域(严瑞芳, 1995)。橡胶工业是国民经济最为重要的基础产业之一,而我国天然橡胶资源严重短缺。杜仲胶是除橡胶树(Heveabrasiliensis)之外世界上唯一具有开发前景的优质天然橡胶资源,成为我国重要且紧缺的战略物资。因此,大力培育杜仲资源,促进杜仲胶产业的发展,对于提升和优化我国橡胶原材料结构具有重要的战略意义。
一般认为杜仲是比较抗虫的树种,但是随着种植规模的扩大,一种专门取食杜仲叶片的害虫杜仲梦尼夜蛾(Orthosiasongi)(鳞翅目: 夜蛾科Noctuidae)暴发成灾,其食性专一,食叶量大,蔓延扩散快,为害期长,目前已成为杜仲产业最具威胁的生物灾害之一(李剑豪等, 1997; 赵阳等, 2015)。杜仲梦尼夜蛾幼虫能够取食消化杜仲叶片,完成正常的生长发育,并将杜仲胶随粪便排出(王俊雅等, 2016; 2017; 孙志强等, 2016),而一些其他食叶昆虫如银杏大蚕蛾(Dictyoplocajaponica)仅可取食少量杜仲叶,长时间饲喂后幼虫不能正常发育,出现消化不良和死亡。因此,杜仲梦尼夜蛾幼虫消化道应该具有适应寄主和消化/降解杜仲胶的特殊代谢机制。
已知栖息于昆虫消化道的微生物参与宿主许多重要的生理活动,如调节代谢、解毒、提供营养、激发免疫反应、影响宿主昆虫选择行为和对环境的适应性等(郭军等, 2015; Paniaguaetal., 2018)。尤其在鳞翅目昆虫中,其肠道微生物的主要功能是协助宿主代谢,帮助降解食物中难消化成分、有毒或有害物质(陈勃生等, 2017)。那么,杜仲梦尼夜蛾幼虫能够取食和利用含胶的杜仲叶片是否与其肠道微生物有关,肠道微生物对其幼虫生长发育和营养利用产生何种影响,能否利用肠道微生物进行杜仲胶的提取,这些都是亟待研究的科学问题。
本研究对杜仲梦尼夜蛾幼虫消化道的细菌进行分离培养与分子鉴定,并测定这些菌株对生物大分子物质(纤维素、果胶和淀粉)和杜仲叶主要成分的降解能力,然后通过抗生素处理分析肠道菌群对其幼虫生长发育和营养利用的影响,研究结果可为进一步研究杜仲梦尼夜蛾与寄主的协同进化、害虫防治及资源利用提供理论依据。
1 材料与方法
1.1 虫源采集及消化道解剖
2017年6月,从陕西省汉中市略阳县杜仲林采集杜仲梦尼夜蛾幼虫,选取健康的6龄幼虫,饥饿2 h后进行消化道的解剖。解剖前,先将幼虫放置于冰箱(-15 ℃)冷冻至昏迷,取出后浸泡于体积分数为75%的酒精中进行体表消毒2 min,经无菌水漂洗3次后,在解剖镜(德国莱卡EZ4D)下小心解剖出完整的消化道。所有解剖均在超净工作台完成,所用工具经严格湿热灭菌。将解剖出的单个消化道放入1.5 mL灭菌的离心管中,加入1 mL无菌水研磨混匀,制成肠液备用。重复5头幼虫。
1.2 肠道细菌的分离培养和分子鉴定
采用平板法在LB培养基、牛肉膏蛋白胨培养基(NA)和大豆蛋白胨培养基(TSA)上进行肠道细菌的分离培养(马乐好等, 2005)。吸取制备好的肠液50 μL涂平板,每种培养基每头幼虫各重复3个平板。将培养平板倒置放入30 ℃培养箱中培养3天,每天观察记录菌落数量和形态。用接种环挑取大小、颜色、形态不同的单菌落,在新的LB平板上划线培养,得到纯的单克隆菌株。
对菌株进行分子鉴定,首先将纯化的菌株接种于LB液体培养基中,置于摇床上(30 ℃,150 r·min-1)培养48 h,从每个菌株吸取2 mL菌液于新的离心管中进行离心(12 000 r·min-1,2 min); 弃上清,在沉淀中加入500 μL无菌水,混匀后放入金属浴(95 ℃)中10 min,然后12 000 r·min-1离心2 min,上清液作为PCR模板备用。采用细菌16S rRNA基因通用引物27F (5′-AGAGTTTGATCCTG GCTCAG-3′) 和1492R (5′-TACGGYTACCTTGTT ACGACTT-3′)进行PCR扩增。PCR扩增体系: Mix 12.5 μL,引物(10 μmol·L-1) 各1 μL,DNA模板1 μL,ddH2O 补充体积至25 μL。PCR反应条件: 94 ℃预变性5 min; 94 ℃变性1 min,53 ℃退火1 min,72 ℃延伸2 min,30个循环; 最后72 ℃延伸10 min,4 ℃保存。PCR产物在1% 琼脂糖凝胶上进行电泳检测,达到测序的浓度和纯度后送奥科鼎盛生物公司进行测序。
将获得的菌株DNA序列进行人工校对后,在GenBank 数据库中进行BLAST序列比对,下载相似性最高的相关微生物序列,然后利用ClustalX 2.1软件进行多重比对,并采用MEGA 6.0 软件基于最理想的建树模型构建最大似然系统发育树(Maximum likelihood tree)。相关菌株的DNA序列已上传 GenBank,序列号为MK571186-MK571195。
1.3 肠道细菌对纤维素、果胶和淀粉的降解作用
为了分析10株细菌对生物大分子的降解能力,挑取其单菌落加入10 mL LB液体培养基中富集12 h,然后各吸取1 mL菌液分别接种于20 mL分别含有纤维素、果胶、淀粉的液体培养基中(夏晓峰, 2014; 薛志静等, 2017)。将以上液体培养基置于恒温培养箱,30 ℃培养3天,以不加菌的培养基作为对照。分别于培养24、36、48、60、72 h时吸取菌液2 mL,12 000 r·min-1离心10 min,取上清液1 mL,釆用二硝基水杨酸法(DNS比色法),使用紫外可见分光光度计(岛津UV-2450)检测波长为550 nm下的吸光值。测定数据采用Excel和Origin软件进行分析和作图。
1.4 肠道细菌对杜仲叶成分的影响
采集新鲜的杜仲叶晾干后粉碎,称取10 g杜仲粉放入烧杯中,加入1 000 mL蒸馏水充分搅拌,分装入10个50 mL三角瓶(各装20 mL)中高压灭菌(121 ℃,15 min),即得杜仲液体培养基。分别在杜仲液体培养基中接入前期富集好的10株细菌液1 mL,不加菌的杜仲叶溶液作为对照,30 ℃培养,72 h后各吸取样品2 mL,12 000 r·min-1离心10 min,取上清夜用0.22 μm滤膜过滤,取滤液在高效液相色谱仪(日立L2000)上检测,比较分析接菌前后杜仲叶成分变化。
色谱条件: 色谱柱,Kromasil 100-5C18250 mm × 4.6 mm; 流动相A为0.1%磷酸,流动相B为甲醇; 流速1 mL·min-1; 检测波长200~400 nm; 柱温30 ℃; 进样量2 μL。梯度洗脱程序: 0~6 min,A(%)6~6,B(%)94~94; 6~13 min,A(%)6~13,B(%)94~87; 13~22 min,A(%)13~20,B(%)87~80; 22~30 min,A(%)20~24,B(%)80~76; 30~45 min,A(%)24~35,B(%)76~65; 45~46 min,A(%)35~45,B(%)65~55; 46~60 min,A(%)45~50,B(%)55~50。
1.5 抗生素处理对杜仲梦尼夜蛾幼虫生长发育的影响
为了揭示肠道菌群对杜仲梦尼夜蛾幼虫生长和发育的影响,采用抑菌圈法和微量肉汤法,参照CLSI 药敏试验标准(CLSI, 2012a; 2012b),从10种抗生素(庆大霉素、红霉素、链霉素、氯霉素、诺氟沙星、四环素、卡那霉素、环丙沙星、阿莫西林、克拉霉素)中筛选出最适的抗生素及其浓度,确定1 μg·mL-1的氯霉素可基本清除幼虫的肠道细菌。
收集产卵时间一致的卵块放置于培养皿中,获得孵化期一致的初孵幼虫。将初孵幼虫放置于玻璃试管(φ=10 mm)中,每管2头,共30管。将新鲜的杜仲叶用1 μg·mL-1氯霉素浸泡10 min,晾干后用打孔器(φ=10 mm)打成圆片,称重后饲喂15管幼虫,作为处理组; 用无菌水浸泡过的杜仲叶圆片饲喂另外15管幼虫,作为对照组。
每天定时进行观察、测量和称质量,分别记录幼虫的发育历期、体长、头宽、幼虫体质量、排粪量和取食量。按照以下公式计算各个营养指标(Thakuretal., 2016):
幼虫相对生长率(RGR)=G/(B×T);
消耗指数(CI)=I/(B×T), 食物利用率(ECI)=G/I;
食物转化率(ECD)=G/(I-F), 近似消耗率(AD)=(I-F)/I。
式中,G为虫体质量增加值(即G=饲后幼虫质量-饲前幼虫质量);I为幼虫的取食量(即I=饲前食物质量-饲后食物质量);F为粪便质量;B为试验期间幼虫的平均体质量,B=(饲前幼虫质量+饲后幼虫质量)/2;T为试验天数。
用Excel和SAS 9.2软件进行数据分析。
2 结果与分析
2.1 杜仲梦尼夜蛾幼虫消化道可分离培养的细菌种类
利用3种培养基,从杜仲梦尼夜蛾肠道中分离到10种不同形态的菌落,提取它们的基因组DNA进行PCR扩增和测序,得到其16S rRNA基因序列。将序列在NCBI数据库中比对(表1)和构建ML系统进化树(图1),结果表明,它们属于变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)的10个属的细菌,分别是短波单胞菌属(Brevundimonas)、肠球菌属(Enterococcus)、假单胞菌属(Pseudomonas)、鞘氨醇单胞菌属(Sphingomonas)、克吕沃尔菌属(Kluyvera)、不动杆菌属(Acinetobacter)、莫拉菌属(Moraxella)、土壤杆菌属(Agrobacterium)、微杆菌属(Microbacterium)和节杆菌属(Arthrobacter)。
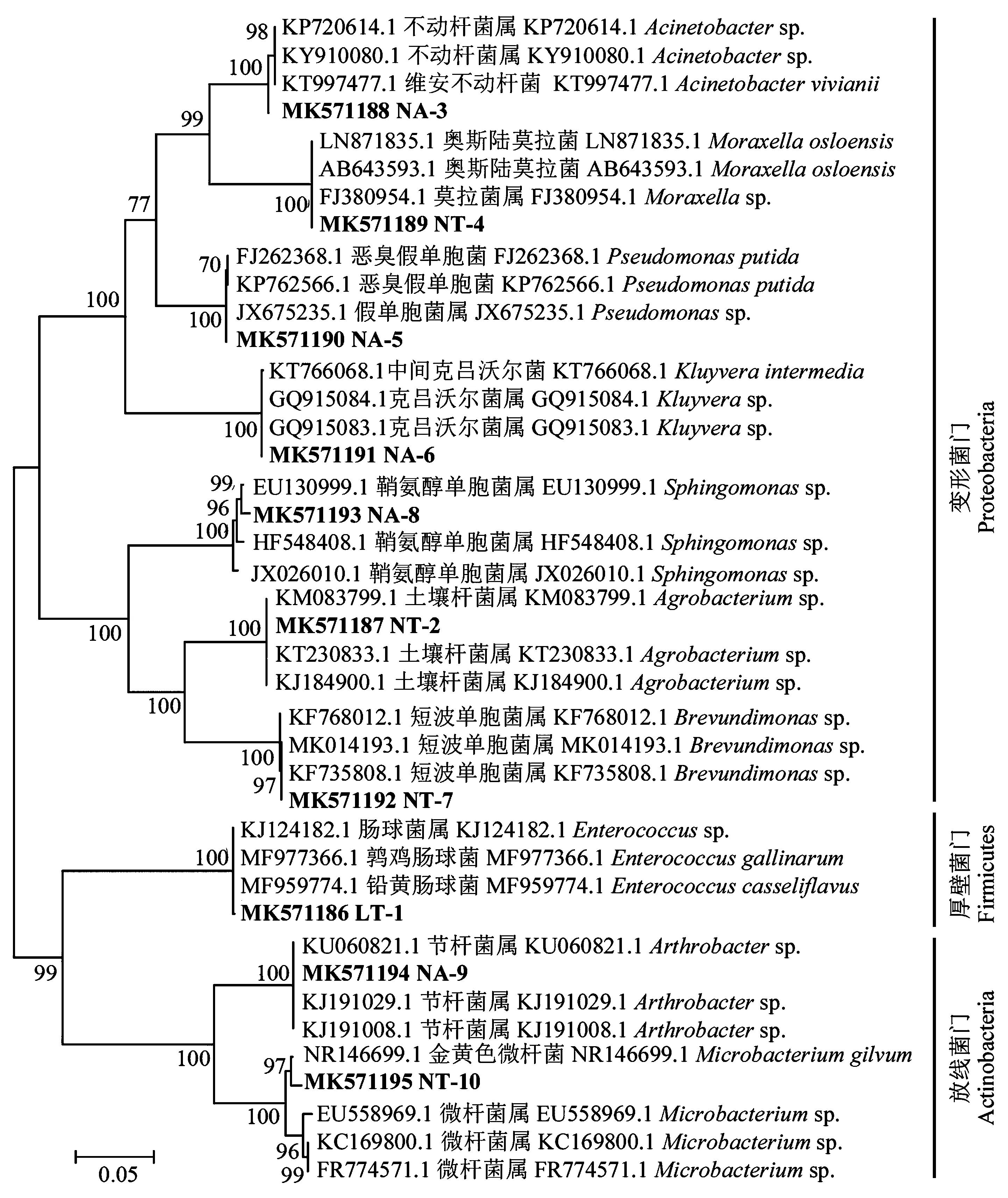
图1 杜仲梦尼夜蛾肠道可分离培养细菌的系统发育分析Fig.1 Phylogenetic analysis of culturable bacteria isolated from the larval guts of O. songi采用软件 MEGA 6.0 中的最大似然法构建而得的系统发育树,模型为K+2G,自展值为1 000; 标尺0.05表示核苷酸位点的平均替代数。The phylogenetic tree was generated using the Maximum Likelihood method with 1 000 bootstraps and K+2G model on MEGA6.0 software. The scale bar represents 0.05 substitution per nucleotide position.

表1 杜仲梦尼夜蛾幼虫肠道细菌的分离鉴定Tab.1 Isolation and identification of bacteria from the larval guts of O. songi
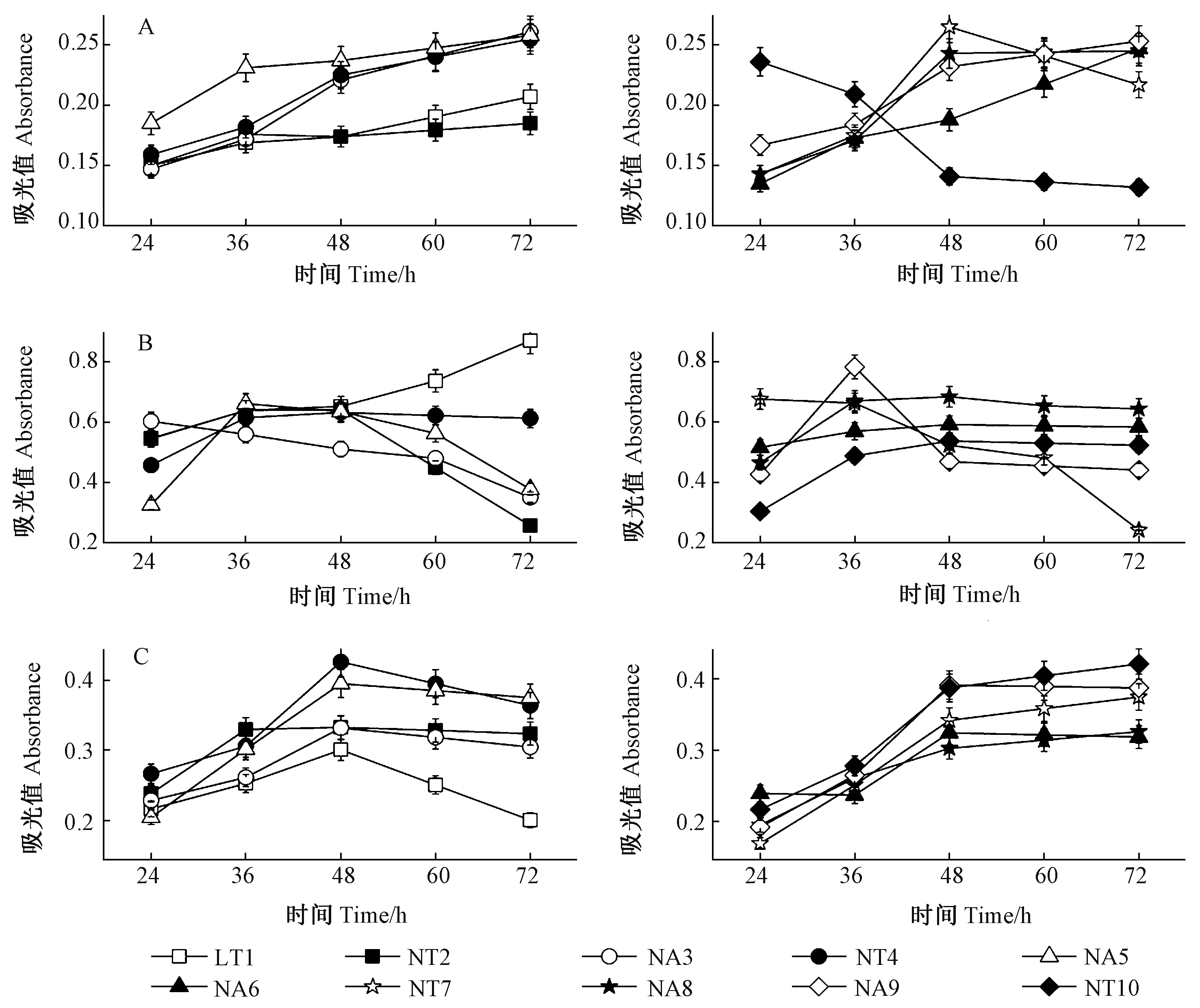
图2 杜仲梦尼夜蛾肠道分离细菌对纤维素(A)、果胶(B)和淀粉(C)的降解能力Fig.2 Biodegradation activity of the gut bacteria isolated from the larvae of O. songi on cellulose(A), pectin(B), and starch(C)
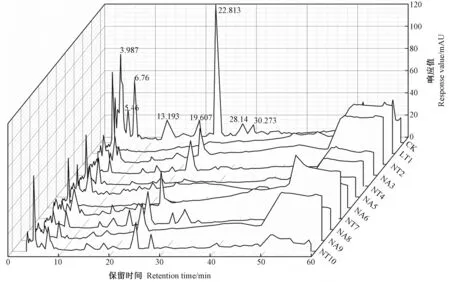
图3 杜仲梦尼夜蛾幼虫肠道细菌对杜仲叶化学成分的影响Fig.3 Effects of gut bacteria isolated from larval guts of O. songi on chemical constituents of E. ulmoides leaves
2.2 肠道细菌对纤维素、果胶和淀粉的降解作用
采用DNS法测定幼虫肠道细菌对淀粉、纤维素和果胶的降解作用,结果表明10株细菌对3种大分子物质降解能力存在差异(图2)。
将10株菌分别加入纤维素培养液后,菌株NT7吸光值呈现先上升后下降的趋势,表明该菌株可在较短时间内分解完培养液中的纤维素,具有很强的降解能力; 8个菌株(LT1、NT2、NA3、NT4、NA5、NA6、NA8和NA9)的吸光值均呈现持续上升的趋势,表明培养液中还原糖含量不断上升,菌株在测定时间内仍未完全降解纤维素,降解能力相对较弱; 菌株NT10的吸光值一直呈递减趋势,表明其只消耗了培养液中原有的单糖,但没有降解纤维素生成新的单糖,无降解纤维素的能力(图2A)。
将10株菌分别加入果胶培养液后,6个菌株(NT2、NT4、NA5、NA6、NA8和NT10)的吸光值趋势表现为先上升后下降,对果胶具有较强的降解能力; 菌株LT1的吸光值呈现一直上升趋势,对果胶的降解能力相对较弱; 菌株NA3与NT7表现为吸光值持续下降,对果胶无降解能力(图2B)。
在淀粉培养液中加入菌液后,10株菌均有降解淀粉的能力,其中,6个菌株(LT1、NT2、NA3、NT4、NA5和NA6)的吸光值表现为先上升后下降,降解淀粉的能力较强; 4个菌株(NT7、NA8、NA9和NT10)的吸光值持续上升,降解淀粉的能力相对较弱(图2C)。
因此,10个菌株中,菌株NT10(微杆菌)对纤维素无降解作用,菌株NA3(不动杆菌)与菌株NT7(短波单胞菌)对果胶无降解作用,其余菌株均对纤维素、果胶和淀粉具有一定的降解能力。
2.3 杜仲梦尼夜蛾肠道细菌对杜仲叶成分的影响
在杜仲叶培养液中加入肠道细菌后,进行高效液相色谱分析。结果显示(图3),在加入10个菌株的样品图谱中,绝大多数特征吸收峰的保留时间与对照图谱一致,但一些特征吸收峰上的物质含量明显降低,甚至一些吸收峰消失,如保留时间在3.987、6.76、13.193、19.607、22.813、30.273的吸收峰。这表明杜仲液接入细菌后,经过微生物的降解作用,杜仲叶中的某些成分可能被细菌分解或利用,导致其成分发生了变化。
2.4 肠道细菌对幼虫生长发育及营养利用的影响
2.4.1 肠道细菌对幼虫生长发育的影响 抗生素处理对幼虫的发育和生长均产生一定的影响(表2)。抗生素处理组,幼虫发育历期约为22.87天,较对照组(约21.7天)延长了1天; 抗生素组每龄幼虫的头宽、体长、体质量均低于对照组,但差异不显著(P>0.05); 但后期抗生素处理组的幼虫化蛹率(10%)显著低于对照组的化蛹率(86.67%),表明抗生素处理对幼虫的正常化蛹产生明显影响。
2.4.2 肠道细菌对幼虫营养指标的影响 与对照相比,抗生素处理组幼虫相对生长率(RGR)、食物利用率(ECI)和食物转化率(ECD)普遍降低(表3),尤其在1~4龄幼虫中降低幅度较大,差异达到显著水平(P<0.05),而5~6龄幼虫的降低幅度较小,没有达到显著水平(P>0.05)。抗生素处理组幼虫的消耗指数(CI)和近似消耗率(AD)均稍高于对照组,但差异不显著(P>0.05)。这表明抗生素处理后,影响了正常的肠道菌群,从而导致幼虫取食和消化能力降低,对营养的利用能力减弱,需消耗更多的食物,尤其对低龄幼虫的影响更为显著。
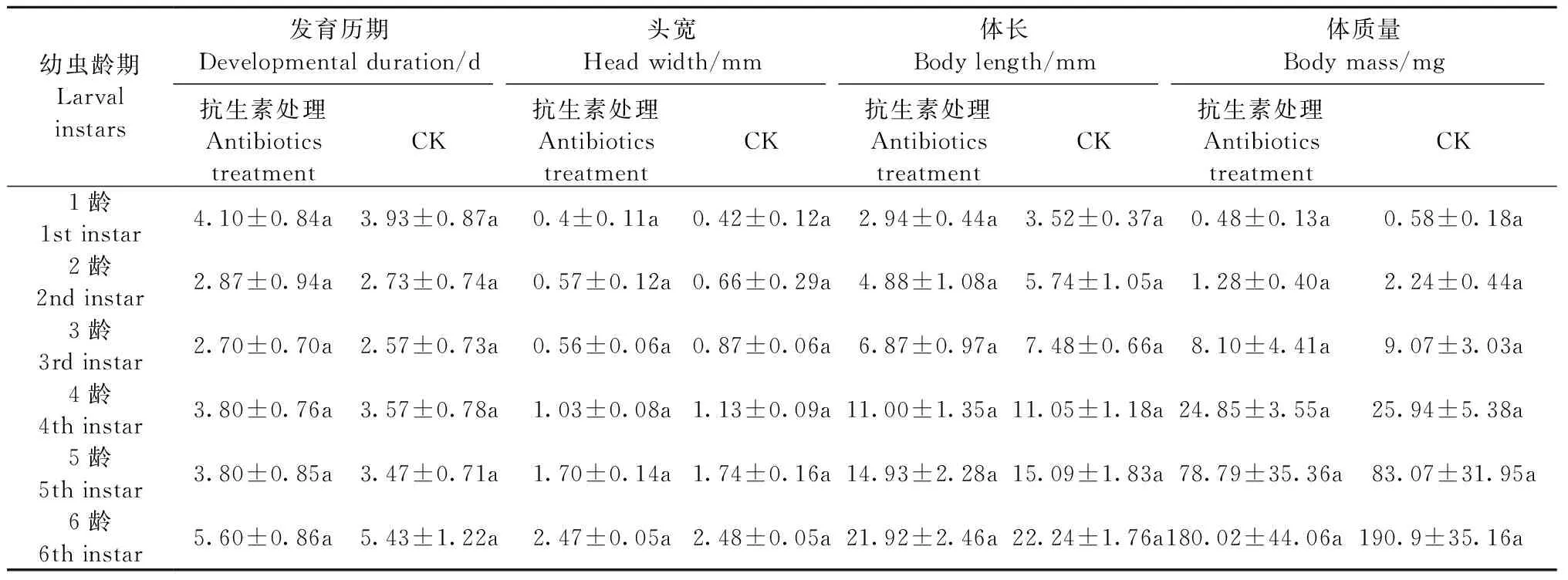
表2 抗生素处理对杜仲梦尼夜蛾幼虫生长发育的影响①Tab.2 Effects of antibiotic treatment on the growth and development of O. songi larvae
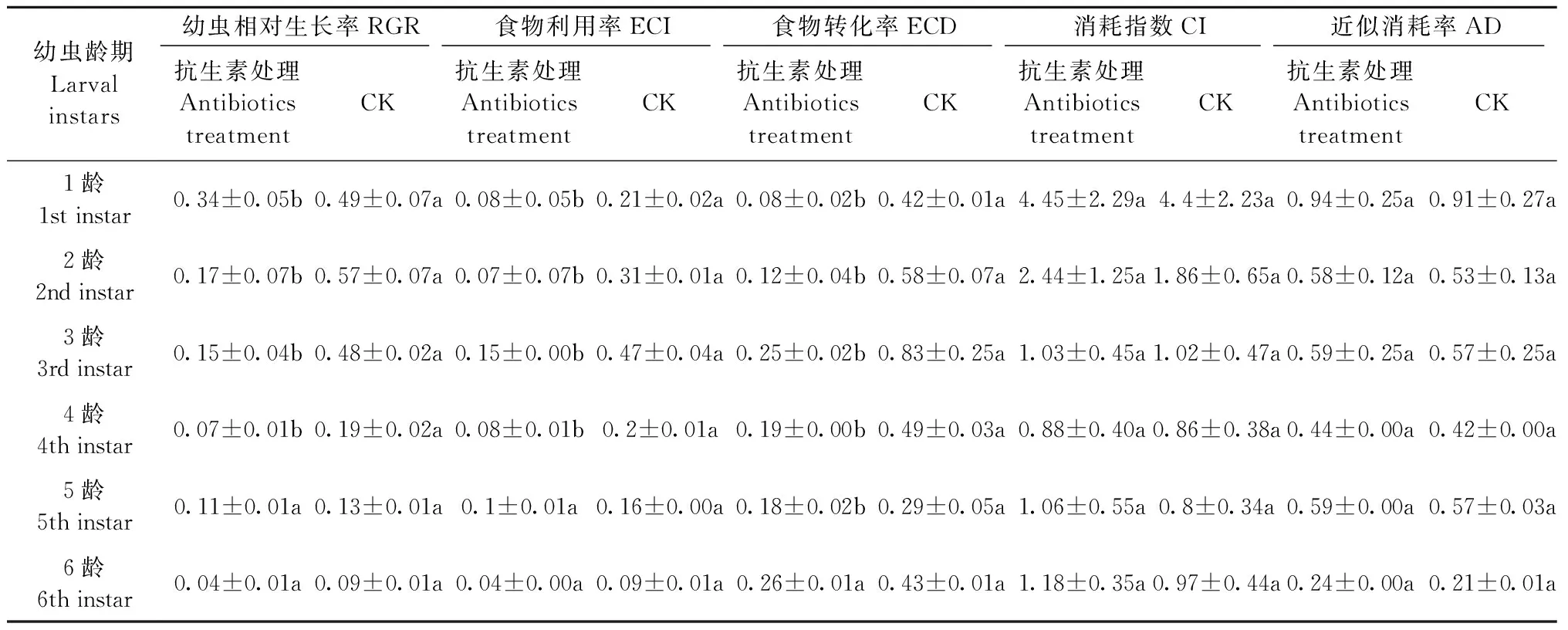
表3 抗生素处理对杜仲梦尼夜蛾幼虫营养指标的影响Tab.3 Effects of antibiotic treatment on nutritional indices of O. songi larvae
3 讨论
本研究进行了杜仲梦尼夜蛾幼虫肠道细菌的分离鉴定,并对其功能进行了初步的研究。利用3种培养基从幼虫肠道分离获得10株不同形态的细菌,分子鉴定表明它们隶属于变形菌门、厚壁菌门和放线菌门的10个属细菌,其中变形菌门为优势菌群。在门水平的菌群组成与其他鳞翅目昆虫如舞毒蛾(Lymantriadispar),棉铃虫(Helicoverpaarmigera),烟草天蛾(Manducasexta)和斜纹夜蛾(Spodopteralittoralis)的研究结果比较相似(Brodericketal., 2004; Xiangetal., 2006; Brinkmannetal., 2008; Tangetal., 2012)。但在属的水平上,笔者从杜仲梦尼夜蛾幼虫肠道获得10株不同属的细菌,包括短波单胞菌、肠球菌属、假单胞菌属、鞘氨醇单胞菌、克吕沃尔菌属、不动杆菌属、莫拉菌属、土壤杆菌属、微杆菌属和节杆菌属,这与其他鳞翅目昆虫可培养肠道菌的组成存在明显差异,如家蚕(Bombyxmori)肠道可培养菌群主要由嗜糖假单胞菌属(Pelomonas)、罗尔斯通菌属(Ralstonia)、葡萄球菌属(Staphylococcus)和不动杆菌属组成(Liangetal., 2014); 小菜蛾(Plutellaxylostella)肠道可培养细菌主要有沙雷氏菌属(Serratia)、肠杆菌属(Enterobacter)、寡养单胞菌(Stenotrophomonas)以及类香味菌属(Myroides)(夏晓峰等, 2013); 棉铃虫肠道中分离到鞘氨醇单胞菌属(Sphingomonas)、肠杆菌属(Enterobacter)、不动杆菌和拟杆菌属(Bacteroides)的细菌(Priyaetal., 2012)。这些差异应该与这些鳞翅目昆虫取食不同的寄主植物密切相关,但杜仲梦尼夜蛾幼虫肠道更为丰富的菌群是否与其能消化利用含胶的杜仲叶相适应还有待于进一步的研究验证。
淀粉是植物中主要的能量储备物质,纤维素和果胶是植物细胞壁的主要成分(贺学礼, 2011)。植食性昆虫肠道内定殖的细菌可以将这些大分子物质分解成小分子单糖供寄主吸收和利用(Dillonetal., 2004; Anandetal., 2010)。透明圈法通常用于研究细菌对生物大分子的降解作用,Anand 等(2010)利用该方法发现家蚕肠道中的假单胞菌具有很强的降解果胶的能力,Dantur 等(2015)研究发现小蔗杆草螟(Diatraeasaccharalis)肠道的肠球菌对纤维素有降解作用,郑亚强等(2017)从马铃薯块茎蛾(Phthorimaeaoperculella)肠道中筛选出可以降解淀粉的鞘氨醇杆菌和节杆菌。这种方法虽然可以简单快速的筛选出降解大分子的菌株,但缺点是有些微生物具有降解色素的能力,它们在培养过程中会形成明显的透明圈,与具有降解能力的菌株不易区分,出现假阳性反应(居乃琥, 2011)。DNS法的原理是利用二硝基水杨酸(DNS)在碱性条件下与还原糖发生反应生成3-氨基-5-硝基水杨酸,该产物在煮沸条件下显棕红色,且颜色深浅与还原糖含量成比例关系,然后用比色法测定还原糖含量,因其简单准确,对还原糖的种类没有选择性,适用于多糖(如纤维素、果胶和淀粉等)水解产生多种还原糖体系的检测(白玲等, 2004)。本研究采用DNS法,结合样品0~72 h吸光值(代表还原糖的浓度)的变化趋势来揭示肠道菌株对3种大分子的降解能力,吸光值结果表现3种变化趋势: 1)吸光值持续下降(还原糖浓度降低),表明溶液中没有还原糖生成,只有还原糖的消耗,菌株对大分子无降解能力; 2)吸光值持续上升,表明菌株能够将溶液中的多糖分解为还原糖,导致还原糖浓度增加,但液体中的多糖未被降解完,表明菌株对大分子有一定的降解能力; 3)吸光值先上升后又下降,表明菌株在短时间内分解完多糖,导致还原糖浓度上升,然后又开始利用消耗单糖,导致还原糖浓度下降,表明菌株具有较强的降解能力。因此,可以初步推断菌株NT10(微杆菌)对纤维素无降解作用,菌株NA3(不动杆菌)与菌株NT7(短波单胞菌)对果胶无降解作用,其余菌株均对纤维素、果胶和淀粉均具有一定的降解能力。
此外,一些肠道菌能够帮助宿主昆虫防御植物的有毒次生代谢物质,在植食性昆虫与寄主植物的协同进化中发挥重要作用(Engeletal., 2013)。例如,寄主植物在遭受甜菜夜蛾(Spodopteraexigua)幼虫取食时会释放N-酰基氨基酸,不仅影响幼虫的消化功能,而且可以产生能够吸引天敌的挥发性物质,而从其幼虫前肠分离的一株微杆菌属细菌可以产生N-酰基氨基酸水解酶,帮助分解这些防御诱导物质,从而影响植物防御反应(Pingetal., 2007)。舞毒蛾幼虫肠道内的不动杆菌能够降解欧洲山杨(Populustremuloides)分泌的酚苷类化合物,保护宿主不受毒害(Masonetal., 2016)。毛健夜蛾(Brithyscrini)肠道内的克雷伯氏菌属(Klebsiella)和棒状杆菌属(Corynebacterium)能够降解食物中的生物碱,大戟天蛾(Hyleseuphorbiae)肠道中的类诺卡氏菌(Nocardioides)、戈登氏菌(Gordonia)和短小杆菌(Curtobacterium)则能够耐受植物分泌的乳胶,对昆虫的肠道起到保护作用 (Vilanovaetal., 2016)。杜仲叶除了富含绿原酸、京尼平苷酸、桃叶珊瑚苷、芦丁、槲皮素等多种有效成分外,还含有特征物质杜仲胶(曾桥等, 2017)。笔者通过高效液相色谱法检测了杜仲梦尼夜蛾幼虫肠道菌对杜仲叶化学成分的影响,结果发现一些物质的吸收峰降低、甚至消失,说明肠道菌对某些物质产生影响,这种影响可能是将一些大分子物质如多糖和蛋白分解为单糖和氨基酸供自身利用,也可能是分解了杜仲叶中的有毒成分,降低对自身的毒害作用。还需通过标准品比对,深入揭示肠道菌对杜仲叶片中特定化学成分的影响,尤其是否对杜仲胶具有降解作用。
在营养供应和消化中具有关键作用的肠道细菌通过促进营养的吸收影响宿主昆虫的发育和健康(Paniaguaetal., 2018)。笔者通过喂食抗生素消除杜仲梦尼夜蛾幼虫肠道菌群,研究结果显示处理组幼虫的相对生长率、食物转化率与利用率均低于对照组,而消耗指数与近似消耗率则高于对照组。这可能是由于缺乏肠道细菌共生体,寄主昆虫无法将摄取的食物顺利转化为它们所需的营养,导致食物转化率和利用率降低,必须靠摄入更多的食物来维持机体需要,因而导致消耗指数与近似消耗率升高。相似的规律也在地中海粉螟(Ephestiakuehniella)和小菜蛾肠道细菌的功能研究中发现(Goharrostamietal., 2018; 沈金红等, 2018)。但一些研究认为利用抗生素处理昆虫来评价肠道微生物必须充分考虑抗生素对宿主昆虫的直接效应(刘凌云等, 2015),所以下一步需要将这些肠道菌喂食给抗生素处理后的幼虫,观察是否能促进幼虫生长发育和对食物的转化和利用率,验证肠道菌的功能。
本研究仅利用传统分离培养方法进行了肠道细菌的分离,并对获得的菌株进行功能的初步研究。但由于分离培养的方法仅能分离出约1%的肠道细菌(叶姜瑜等, 2004),后续仍需借助高通量测序、宏基因组或微生物组等方法全面揭示其肠道细菌的组成、变化规律,深入揭示肠道微生物在该种昆虫与杜仲协同进化中的代谢机制。同时,继续开展肠道菌的功能研究,揭示其对杜仲叶成分、杜仲胶结构的影响; 对功能明显的菌株进行种的鉴定和理化性质分析; 也可通过人为的调控或改良杜仲梦尼夜蛾幼虫肠道细菌组成,或改变某种细菌在肠道内的数量或者密度打破其肠道微生态平衡,寻找控制其种群密度和防治害虫的新方法。
4 结论
杜仲梦尼夜蛾幼虫肠道中可分离培养的10株细菌分别隶属于变形菌门、厚壁菌门和放线菌门的10个属,包括短波单胞菌属、肠球菌属、假单胞菌属、鞘氨醇单胞菌属、克吕沃尔菌属、不动杆菌属、莫拉菌属、土壤杆菌属、微杆菌属和节杆菌属。大部分菌株对生物大分子(纤维素、果胶和淀粉)均有不同程度的降解作用,并显著影响杜仲叶中成分的变化。饲喂抗生素消除肠道菌群可影响幼虫的生长发育,显著降低幼虫的化蛹率和低龄幼虫的取食和消化能力。因此,肠道细菌在杜仲梦尼夜蛾幼虫的生长发育、食物消化、营养物质利用等方面发挥着重要作用。

