杉木不同世代育种群体的遗传多样性*
李 霞 王利宝 文亚峰 林 军 武星彤 袁美灵 张 原 王敏求 李鑫玉
(1. 中南林业科技大学风景园林学院 长沙 410004; 2. 广西国有东门林场 崇左 532108; 3. 中南林业科技大学林学院 长沙 410004; 4. 广东省乐昌市龙山林场 乐昌 512200)
人工林是森林资源的组成部分,在木材生产、生态环境保护以及景观建设中具有重要功能和作用(刘世荣等, 2018)。人工林可持续经营中,生物多样性,特别是遗传多样性(genetic diversity)的保护和保持是一项非常重要的内容。对生命周期相对较长的林木来说,遗传多样性决定了它适应环境的能力,是维持森林生态系统长期稳定的基础,其对林木良种选育、营林措施的制定以及森林资源的保护、利用等具有重要意义(盛炜彤, 2018; Booyetal., 2010; Loweetal., 2004)。
人工林的遗传多样性受育种(造林)材料本身特性、资源分布、环境条件、人为干扰等因素的影响(Lefévre, 2004),其中育种(造林)材料是最为关键的因素,它直接决定了人工林遗传多样性的高低,而其他因素是通过间接作用对人工林遗传多样性产生影响(文亚峰等, 2010)。随着人工林可持续经营理念的提出和发展,遗传多样性水平作为一个重要指标越来越多地被用于评价林木种子质量(张泽宁等, 2008)。国内外林木良种选育基本上是沿着选优、建园、子代测定、再选择、再建园的轮回选择路线,从低世代向高世代育种群体发展。育种材料的选择及有效群体的确立不仅为林木遗传改良和良种生产提供了重要途径,而且能在保持人工林遗传多样性方面起到有效的积极作用。林木育种群体的遗传多样性在马尾松(Pinusmassoniana)(朱必凤等, 2007)、红松(Pinuskoraiensis)(冯富娟等, 2007)、湿地松(Pinuselliottii)(易能君等, 2000)等树种中有一定研究。马尾松种子园的遗传多样性研究表明,表型选择不会显著降低育种群体的遗传多样性水平,有的甚至具有比亲本或天然群体更高的遗传多样性(金国庆等, 2019; 赖焕林等, 1997)。相关研究进一步表明,在确立和管理林木育种群体过程中,选择遗传基础较宽的、育种群体数量较大的、管理措施科学的育种材料有利于从源头上保证和维持人工林群体的遗传多样性水平。
杉木(Cunninghamialanceolata)作为我国南方最重要的商品用材树种,其遗传改良走在其他树种的前列,14个杉木分布省(区)已开展了优树选择、优良基因收集、育种群体建立、子代测定等工作,积累了有关遗传方差、配合力、交互作用和稳定性分析等方面的大量数据(俞新妥, 2000; 2006)。目前,大部分杉木分布省(区)的育种群体已从1代、1.5代发展到第2代,并且已获得第3代育种群体(郑仁华等, 2014)。虽然育种材料的遗传变异引起了很大关注,但杉木育种群体的遗传多样性研究不足,特别是多世代育种群体间遗传多样性的动态变化研究更是缺乏。基于此,本研究以我国2个国家级杉木良种基地的育种群体为研究对象,采用核基因组和叶绿体基因组微卫星(SSR)标记技术,解析杉木不同世代育种群体的遗传多样性变化规律,检测群体遗传结构及其基因流,为我国杉木长期育种和人工林可持续高效经营提供科学依据。
1 材料与方法
1.1 试验材料
选择湖南攸县杉木良种基地(YX,27°18′N,113°47′E)和广东乐昌市龙山杉木良种基地(LC,25°12′N,113°28′E)的育种群体为研究材料。2个基地均属于国家重点杉木良种基地,攸县基地建于1976年,占地40 hm2,建有1代(F1)、1.5代(F1.5)和2代(F2)育种群体,初级建园材料以湖南、安徽、广东、福建、湖北等地的杉木种源为主。乐昌市龙山基地建于1981年,占地45.5 hm2,建有1代、2代、2.5代(F2.5)和3代(F3)育种群体,初级建园材料以广东、广西、福建、贵州和湖南等地的杉木种源为主。
采样方式以不同世代育种群体为单位,建园材料全部采集,每个无性系采1株。攸县育种群体采集F1、F1.5和F2材料样本183份,乐昌育种群体采集F1、F2、F2.5和F3材料样本337份(表1),7个育种群体根据来源地不同分为攸县(YX)和乐昌(LC)2个组群。所有材料样本采集新鲜幼嫩叶,硅胶干燥保存。杉木基因组DNA提取按Wen等(2013)的方法,利用紫外分光光度计检测DNA质量。

表1 杉木育种群体材料的来源及数量Tab.1 The sources and sample number of Chinese fir breeding populations
1.2 微卫星位点筛选与基因分型
1.2.1 核基因组SSR位点 从杉木(Wenetal., 2013)和日本柳杉(Cryptomeriajaponica)(Uenoetal., 2012)已开发的EST-SSR位点中筛选获得18个多态性较高的位点用于试验分析(表2)。PCR反应体系和条件根据QIAGEN®多重PCR试剂盒的说明进行适当调整。多重PCR反应体系(10.0 μL) 中含2×Multiplex PCR master混合液5.0 μL,10×引物混合液1.0 μL,5~10 ng·μL-1的DNA模板1.0~2.0 μL(根据引物数量进行调整)。10×引物混合液由5~6个候选位点引物混合而成,其中含0.5~2.0 μmol·L-1的荧光标记通用引物(文亚峰等, 2015)、2.0 μmol·L-1正向引物(F)和2.0 μmol·L-1反向引物(R)。PCR反应程序为: 95 ℃预变性15 min; 94 ℃变性30 s,60 ℃退火90 s,72 ℃延伸60 s,共35个循环; 60 ℃延伸30 min。PCR扩增产物用2.0%琼脂糖凝胶电泳检测。扩增成功的多重PCR产物稀释5~10倍后,在ABI3730自动测序仪上基因分型(Liz 600 为内标),利用GENEMAPPER v. 3.7分析基因分型结果。
1.2.2 叶绿体基因组SSR位点 2个多态性位点CJCP1m_004 和 CJCP2m_002源于日本柳杉(文亚峰等, 2014),正向引物5′端以FAM荧光标记后用于PCR扩增。PCR扩增体系和条件按 QIAGEN®多重PCR试剂盒方法并作适当调整。6.0 μL扩增体系中含1× PCR混合液3.0 μL、0.2 μmol·L-1正向和反向引物混合液1.0 μL、5~10 ng·μL-1的DNA 模板1.0~2.0 μL。PCR反应条件为: 95 ℃预变性15 min; 94 ℃变性 30 s,55 ℃退火90 s,72 ℃延伸60 s,共35个循环; 60 ℃延伸30 min,利用2.0%的琼脂糖凝胶电泳检测扩增条带。PCR片段基因分型在ABI3730自动测序仪上进行(Liz 600 为内标),利用GENEMAPPER v. 3.7分析基因分型结果。
1.3 数据分析
1.3.1 核基因组SSR数据 采用GENALEX 6.3(Peakall, 2006)统计各群体的等位基因数(Na)、私有等位基因数(Npa)、观测杂合度(Ho)和期望杂合度(He)。Fstat 2.9.3(Goudet, 1995)软件估算各群体的等位基因丰富度(AR)、不同育种群体间的遗传分化系数(Fst)、近交系数(Fis)。育种群体总体基因流(花粉和种子)根据公式Nm=(1/Fst- 1)/4计算获得。利用STRUCTURE 2.3.3 (Pritchardetal., 2000)进行群体遗传结构分析,K值设定为1~7, 每个值运算10次,设置Burn in Period和MCMC (Markov Chain Monte Carlo)的迭代参数分别为50 000和100 000,将所得数据提交到STRUCTURE HARVESTER (Earletal., 2012),根据ΔK数值的分布确定最优基因库数K值。为使STRUCTURE图示更为直观,利用Clumpp软件处理10次独立运算数据,然后使用Distruct将计算结果图形可视化输出。Arlequin 3.0(Excoffieretal., 2005)对群组间、群体间和群体内的遗传变异进行巢式分子方差分析(AMOVA)。
1.3.2 叶绿体基因组SSR数据 利用Haplotype Analysis1.05(Eliadesetal., 2009)软件进行单倍型分析,估算不同群体的单倍型数量(A)、有效单倍型数(Ne)、私有单倍型数(P)、单倍型丰富度(Rh)、遗传多样性指数(H)和群体分化系数(Fst)。种子介导的基因流根据公式Nm=(1/Fst- 1)/2计算获得。
2 结果与分析
2.1 育种群体的遗传多样性与遗传分化
EST-SSR标记结果表明,杉木育种群体的总体遗传多样性(Ht)为0.687,群体间遗传分化系数(Fst)为0.012,育种群体的近交系数(Fis) 为0.028(表2)。攸县(YX)和乐昌(LC)组群都具有较高的遗传多样性,观测杂合度(Ho)分别为0.671和0.656,期望杂合度(He)达到了0.678和0.667。以乐昌组群F2.5代的样本数为最小参数(33),2个组群的等位基因丰富度(AR)分别为7.715和7.293。攸县和乐昌组群的遗传分化系数(Fst)相同,都为0.008,组群内不同世代育种群体间没有显示出较大的遗传分化。2个组群的近交系数分别为0.023和0.034(表3)。Fstat双侧检验结果表明,攸县和乐昌组群的等位基因丰富度(AR)、观测杂合度(Ho)和近交系数(Fis)均没有显著性差异(P>0.05)。
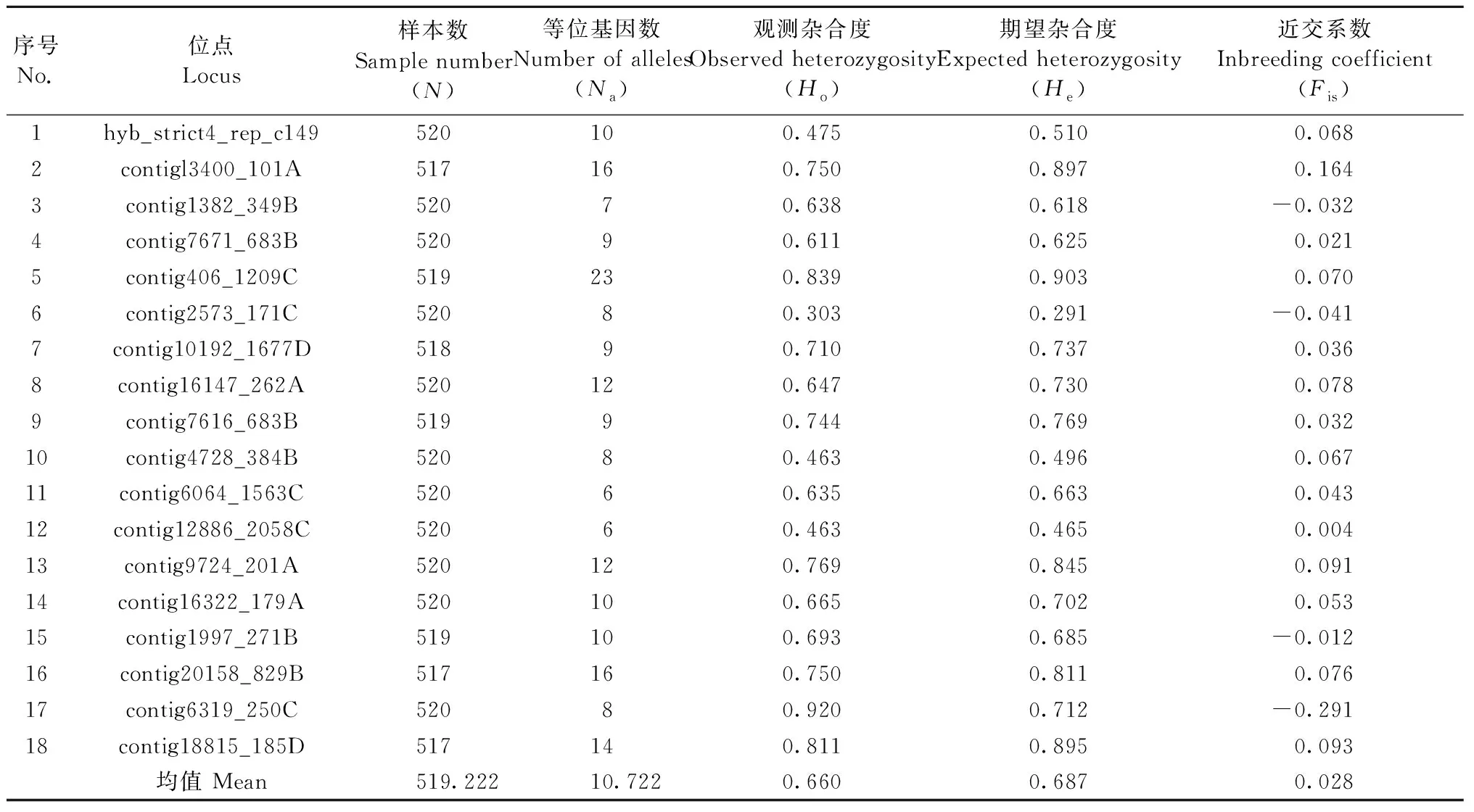
表2 18个EST-SSR位点的遗传多样性参数Tab.2 Genetic diversity parameters of 18 EST-SSR loci
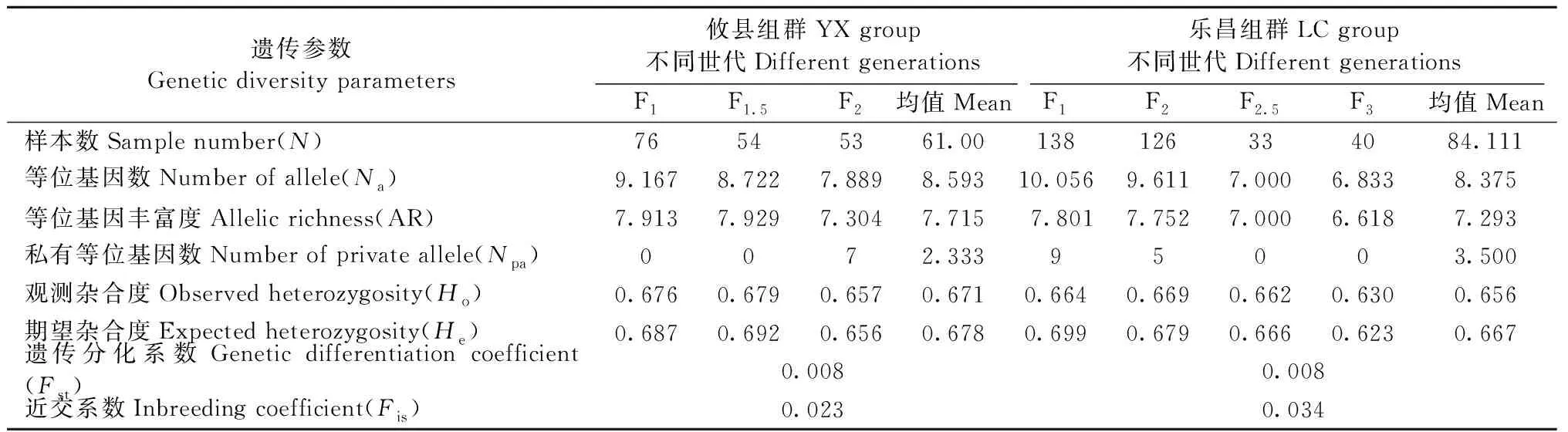
表3 杉木不同世代育种群体基于EST-SSR的遗传多样性参数Tab.3 Genetic diversity parameters of different generations of breeding populations based on EST-SSR
2个cp-SSR位点分别检测到2个和8个单倍型,2位点组合后共检测到11个单倍型,攸县(YX)和乐昌(LC)组群分别为8个和11个(表4)。杉木育种群体的总多样性指数(Ht)为0.524,遗传分化系数(Fst)为0.031。攸县和乐昌组群的遗传多样性指数(H)分别为0.541和0.507,遗传多样性较为相近,但单倍型丰富度(Rh)存在较大差异,攸县组群高于乐昌组群,分别为4.923和4.233。攸县组群内群体间的遗传分化高于乐昌组群,Fst分别为0.017和0.014(表5)。

表4 杉木育种群体的单倍型信息Tab.4 Haplotype information in Chinese fir breeding populations
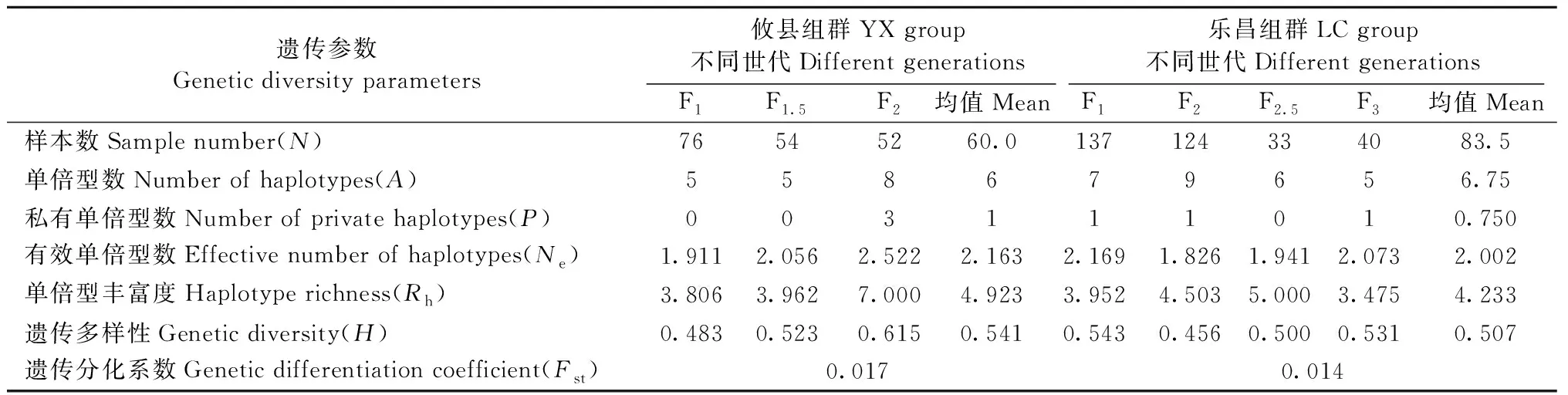
表5 杉木不同世代育种群体基于叶绿体SSR的遗传多样性参数Tab.5 Genetic diversity parameters of different generations of breeding populations based on cpSSR
2.2 育种群体的遗传结构与基因流
核基因组微卫星AMOVA分析结果显示,遗传变异主要存在于各世代群体内,群体内遗传变异占总遗传变异的98.57%,组群间和不同世代群体间的遗传变异占总遗传变异的0.62%和0.81%(表6)。STRUCTURE分析结果(图1)显示,当K=2时出现明显的拐点且取得最大值,说明7个世代育种群体最有可能被分为2个基因库(gene pool)(图1A、B)。K=2时,攸县组群大部分被划分到基因库1(绿色)中,乐昌组群在基因库1和基因库2(红色)中各占一半,群体间或群体内都显示出较高的杂合度; 2个组群低世代群体的相似性程度高,但高世代群体的基因库存在较大差异(YX F2和LC F3);K=3时,2个组群都有新的基因库3(蓝色)出现,但YX F2的基因库组成变化更为明显;K=4时,2个组群都有新的基因库4(黄色)出现,总体组群类似于K=3时情况(图1C)。2个组群单独STRUCTURE分析结果(YX和LC)也显示,攸县和乐昌组群遗传结构的差异主要出现在高世代育种群体。基因流检测结果表明,2个组群的总体基因流相同,达到了31.0,而种子介导的基因流存在一定差异,攸县和乐昌组群分别为28.9和35.2。
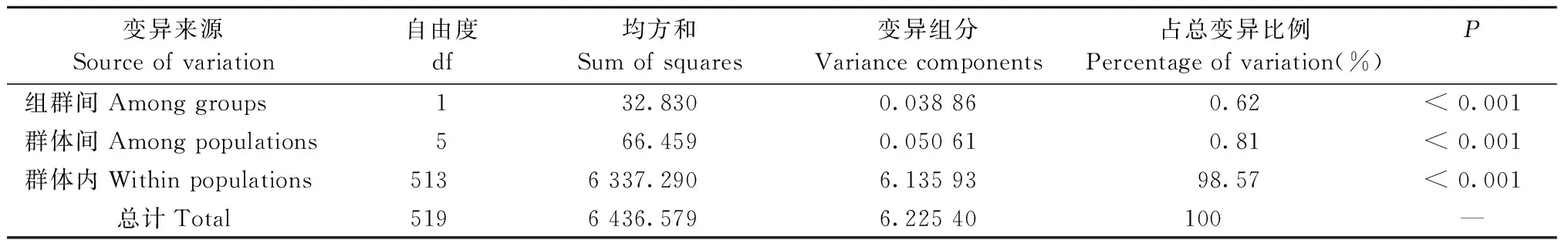
表6 杉木育种群体的分子方差分析(AMOVA)Tab.6 Analysis of molecular variance (AMOVA) of Chinese fir breeding populations
2.3 不同世代育种群体的遗传多样性
随着育种进程的推进,攸县组群和乐昌组群不同世代育种群体的遗传变异有较为相似的变化规律。EST-nSSR分析结果显示,随着育种世代的升高,等位基因数(Na)、等位基因丰富度(AR)、观测杂合度(Ho)和期望杂合度(He)逐步降低,等位基因数(Na)的变化幅度更为明显。从F1经F2和F2.5,再到F3,乐昌组群内各群体的期望杂合度降低比例分别为2.86%、1.91%和6.46%(图2)。2个组群的私有等位基因数(Npa)有较大差异,攸县组群检测到7个私有等位基因,全部存在于高世代群体(F2),而乐昌组群的14个私有等位基因都存在于低世代育种群体,F1和F2各有9个和5个私有等位基因(表3)。
叶绿体基因组SSR检测结果也清晰显示了遗传多样性随育种进程的变化,从单倍型数(A)、单倍型丰富度(Rh)和群体多样性指数(H)来看,攸县和乐昌组群的变化趋势略有差异。攸县组群随育种世代的升高,遗传多样性逐步上升,而乐昌组群则呈现先上升再降低的趋势(表5)。
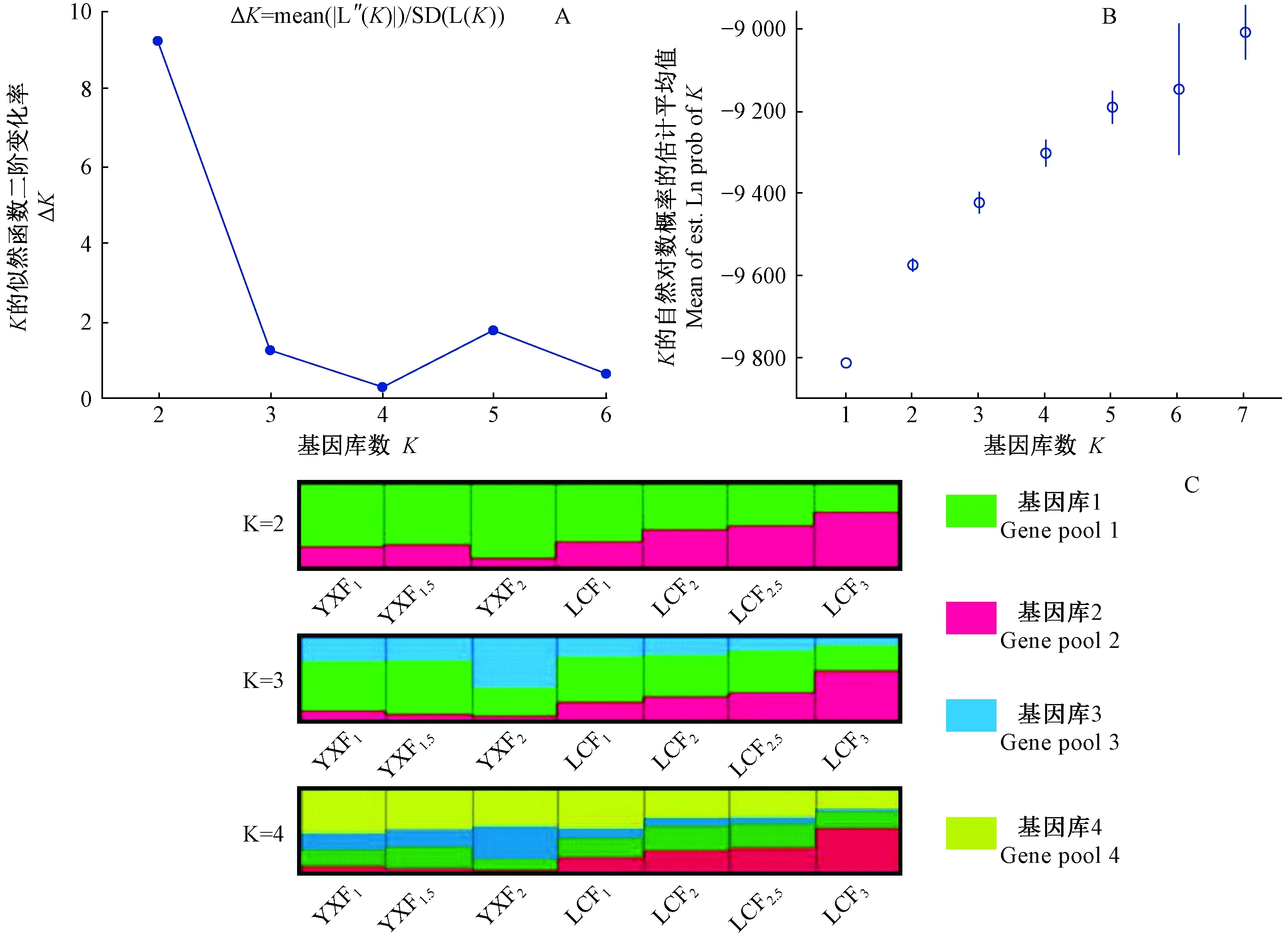
图1 杉木7个世代育种群体STRUCTURE分析结果Fig.1 STRUCTURE analysis results of 7 generations of Chinese fir breeding populations
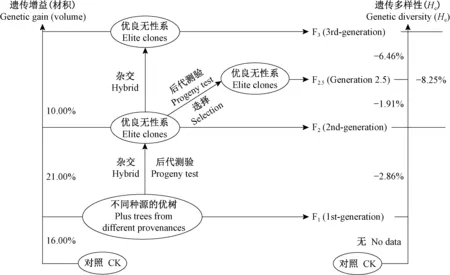
图2 乐昌组群不同世代育种群体遗传增益与遗传多样性变化的百分比比较Fig.2 Comparison of the percentage of genetic gain and genetic diversity of different generations in Lechang group
3 讨论
3.1 杉木育种群体遗传多样性水平评价
本研究表明,我国杉木育种群体具有遗传多样性高、基因流大、近交率低的特点。杉木育种群体遗传多样性(nSSR)达到了0.687,其值不仅高于柳杉(Cryptomeriafortunei)(He=0.501)(徐进等, 2014)、马尾松(He=0.482)(王鹏良, 2006)和华北落叶松(Larixprincipis-rupprechtii)(He=0.502)(于大德等, 2014)种子园的遗传多样性,而且高于云南松(Pinusyunnanensis)(He=0.429)(许玉兰等, 2015)和日本柳杉(Ht=0.651)(Kimuraetal., 2014)等天然林群体的遗传多样性。攸县和乐昌育种群体内的基因流达到了31.0,近交率低于0.028,基因流和近交率参数均优于日本柳杉(Tsumuraetal., 2014)。杉木长期育种过程中,不同世代育种群体的遗传多样性会随着育种进程的推进而逐步降低,但世代间减少幅度小于6.46%,因此育种学家不必过分担心杉木育种选择过程中,其遗传多样性的损失,这与马尾松(张薇, 2008)的研究结果有相似之处。
就叶绿体基因组标记而言,虽然本研究只选用了2个微卫星标记位点,但其多态性非常丰富,11个单倍型清晰地反映了育种材料遗传多样性的变化规律: 随着育种世代的升高,攸县组群的遗传多样性逐步上升,而乐昌组群则出现先上升再降低的趋势。叶绿体基因组的检测结果与核基因组存在一定差异,这种差异既与不同基因组的遗传方式(双亲或单亲遗传)有关,也与育种群体中材料的数量和来源有直接关系。杉木叶绿体基因组呈母性遗传(Qietal., 1999),其标记结果反映了母本(种子)基因流的变化情况。本研究在采样调查中发现,攸县组群在育种过程中并未完全严格按照轮回选择的方式,而是采取向高世代群体补充优良育种材料(无性系)的措施,所补充的材料来源于12个湖南省优良无性系(徐清乾等, 2002)。新的育种材料的补充一定程度提高了攸县组群高世代育种群体的遗传多样性,使其F2育种群体出现较多私有等位基因(7个)和私有单倍型(3个),也解释了攸县和乐昌高世代育种群体遗传结构存在较大差异(图1C,K=3)的原因。
3.2 杉木育种材料的科学管理
林木遗传改良过程中,遗传多样性和遗传增益的平衡一直是育种学家关注的重点(Krakowskietal., 2003; 魏润鹏, 1995; 王章荣, 2019)。根据本研究对乐昌不同世代育种群体遗传增益的测定结果,随着育种世代的增高,木材材积遗传增益变化明显,F1比对照林分增加16%,F2比F1增加21%,F3较F2增加10%(图2)。本研究表明,在育种过程的不断推进中,其育种群体的遗传多样性呈现逐步降低的趋势,在杉木遗传改良过程中,有效缓和遗传增益和遗传多样性间的冲突是非常必要的,而为保证杉木长期育种目标的顺利实现,育种材料资源体系的建立和科学管理显得尤为重要(王章荣, 2012)。
林木长期育种过程中,育种群体的作用非常重要,既保证了遗传增益的短期效益,又满足了高世代育种的需求。从本研究对2个育种群体遗传多样性的检测结果来看,我国杉木高世代育种策略和管理方法是科学有效的。在高世代育种过程中不断补给新的育种材料是维持遗传多样性的有效措施,但应充分掌握补给材料的遗传背景,避免产生近交等不利遗传效应。今后还应进一步加强育种群体的组成结构、群体规模、选择强度和方法等的研究,以保证近期和长期育种的遗传增益(王章荣, 2012)。还可利用父本分析的方法,对杉木育种群体的花粉基因流、花粉污染情况进行定量监测,以提高杉木良种质量。
分析育种材料的遗传变异和多样性水平,其目的在于获得具有较高遗传增益且遗传多样性丰富的生产群体。对于以生产良种为目的林木种子园,亲本选配不仅要考察开花期、花果量、生长量、抗性、材性等多个性状,同时还要考虑选配无性系的数量和亲缘关系(Cotterill, 1984),尽可能选择不同种源的材料,以保证生产群体具有较高的遗传多样性水平。目前,杉木已建立了第2代、第3代种子园,但不少地方仍将育种群体和生产群体混为一体(王章荣, 2012)。杉木高世代育种过程中,应注意育种群体和生产群体的区分,组建独立的育种群体,以保证长期的育种潜力和育种效率。
4 结论
湖南攸县和广东乐昌2个国家级杉木良种基地的育种群体有较高的遗传多样性水平,群体间具有基因流大、近交率低的特点。随着育种进程的推进,高世代育种群体的遗传多样性有逐步降低的趋势,但世代间遗传多样性的减少幅度小于6.46%,进一步说明我国杉木育种群体的管理和高世代育种策略是科学有效的。本研究结果可为我国杉木长期育种和人工林可持续高效经营提供科学依据。今后,还可对杉木育种群体的花粉基因流、外来花粉污染情况进行定量监测,进一步提高杉木良种质量。

