循环肿瘤细胞对小细胞肺癌化疗效果预测价值的分析
鲁翔华,陈皇,马双双,李利亚(1.北京中医药大学研究生院,北京 100029;2.中日友好医院 a.中西医结合肿瘤科,b.病理科,北京 100029)
小细胞肺癌(small lung cell cancer, SCLC)病情进展快、恶性程度高,易发生远处转移,致使多数SCLC患者确诊时已是晚期,生存预后差。而早期诊断、及时评估患者病情进展是延长SCLC患者生存时间的有效方法。研究显示,循环肿瘤细胞(circulating tumor cell, CTC)在SCLC人群中的检出率为67%~86%,且CTC半衰期为1.0~2.4 h,使得CTC可动态监控癌症转移,成为可实时反映转移情况的标志物[1]。本研究采用叶酸受体靶向PCR技术(ligand-targeted polymerase chain reaction, LT-PCR)定量检测SCLC患者血液样本中的CTC含量,并在SCLC患者接受2个周期化疗后对其进行实体瘤RECIST评分,以探讨CTC对于SCLC患者化疗效果的预测价值及与SCLC相关肿瘤标志物——胃泌素释放肽前体(pro-gastrin-releasing peptide, pro-GRP)、神经元特异性烯醇化酶(neuron specific enolase, NSE)、癌胚抗原 (carcino-embryonic antigen, CEA)等[2-3]的预测效能对比。
1 对象与方法
1.1研究对象 收集2018年10月至2019年10月于中日友好医院就诊的SCLC患者42例,男34例,女8例,年龄48~82岁,中位年龄63岁;既往有吸烟史患者29例,无吸烟史患者13例。纳入及排除标准:(1)均经过病理组织学明确诊断;(2)采血前未接受过化疗、放疗或其他抗癌治疗;(3)无合并严重的心肝肾疾病、精神疾病或其他恶性肿瘤;(4)病历资料记录完整。SCLC患者分期检查包括胸部计算机断层扫描、颅脑核磁共振、骨扫描和颈腹部彩色超声等;按照美国退伍军人肺癌协会(Veterans Administration Lung Study Group, VALG)的局限期(limited disease, LD)和广泛期(extensive disease, ED)进行分期[4],其中LD 15例,ED 27例。根据美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)发布的SCLC诊疗指南[4]推荐的SCLC患者一线化疗用药方案进行化疗,在化疗前及化疗2个周期后进行影像学检查,使用实体瘤RECIST评级进行疗效评估,其中部分缓解(partial remission, PR)14例,疾病稳定(stable condition, SD)19例,疾病进展(disease progression, PD)7例,完全缓解(complete remission, CR)1例,死亡1例。
1.2主要试剂与仪器 微型台式真空泵(海门其林贝尔公司),垂直混匀仪(宁波新芝生物公司),低温高速离心机(德国Sigma公司),ABI 7300实时荧光定量PCR仪(美国Lifetechnologies公司)。FR+-CTC试剂盒(上海格诺思博公司),Advia Centaur型全自动化学发光免疫分析仪及配套pro-GRP、NSE、CEA检测试剂盒(德国拜尔公司)。
1.3标本采集 采集患者入院治疗前的空腹静脉血3~5 mL,EDTA-K2抗凝,置于4 ℃保存,并于24 h内完成检测。
1.4LT-PCR定量检测CTC 取3 mL全血样本,加入红细胞裂解液,4 ℃裂解15 min,去除红细胞后加入150 μL抗CD45磁珠和50 μL抗CD14磁珠,4 ℃反应30 min,分别去除白细胞和巨噬细胞。将样品中剩余的细胞(包括CTC)进行检测,使用特异性小分子探针对CTC表面高表达的叶酸受体(folatereceptor,FR)进行标记和鉴别,最后使用特异性吸引物结合Taqman探针(5′-FAM-CAGTTGAGGGTTC-MGB-3′),用PCR对CTC结合的小分子探针进行定量检测。加入10 μL含有肿瘤特异性叶酸配体-寡核苷酸偶合物的探针标记液,室温温育40 min,加入1 mL洗涤缓冲液,4 ℃、500×g离心10 min,重复3次,去除未结合的探针。最后加入120 μL洗脱缓冲液,4 ℃温育2 min,洗脱下已结合的探针,瞬时离心,收集沉淀,加入24 μL中和缓冲液,用于荧光定量PCR扩增分析。PCR信号与数据分析采用ABI 7300实时荧光定量PCR仪进行,反应条件:95 ℃ 2 min,40 ℃ 30 s,72 ℃ 30 s,8 ℃ 5 min,共40个循环;95 ℃ 10 s,35 ℃ 30 s,72 ℃ 10 s。CTC判定标准:荧光染色为CK+/CD45-,DAPI+,有完整的胞膜胞核形态。计数3 mL血液中检测到的FR+-CTC,评估样本中的CTC含量,按试剂盒说明书以CTC≥8.7 FU/3 mL为阳性标准。
1.5pro-GRP、NSE、CEA检测 取各研究对象入院时的空腹静脉血5 mL,按Advia Centaur型全自动化学发光免疫分析仪及配套pro-GRP、NSE、CEA检测试剂盒说明书,进行检测及结果判读。阳性判定标准:pro-GRP>50 pg/mL,NSE>17.00 ng/mL,CEA>5.00 ng/mL。
1.6统计学分析 采用SPSS 25.0统计软件进行。CTC含量经正态性检验,呈偏态分布,数据以中位数(四分位数)[M(P25,P75)]表示,各组数据经检验方差不齐,采用Kruskal-WallisH检验比较总体差异,Mann-WhitneyU检验进行组间两两比较,双变量相关分析用Spearman相关检验。以P<0.05为差异有统计学意义。
2 结果
2.1SCLC患者的CTC计数水平 CTC在SCLC患者血液标本中的表达水平为12.05(7.55,15.81)FU/3 mL,CTC的阳性率为71.43%(30/42)。SCLC患者的性别、年龄、吸烟史等临床参数与CTC的表达水平的差异均无统计学意义(P均>0.05)。而不同分期SCLC患者的CTC表达水平的差异有统计学意义(U=96.50,P=0.005)。见表1。
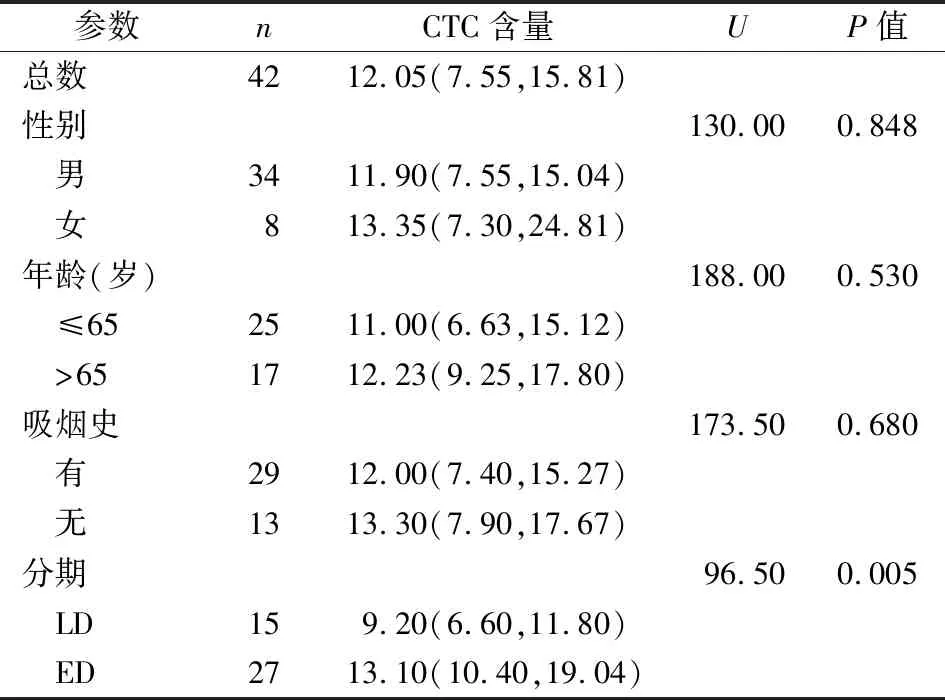
表1 SCLC患者的CTC含量[M(P25,P75)]
2.2CTC与pro-GRP、NSE、CEA相关性分析 SCLC患者pro-GRP含量为156.06(38.21,900.36) pg/mL,NSE含量为18.50(11.00,32.25) ng/mL,CEA含量为2.99(2.17,5.69) ng/mL,经Spearman相关性分析,CTC与pro-GRP、NSE、CEA均无相关性(r分别为0.123、0.176、0.026,P均>0.05)。
2.3CTC与pro-GRP、NSE、CEA对SCLC化疗疗效的预测效能比较 不同化疗疗效评级的SCLC患者的CTC表达水平差异有统计学意义(P<0.05),化疗疗效评级越差的患者CTC的表达水平越高;PR组与SD组间CTC表达水平差异无统计学意义(P>0.05),但化疗获益组(PR组、SD组)与PD组患者CTC表达水平差异有统计学意义(P<0.05);CR患者中1例CTC表达阴性,死亡患者中1例CTC表达阳性。见表2。

表2 CTC与SCLC患者化疗疗效评级的相关性分析
不同化疗疗效评级的SCLC患者pro-GRP、NSE、CEA的表达水平差异无统计学意义(P均>0.05),化疗获益组(PR组、SD组)与PD组患者pro-GRP、NSE、CEA表达水平差异无统计学意义(P均>0.05);1例CR患者各项肿瘤标志物的表达均为阴性;1例死亡患者各项肿瘤标志物的表达均为阳性。见表3。
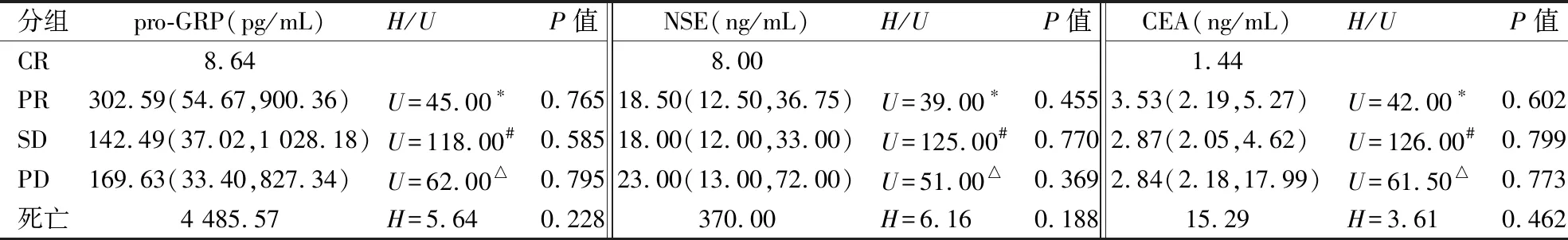
表3 pro-GRP、NSE、CEA与SCLC患者化疗疗效评级相关性分析
3 讨论
本研究使用的LT-PCR技术特异性高,操作简便,故而采用该技术检测CTC,并评价CTC对SCLC患者化疗疗效的预测效能及与pro-GRP、NSE、CEA等肿瘤标志物的预测效能进行比对,结果显示SCLC分期越差患者的CTC表达水平越高,提示CTC可用于辅助判断SCLC患者疾病分期。此外,CTC可实时监测SCLC患者疾病进展情况,弥补影像学检查的空窗期。经Spearman相关性分析,CTC与pro-GRP、NSE、CEA均无相关性,表明CTC有望成为一种新的标志物。在化疗疗效预测效能上,化疗前CTC表达水平越高的患者在化疗后RECIST评级越差,PD组患者化疗前的CTC表达水平显著高于化疗获益组患者,不同化疗评级的SCLC患者化疗前pro-GRP、NSE、CEA的表达水平差异无统计学意义,因此,CTC预测化疗疗效的效能优于其他肿瘤标志物。
Shen等[5]的研究纳入了80例SCLC患者,结果发现CTC是对接受化疗的SCLC患者的疗效有评估价值的标志物。本研究结果提示,CTC对于SCLC患者的化疗疗效评估具有一定的临床意义,其预测效能优于其他肿瘤标志物,进一步佐证了该研究结果的正确性。Syrigos等[6]在关于非小细胞肺癌的研究中证实,CTC表达水平较高的患者较低水平患者的疗效及生存预后更差,虽然其研究对象的病理分型与本研究不同,但均为肺癌患者,在CTC水平越高的患者其治疗效果越差这一结论上具有一致性。Wang等[7]研究结果显示,在接受放化疗治疗的SCLC患者中CTC呈高表达提示不良预后,本研究结果与Wang 等的结果相似,但区别在于本研究未纳入接受放疗治疗的患者。
本研究的局限性在于纳入研究的时间较短且病例数偏少,今后需增加研究时间并联合多中心进行大样本分析研究,以减少误差;此外,还应进一步统计患者的无进展生存期及中位生存期,以分析CTC表达水平与SCLC患者生存时间之间的关系,为CTC在SCLC患者诊疗中的临床应用提供更有价值的实验依据。

