不同杀线剂对山药土壤线虫群落结构及其理化性质的影响
范琳娟 刘子荣 徐雪亮 王奋山 彭德良 姚英娟




摘要 :以苗期山藥土壤为研究对象,以土壤线虫群落和土壤理化性质为分析指标,探究6种杀线剂对山药土壤环境的影响,旨在为山药线虫病的科学防治提供参考。结果表明,6种杀线剂对山药土壤含水量、pH、有机质、铵态氮及速效钾含量无显著影响,但均可显著降低土壤速效磷含量。与清水处理(CK)相比,6种杀线剂不仅可大幅提高土壤中有益的食细菌类线虫的相对丰度,也使有害的植物寄生类线虫的相对丰度显著降低,且对拟丽突属Acrobeloides的促生作用以及对根结属Meloidogyne和短体属Pratylenchus的灭杀作用最为明显,尤其是10.5%阿维·噻唑膦颗粒剂和41.7%氟吡菌酰胺悬浮剂,但其也均使有益的食细菌类线虫真头叶属Eucephalobus和丽突属Acrobeles相对丰度显著降低70%以上。对土壤线虫生态指数分析表明,10.5%阿维·噻唑膦颗粒剂和41.7%氟吡菌酰胺悬浮剂处理的土壤线虫丰富度指数(SR)和瓦斯乐斯卡指数(WI)均显著升高,植物寄生线虫指数(PPI)和成熟度指数(MI)无显著变化,但多样性指数(H′)、均匀度指数(J′)和营养类群指数(TD)均显著降低;2.5亿孢子/g厚孢轮枝菌颗粒剂、50亿孢子/g淡紫拟青霉颗粒剂、20%辣根素水剂和10亿孢子/g茶枯抑线生物菌肥(解淀粉芽胞杆菌)不仅可显著降低土壤线虫PPI和PPI/MI、大幅提高SR,对土壤线虫H′、J′和WI和MI影响不大,但50亿孢子/g淡紫拟青霉颗粒剂和10亿孢子/g茶枯抑线生物菌肥(解淀粉芽胞杆菌)处理的TD显著降低。相关性分析结果表明,速效磷含量与土壤线虫数量、属数及植物寄生类线虫相对丰度均呈极显著正相关。综上,6种杀线剂可有效控制植物寄生类线虫种群数量,但2种化学杀线剂还会对土壤有益线虫、土壤养分及线虫群落的多样性和均匀度等产生明显负作用,对土壤环境干扰较大。
关键词 :山药; 杀线剂; 土壤线虫; 土壤理化性质
中图分类号:
S 436.32, S632.1
文献标识码: A
DOI: 10.16688/j.zwbh.2020393
Effects of different nematicides on soil nematode community and soil properties in yam fields
FAN Linjuan1, LIU Zirong1, XU Xueliang1, WANG Fenshan1, PENG Deliang2, YAO Yingjuan1*
(1.Institute of Applied Agricultural Microorganisms, Jiangxi Academy of Agricultural Sciences, Nanchang 330200, China;
2.Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract
In order to provide a reference for scientific control of Chinese yam nematode disease, the effects of six nematicides on the soil nematode community and physical and chemical properties of soil for planting Chinese yam at seedling stage were analysed.The results showed that six kinds of nematicides had no significant effects on soil moisture content, pH value, organic matter, ammonium nitrogen and plant-available potassium, but all treatments could significantly reduce the content of plant-available phosphorus.Compared with the control, the relative abundance of beneficial bacterivores was greatly increased by six kinds of nematicides, meanwhile, the relative abundance of harmful herbivores was significantly decreased.Their growth-promoting effects on Acrobeloides and their killing effects on Pratylenchus and Meloidogyne were the most obvious, especially abamectin·fosthiazate 10.5% GR and fluopyram 41.7% SC.Nevertheless, they also reduced the relative abundance of Eucephalobus and Acrobeles by 70% or more.Analysis of soil nematode ecological indexes showed that SR and WI were significantly increased and there was no significant change in PPI and MI, but the indexes H′, J and TD were significantly decreased after treatment with abamectin·fosthiazate 10.5% GR and fluopyram 41.7% SC.However, the treatments with Verticillium chlamydosporium 25 million spores/g GR, Paecilomyces lilacinus five billion spores/g GR, horseradish 20% AS and one billion spores/g biological bacterial fertilizer for tea curd (Bacillus amyloliquefaciens) not only reduced the indexes of PPI and PPI/MI, increased the index of SR, but also had no effect on the indexes of H′, J′, WI and MI, though the TD index was reduced in the treatments with Paecilomyces lilacinus five billion spores/g GR and one billion spores/g biological bacterial fertilizer for tea curd (Bacillus amyloliquefaciens).Moreover, the results of correlation analysis showed that there was a significant positive correlation between plant-available phosphorus content and soil nematode number, genus number and relative abundance of parasitic nematodes.To sum up, the number of parasitic nematodes could be controlled by the six kinds of nematicides, but the two chemical insecticides also had negative effects on the soil beneficial nematodes, soil nutrients, diversity and evenness of nematode community, which caused greater disturbance to the soil environment than biological nematicides.
Key words
Chinese yam; nematicide; soil nematode; soil property
线虫病是导致山药连作障碍的主要因子之一。据本研究团队调查,山药线虫病田间发病率一般为10%~50%,重者达到100%,引起减产20%左右,已成为制约江西省山药产业可持续发展的一大难题。贺哲等[1]和黄婷等[2]发现为害山药的病原线虫主要为短体线虫属Pratylenchus和根结线虫属Meloidogyne,这两个属的线虫抗逆性和繁殖能力很强,不易根治,目前主要依靠化学防治[3]。刘廷辉等[3]和董文芳等[4]的研究表明,10.5%阿维·噻唑膦颗粒剂、20%辣根素水剂、42%威百亩水剂和99.5%氯化苦液剂等不仅对山药线虫病具有较好的防效,还能起到增产作用。此外,氟吡菌酰胺作为新一代具有全新作用机理的杀线剂,可通过抑制靶标琥珀酸脱氢酶活性,干扰线虫的呼吸作用使病原物体内能量耗尽而实现防病,已被广泛应用于多个国家的多种作物上[5]。在生物杀线剂方面,应用较多的主要为活孢子制剂(如厚孢轮枝菌Verticillium chlamydosporium、淡紫拟青霉Paecilomyces lilacinus和解淀粉芽胞杆菌Bacillus amyloliquefaciens的活孢子制剂等)和生物代谢产物(如阿维菌素等)。前人的研究表明,杀线剂在杀死土壤中植物寄生类线虫的同时,也会杀死土壤中的有益生物,破坏土壤的生态平衡[68]。但目前针对上述药剂鲜有此方面的报道。
土壤线虫群落与其生境尤其是土壤环境紧密相关,土壤环境为线虫的生存或生活提供条件,影响和调节其群落多样性和分布密度,而线虫通过参与调控土壤养分循环等过程又可影响土壤环境[9]。通常情况下,土壤线虫按照食性的不同可分为有益的食细菌线虫、食真菌线虫、捕食/杂食性线虫及有害的植物寄生线虫,且彼此相互依存、相互制约共同维护土壤微生态环境的平衡和稳定[10]。此外线虫具有个体微小、种类数量繁多、分布广泛、对土壤微生态环境反应敏感等特点,被认为是反映土壤健康状况的代表性指示生物,也是目前应用最多的生物指示因子之一[8,1112]。
本研究以苗期山药为研究对象,从土壤线虫群落组成、营养类群相对丰度和生态指数及土壤理化性质的角度,探究2种化学杀线剂(10.5%阿维·噻唑膦颗粒剂和41.7%氟吡菌酰胺悬浮剂)、3种生物杀线剂[2.5亿孢子/g厚孢轮枝菌颗粒剂、50亿孢子/g淡紫拟青霉颗粒剂和10亿孢子/g茶枯抑线生物菌肥(含解淀粉芽胞杆菌)]
和植物源杀线剂20%辣根素水剂对土壤生态环境的正负面影响,以期为合理选用杀线剂、科学防治山药线虫病提供参考依据。
1 材料与方法
1.1 供试药剂及试验地概况
试验地点设在瑞昌市范镇范镇村(29°35′43″N,115°33′55″E),为新开垦田,该地属大陆温湿性气候带,年平均气温17.5℃,年降雨量1 700 mm左右,每年4月-8月降雨量占全年降雨量的63.40%。供试药剂相关信息见表1。
1.2 田间试验设计
试验地山药播种密度为约5 400株/667 m2,株行距(20~30)cm×(45~55)cm;试验小区随机排列,面积为10 m2(2 m×5 m),每小区种4行,每行20株,即每小区80株,每处理重复3次。按照正常操作进行田间其他农事管理。
于2019年3月11日当天播种前施药,采用在播种沟沟施的方法,以清水作为对照,所有药剂均按照田间推荐剂量施用,其中颗粒剂拌入适量细土撒施;悬浮剂和水剂按照150 L/667m2水稀释后沟内浇施;辣根素浇施后迅速盖土并用塑料薄膜封闭,熏蒸处理7 d并散气4 h后再进行播种。除辣根素外,其他處理均于施药后播种。
1.3 测定项目和方法
1.3.1 土样采集
于2019年7月18日采用随机五点取样法,采集5~20 cm深度土样,每个处理3个重复,每个重复取约500 g土放入自封袋,带回实验室。一部分分离土壤线虫,一部分自然风干测定含水量和土壤理化指标。
1.3.2 土壤理化指标的测定
土壤pH采用酸度计法按水∶土=2.5∶1测定;有机质含量采用重铬酸钾法,铵态氮含量采用靛酚蓝比色法,速效钾含量采用火焰光度法,速效磷含量采用钼锑抗比色法测定[13]。
1.3.3 土壤线虫的分离与鉴定
采用贝尔曼漏斗法分离线虫,室温条件下分离48 h,然后于60℃杀死分离到的线虫,在显微镜下观察线虫的形态特征,依据尹文英[14]的《中国土壤动物检索图鉴》、刘维志[15]的《植物线虫志》和谢辉[16]的《植物线虫分类学》进行属的鉴定,分别统计各属线虫的数量,并统计食细菌类(bacterivores)、食真菌类(fungivores)、杂食/捕食类(omnivores/predators)和植物寄生类(herbivores)线虫的数量[11]。根据土壤湿度,将土壤线虫个体数量换算成 100 g 干土中含有的线虫数目。
1.4 数据处理
(1)多样性指数:Shannon 多样性指数H′ =-∑Pi lnPi;Pielou均匀度指数J′:J′=H′/lnS;Margalef丰富度指数SR=(S-1)/lnN;营养类群指数(trophic diversity index)TD=1/∑T2i。其中 i 为某一给定的分类单元,Pi为第 i 个分类单元中个体所占比例,S为土壤线虫群落所有线虫类群数,N为土壤线虫群落全部类群的个体总数;Ti指第i个营养类群在线虫群落中所占的比例[1718]。
(2)生态功能指数:线虫通路比值(nematode channel ratio, NCR),NCR=B/(B+F),反映土壤食物网的代谢途径;瓦斯乐斯卡指数(Wasilewska index,WI),WI=(F+B)/PP,指示土壤健康程度,指数值越高表明土壤越健康。其中,B、F 和PP分别为食细菌、食真菌和植物寄生类线虫的数量[1920]。
(3)成熟度指数:包括植物寄生线虫成熟度指数(plant parasites index,PPI)和自由生活线虫成熟度指数(maturity index,MI)。MI(PPI)=∑v (i)×f (i),式中v (i) 和f(i)分别为群落中某属(i)的c-p(colonizer-persister)值及其个体数在群落总个体中所占比例;PPI/MI:植物寄生线虫成熟度指数与自由生活线虫成熟度指数之比[21]。
所有数据用 Microsoft excel 2013和SPSS 20.0统计分析。
2 结果与分析
2.1 不同杀线剂对土壤理化性质的影响
不同杀线剂对山药土壤含水量、pH、有机质及速效钾含量无显著影响,对铵态氮和速效磷含量影响不同(表2)。其中10.5%阿维·噻唑膦GR处理的土壤铵态氮含量显著高于41.7%氟吡菌酰胺SC处理,但各药剂处理与对照均无显著差异;与对照相比,所有药剂处理速效磷含量均显著降低,且2种化学药剂处理的土壤速效磷含量下降幅度分别达68.90%和66.46%,其他4种杀线剂处理后土壤速效磷含量表现为:10亿孢子/g茶枯抑线生物菌肥>20%辣根素AS≈50亿孢子/g淡紫拟青霉GR>2.5亿孢子/g厚孢轮枝菌GR,降幅分别达55.84%、60.97%、62.80%和81.71%,且2.5亿孢子/g厚孢轮枝菌GR处理与10亿孢子/g茶枯抑线生物菌肥、50亿孢子/g淡紫拟青霉GR和20%辣根素AS差異显著。由此表明,这6种杀线剂对土壤速效磷含量的影响最大。
2.2 不同杀线剂对土壤线虫群落结构的影响
对不同杀线剂处理的土壤进行线虫的分离和属的鉴定,对照土壤共分离到19个属,2种化学药剂处理的共分离到15个属,其他4种药剂处理的共分离到17个属(表3)。
对照土壤中线虫群落主要由食细菌类的真头叶属Eucephalobus、丽突属Acrobeles、拟丽突属Acrobeloides及植物寄生类的根结属Meloidogyne和短体属Pratylenchus组成,食细菌类线虫和植物寄生类线虫分别占线虫总数量的65.20%和17.58%。
2种化学杀线剂处理的土壤中线虫群落主要由食细菌类线虫组成。其中10.5%阿维·噻唑膦GR和41.7%氟吡菌酰胺SC处理的土壤中拟丽突属Acrobeloides分别占线虫总数量的83.43%和77.53%,真头叶属和丽突属的相对丰度与对照相比均降低70%以上,由优势属降为常见属;根结属和短体属的相对丰度也较对照大幅降低,由优势属降为次优势属、常见属或稀有属。
3种生物杀线剂和1种植物源杀线剂处理的土壤中线虫群落主要组成属不同。其中2.5亿孢子/g厚孢轮枝菌GR和50亿孢子/g淡紫拟青霉GR处理的土壤中线虫群落主要由食细菌类的真头叶属和拟丽突属、食真菌类的滑刃属Aphelenchoides组成,两类线虫分别占线虫总数量的64.21%和11.75%、71.79%和6.84%,均较对照略有提高;2.5亿孢子/g厚孢轮枝菌GR处理的根结属与对照相比相对丰度显著提高,由优势属提升为极优势属,50亿孢子/g淡紫拟青霉GR处理的土壤中根结属和短体属及2.5亿孢子/g厚孢轮枝菌GR处理的短体属的相对丰度均大幅降低;20%辣根素AS和10亿孢子/g茶枯抑线生物菌肥处理的土壤中线虫群落主要由真头叶属、丽突属和拟丽突属组成;分别共占线虫总数量的66.66%和75.23%;此外,根结属和短体属的相对丰度均较对照显著降低,由优势属降为次优势属或稀有属。综上,这6种杀线剂在不同程度上均可控制土壤中山药病原线虫的种群数量,并对土壤线虫群落产生不同影响。
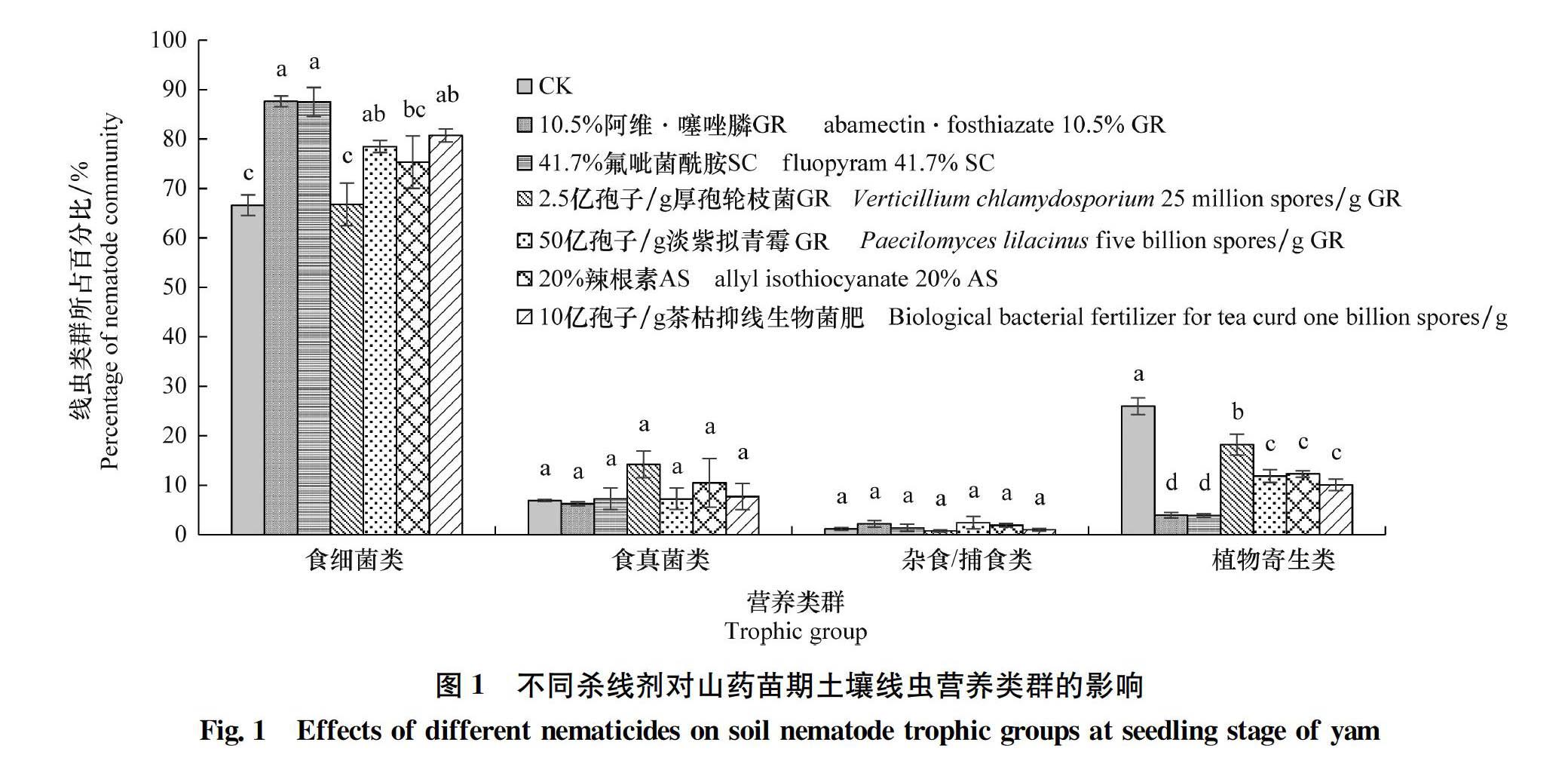
2.3 不同杀线剂对土壤线虫营养类群的影响
由图1知,不同杀线剂对山药土壤食真菌类和杂食/捕食类线虫的相对丰度影响不大,而对食细菌类和植物寄生类线虫的相对丰度具有较大影响。2种化学药剂处理的土壤食细菌类线虫相对丰度均达到85%以上,生物杀线剂中50亿孢子/g淡紫拟青霉GR和10亿孢子/g茶枯抑线生物菌肥
处理的土壤食细菌类线虫相对丰度均达到75%以上,显著高于CK(66.63%)。不同杀线剂处理的土壤植物寄生类线虫的相对丰度均显著低于CK,10.5%阿维·噻唑膦GR和41.7%氟吡菌酰胺SC处理的降幅分别达84.8%和85.20%,生物杀线剂中以2.5亿孢子/g厚孢轮枝菌GR的效果最差,降幅达29.90%,50亿孢子/g淡紫拟青霉GR、20%辣根素AS和10亿孢子/g茶枯抑线生物菌肥3个处理之间无显著差异,降幅均在50.00%以上。这表明杀线剂不仅可显著降低土壤中植物寄生线虫的相对丰度,还可在一定程度上促进食细菌类线虫的种群数量。
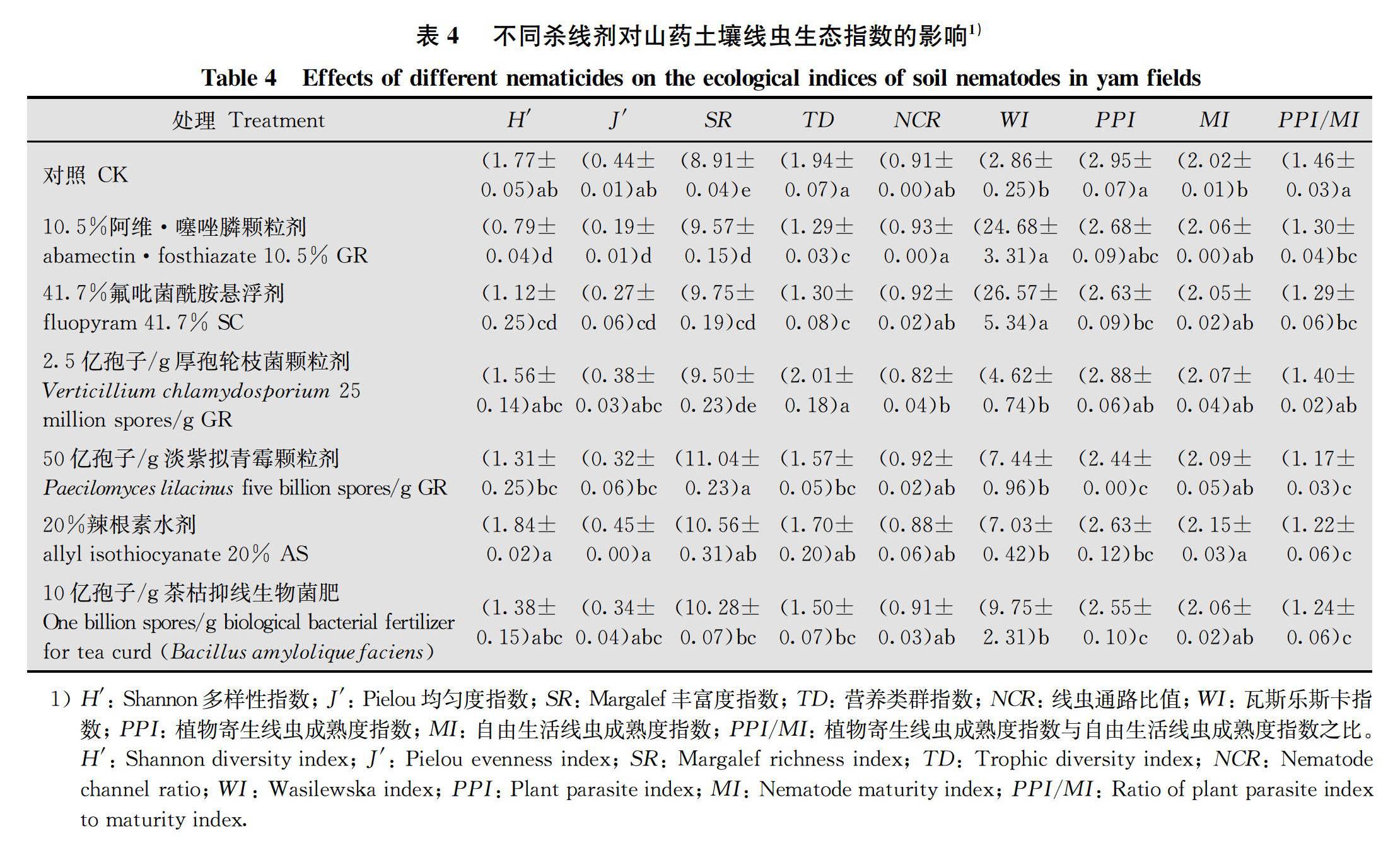
2.4 不同杀线剂对土壤线虫生态指数的影响
运用线虫生态指数分析,与CK相比,2种化学杀线剂处理的土壤线虫多样性指数H′、均匀度指数J′和营养类群指数TD均显著降低,丰富度指数SR和瓦斯乐斯卡指数WI均显著升高;其他4种杀线剂处理的土壤线虫H′和J′无显著变化,SR均显著提高(2.5亿孢子/g厚孢轮枝菌GR除外),2.5亿孢子/g厚孢轮枝菌GR和20%辣根素AS处理的土壤线虫TD 无显著变化,而50亿孢子/g淡紫拟青霉GR和10亿孢子/g茶枯抑线生物菌肥处理的TD显著降低。不同药剂处理的线虫通路比值NCR均大于0.80,且与CK之间均无显著差异。6种杀线剂处理后土壤植物寄生线虫成熟度指数PPI与CK相比均呈显著降低的趋势(10.5%阿维·噻唑膦GR和2.5亿孢子/g厚孢轮枝菌GR除外);而除20%辣根素AS处理成熟度指数MI显著提高外,其余处理均无显著变化;2.5亿孢子/g厚孢轮枝菌GR处理的PPI/MI与CK间无显著差异,其余处理均显著降低。
2.5 土壤线虫群落与土壤理化性质的相关性
由表5可看出,土壤pH、有机质、铵态氮、速效钾、土壤含水量与土壤线虫数量、属数、营养类群相对丰度以及生态指标之间均无显著相关性,而速效磷含量与土壤线虫数量、属数及植物寄生类线虫相对丰度均呈极显著正相关,与其他营养类群线虫相对丰度和生态指标的相关性未达到显著水平。
3 讨论
3.1 不同杀线剂对土壤理化性质的影响
土壤理化性质是影响土壤质量的重要指标。本研究结果显示,6种杀线剂对土壤含水量、pH、有机质、铵态氮和速效钾含量均影响不大,但使速效磷含量显著降低。速效磷是土壤中可被植物直接吸收的磷,是评价土壤供磷水平的重要指标[23]。许多研究表明,土壤理化性质与土壤线虫群落[8, 24]、土壤微生物[2526]、土壤酶活性[27]均具有密切关系。本研究结果也证实了土壤线虫数量、属数及植物寄生类线虫相对丰度与速效磷含量间均具有呈极显著正相关关系。由此分析6种杀线剂施用后改变了土壤线虫群落结构,从而影响了微生物对速效磷的释放[28];另一方面也可能是杀线剂施用后改变了土壤微生物的代谢途径和土壤酶活性,从而干扰了正常的土壤养分循环等生化过程的进行。时立波等[6]和武贺等[7]研究表明,杀线剂对土壤微生物组成和数量会产生较大影响;范琳娟等[29]研究也表明杀线剂施用后不仅会影响土壤微生物数量,也会使土壤速效磷等养分含量大幅降低。本研究结果与其基本一致。
3.2 不同杀线剂对土壤线虫群落的影响
6种杀线剂对土壤线虫的群落组成、营养类群和生态指数均具有不同程度的影响。从营养类群来看,10.5%阿维·噻唑膦GR、41.7%氟吡菌酰胺SC、50亿孢子/g淡紫拟青霉GR及10亿孢子/g茶枯抑線生物菌肥(解淀粉芽胞杆菌)处理的土壤食细菌类线虫相对丰度均较对照显著提高。其中,拟丽突属属于典型的机会主义的cp2类群,自然选择的作用使该种群繁殖能力较强且生命周期较短,抗干扰能力较强,是大多数农田生态系统中的极优势属[3032]。6种杀线剂施用后土壤中拟丽突属的相对丰度均较对照大幅提高(辣根素除外),与杨叶青等[8]研究棉隆和氯化苦对草莓土壤中拟丽突属的影响一致。此外,这也符合Walker[33]提出的“冗余种”假说,土壤线虫群落在正常情况下是处于稳定的状态,施用杀线剂打破了这种平衡状态,为了维持群落相对稳定,土壤中某些线虫类群的个体数量会大幅增加来替代在该环境中不易存活的线虫的作用。食细菌类线虫在土壤食物网和营养循环过程中发挥重要作用,可用以指示土壤肥力[24, 34]。10.5%阿维·噻唑膦GR和41.7%氟吡菌酰胺SC处理的土壤中食细菌类线虫真头叶属和丽突属及2.5亿孢子/g厚孢轮枝菌颗粒剂和50亿孢子/g淡紫拟青霉GR处理的丽突属的相对丰度均较对照显著降低,表明真头叶属对10.5%阿维·噻唑膦颗粒剂和41.7%氟吡菌酰胺悬浮剂比较敏感,丽突属对10.5%阿维·噻唑膦GR、41.7%氟吡菌酰胺SC、2.5亿孢子/g厚孢轮枝菌GR和50亿孢子/g淡紫拟青霉GR均比较敏感。可见,无论是化学杀线剂还是生物杀线剂,施用后均可能会对土壤线虫群落结构产生影响,降低土壤食物网中微生物捕食者的数量,对土壤生态系统产生一定影响[35]。
6种杀线剂也使土壤中植物寄生类线虫相对丰度大幅降低,尤其是2种化学药剂处理的降幅均达到80%以上。陈群英等[36]研究表明,施用药剂会使土壤中植物寄生类线虫数量大幅降低。白鹏华等[31]研究也表明,梨园多次施药后土壤0~20 cm和20~40 cm土层食细菌类线虫和植物寄生类线虫相对丰度均较施3次药发生了较大变化。本研究结果也证明了杀线剂对植物寄生类线虫具有较强灭杀作用,尤其是在对照土样中相对丰度较高的根结属和短体属。有研究表明,氟吡菌酰胺、阿维·噻唑膦、淡紫拟青霉、厚孢轮枝菌和辣根素等对根结线虫病和短体线虫病均具有较好的防效[34, 37];茶枯抑线生物菌肥(解淀粉芽胞杆菌)是近年新研发的集药、肥一体的全新生物型颗粒线肥,具双重防线机理(茶枯中的茶皂素和解淀粉芽胞杆菌),对线虫卵孵化具有较强的抑制作用。本研究证实了这6种杀线剂对土壤中的根结属和短体属线虫的种群数量具有较好的控制作用。
从土壤线虫生态指数看,6种杀线剂对线虫通路比值NCR和成熟度指数MI影响不大,但NCR值均高于0.8,表明土壤有机质的分解主要是通过细菌完成的;植物寄生线虫成熟度指数PPI与受干扰的频率呈较强正相关,PPI/MI值在土壤生态系统受扰动的时候会升高[38]。10.5%阿维·噻唑膦颗粒剂和41.7%氟吡菌酰胺悬浮剂施用后PPI和PPI/MI大幅降低,使土壤生态系统受干扰的程度降低;丰富度指数SR和瓦斯乐斯卡指数WI显著升高,使土壤线虫属的丰富度和土壤生态系统的健康程度大幅提高;但同时线虫多样性指数H′、均匀度指数J′和营养类群指数TD较对照显著降低,对土壤线虫群落的多样性和均匀度造成了不利影响。其他4种杀线剂不仅可显著降低土壤线虫PPI和PPI/MI、大幅提高SR(2.5亿孢子/g厚孢轮枝菌颗粒剂除外),对土壤线虫H′、J′、WI和MI影响不大,但50亿孢子/g淡紫拟青霉颗粒剂和10亿孢子/g茶枯抑线生物菌肥(解淀粉芽胞杆菌)处理的土壤线虫TD也显著低于对照。由此得出本研究使用的生物杀线剂(2.5亿孢子/g厚孢轮枝菌颗粒剂除外)不仅降低了土壤生态系统受干扰的程度,还提高了土壤线虫属的丰富度,且对土壤线虫属多样性、均匀度、健康程度和抗干扰能力无明显负影响。苏兰茜等[35]研究表明1.8%阿维菌素乳油和10%噻唑膦颗粒剂可显著降低苗期香蕉土壤线虫H′,自由生活线虫成熟度指数MI与本研究结果相近,但其对J′无显著影响及5亿活孢子/g淡紫拟青霉粉剂施用后使土壤线虫H′、J′和MI显著降低与本研究不同。
国内关于杀线剂对土壤线虫群落方面的研究较少,本文首次探讨了不同类型杀线剂对山药土壤线虫群落结构的影响,并以此评价了不同杀线剂对土壤生态环境的影响。明确了化学杀线剂虽在杀灭植物寄生类线虫和提高土壤健康程度等方面优于生物杀线剂,但其也对土壤线虫群落的多样性和均匀度造成了不利影响,对土壤环境的负影响较大。并且经过比较,2种化学杀线剂对土壤环境的作用效果相近,其他4种杀线剂中50亿孢子/g淡紫拟青霉颗粒剂、20%辣根素水剂和10亿孢子/g茶枯抑线生物菌肥(解淀粉芽胞杆菌)的作用效果相近,2.5亿孢子/g厚孢轮枝菌颗粒剂的作用效果最差。综上,建议生产上在山药连作障碍发生严重的山药田谨慎选用化学杀线剂,在发生较轻的山药田尽量选用生物杀线剂,以减少对土壤生态环境的影响。本文仅探讨了这6种杀线剂对苗期土壤环境的影响,是否会影响山药成熟期土壤环境有待进一步研究。
参考文献
[1] 贺哲,黄婷,李俊科,等. 瑞昌山药根腐线虫病病原鉴定[J]. 江西农业大学学报, 2016, 38(5): 879883.
[2] 黄婷,蒋军喜,余国庆,等. 山药病害最新研究进展[J]. 生物灾害科学, 2014, 37(1): 7478.
[3] 刘廷辉,贾海民,李瑞军,等. 6种药剂对山药种薯短体线虫的防治效果[J]. 农药, 2017, 56(6): 450452.
[4] 董文芳,刘廷辉,贾海民,等. 3种药剂对山药短体线虫病的田间防治效果[J]. 河北农业科学, 2017, 21(1): 4648.
[5] ABAD-FEUNTES A, CEBALLOS-ALCANTRALLIA E, MERCADER J, et al. Determination of succinatede hydrogenase-inhibitor fungicide residues in fruits and vegetables by liquid-chromatography-tandem mass spectrometry [J]. Analytical and Bioanalytical Chemistry, 2015, 407(14): 42074211.
[6] 时立波,王振华,刘静,等. 几种杀线剂对土壤微生物数量及真菌多样性影响[J]. 农药, 2008, 47(12): 917919.
[7] 武贺,段玉玺,陈立杰. 施用杀线剂对大豆根际真菌的影响[J]. 大豆科学, 2008, 27(4): 715719.
[8] 杨叶青,范琳娟,刘奇志,等. 棉隆和氯化苦熏蒸对重茬草莓土壤线虫群落及养分含量的影响[J]. 园艺学报, 2018, 45(4): 725733.
[9] 张晓珂,梁文举,李琪. 我国土壤线虫生态学研究进展和展望[J]. 生物多样性, 2018, 26(10): 10601073.
[10]ERLER F, ATES A O. Potential of two entomopathogenic fungi, Beauveria bassiana and Metarhizium anisopliae (Coleoptera: Scarabaeidae), as biological control agents against the June beetle [J]. Journal of Insect Science, 2015, 15(1): 16.
[11]YEATES G W. Effects of plants on nematode community structure [J]. Annual Review of Phytopathology, 1999, 37(1): 127149.
[12]李玉娟,吳纪华,陈慧丽,等. 线虫作为土壤健康指示生物的方法及应用[J]. 应用生态学报, 2005, 16(8): 15411546.
[13]鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社, 2000.
[14]尹文英. 中国土壤动物检索图鉴[M]. 北京:科学出版社, 1998.
[15]刘维志. 植物线虫志[M]. 北京:中国农业出版社, 2004.
[16]谢辉. 植物线虫分类学[M]. 北京:高等教育出版社, 2005.
[17]YEATES G W. Nematodes as soil indicators:functional and biodiversity aspects [J]. Biology and Fertility of Soils, 2003, 37(4): 199210.
[18]DICKMAN M. Some indices of diversity [J]. Ecology, 1968, 49(6): 11911193.
[19]YEATES G W, KING K L. Soil nematodes as indicators of the effect of management on grasslands in the New England Tablelands(NSW):Comparison of native and improved grasslands [J]. Pedobiologia,1997, 41(6): 526536.
[20]FERRIS H, BONGERS T, GOEDE D. A framework for soil food web diagnostics:extension of the nematode faunal analysis concept [J]. Applied Soil Ecology, 2001, 18(1): 1329.
[21]BONGERS T. The maturity index: An ecological measure of environmental disturbance based on nematode species composition [J]. Oecologia, 1990, 83: 1419.
[22]EKSCHMITT K, BAKONYI G, BONGERS M, et al. Nematode community structure as indicator of soil functioning in European grassland soils [J]. European Journal of Soil Biology, 2001, 37(4): 263268.
[23]张世熔,黄元仿,李保国,等. 黄淮海冲积平原区土壤速效磷·钾的时空变异特征[J]. 植物营养与肥料学报, 2003, 9(1): 38.
[24]焦加国,刘贝贝,毛妙,等. 江苏省不同农业区土壤線虫群落分布特征[J]. 应用生态学报, 2015, 26(11): 34893496.
[25]石程仁,禹山林,杜秉海,等. 连作花生土壤理化性质的变化特征及其与土壤微生物相关性分析[J]. 花生学报, 2018, 47(4): 16.
[26]赵雅姣,刘晓静,吴勇,等. 西北半干旱区紫花苜蓿小黑麦间作对根际土壤养分和细菌群落的影响[J]. 应用生态学报, 2020, 31(5): 16451652.
[27]邓大豪,李得铭,翟子翔,等. 盐胁迫下菌肥对柑橘土壤理化性质和酶活的影响[J]. 海南大学学报(自然科学版), 2020, 38(3):226232.
[28]吴纪华,宋慈玉,陈家宽. 食微线虫对植物生长及土壤养分循环的影响[J]. 生物多样性, 2007, 15(2): 124133.
[29]范琳娟,刘奇志,宋兆欣,等. 氯化苦对重茬草莓土壤生物和非生物因子的影响[J]. 农药, 2017, 56(2): 131134.
[30]DUPONT S T, FERRIS H, VAN HORN M. Effects of cover crop quality and quantity on nematode-based soil food webs and nutrient cycling [J]. Applied Soil Ecology, 2009, 41(2): 157167.
[31]白鹏华,刘奇志,刘宝生,等. 多次施用化学农药对梨园土壤线虫群落结构及土壤理化性质的影响[J]. 果树学报, 2017, 34(6): 715722.
[32]李晓兰,相吉山,庞燕飞,等. 覆膜连作对玉米田土壤线虫群落的影响[J]. 中国农业科技导报, 2018, 20(10): 105114.
[33]WALKER B H. Biodiversity and ecological redundancy [J]. Conservation Biology,1992, 6(1): 1823.
[34]MENG Fanxiang, OU Wei, LI Qi, et al. Vertical distribution and seasonal fluctuation of nematode trophic groups as affected by land use [J]. Pedosphere, 2006, 16(2): 169176.
[35]苏兰茜,王康,阮云泽,等. 3种杀线虫剂对香蕉土壤线虫群落结构的影响[J]. 植物保护, 2016, 42(3): 9198.
[36]陈群英,刘向辉,梁玉勇,等. 转Bt水稻种植与杀虫剂使用对土壤线虫群落的影响[J]. 植物保护学报, 2015, 42(5): 724733.
[37]迟元凯,叶梦迪,赵伟,等. 氟吡菌酰胺对南方根结线虫的作用效果[J]. 植物保护学报, 2019, 46(6): 13641370.
[38]BONGERS T, VAN DER MEULEN H, KORTHALS G. Inverse relationship between the nematode maturity index and plant parasite index under enriched nutrient conditions [J]. Applied Soil Ecology, 1997, 6(2): 195199.
(责任编辑:杨明丽)

