冷等离子体对单核增生李斯特菌的杀菌机理
窦勇,姚妙爱,闾怀中,胡佩红,董静
冷等离子体对单核增生李斯特菌的杀菌机理
窦勇1,姚妙爱1,闾怀中1,胡佩红2,董静1
(1江苏财经职业技术学院粮食工程与食品药品学院,江苏淮安 223003;2淮安正昌饲料有限公司,江苏淮安 223003)
【】作为一种新兴的非热灭菌技术,冷等离子在食品行业中得到了广泛的应用。通过探讨冷等离子体对细菌细胞膜的破坏效果,阐述其抗菌机制,为冷等离子体在食品行业的应用提供参考。本研究以单核增生李斯特菌(,LM)为试验菌株,研究冷等离子体处理对LM形态和胞内物质的影响,阐述LM细胞膜完整性的变化;冷等离子体处理后,通过测定细胞膜脂肪酸含量和类型的变化,比较8-苯胺-1-萘磺酸荧光强度的改变,反映冷等离子体对LM细胞膜流动性的影响。通过测定碘化丙啶荧光、电导率和-半乳糖苷酶活性的变化,观察冷等离子体对LM细胞膜通透性的改变。最后,通过检测胞内活性氧和活性氧相关基因表达量的变化,阐明冷等离子体对LM细胞膜造成的氧化损伤。冷等离子体处理后,LM细胞膜表面观察到破损变形的结构,胞内蛋白质和DNA分别下降了68 mg∙mL-1和14 μg∙mL-1,证明冷等离子体破坏了细胞膜的完整性。冷等离子体处理使LM细胞膜中不饱和脂肪酸的含量从40.17%上升至53.91%,饱和脂肪酸的含量从53.68%下降到41.57%,8-苯胺-1-萘磺酸荧光强度从8.99下降到3.73,说明冷等离子体处理后细胞膜的流动性增加。此外,冷等离子体处理后,碘化丙啶可以透过细胞膜,与胞内遗传物质结合发出红色荧光,电导率由0.15 mS∙cm-1上升至0.33 mS∙cm-1,-半乳糖苷酶活性也发生了明显的变化,OD420nm从0.274提高至0.683,说明LM细胞膜通透性提高。胞内活性氧(reactive oxygen species,ROS)荧光和荧光强度的变化说明,冷等离子体刺激细胞膜上ROS的产生,因此对细胞膜造成了氧化损伤。qRT-PCR结果显示冷等离子体处理下调了和的相对表达量,分别下降43.29%和52.71%,而的相对表达量上调了89.42%,揭示冷等离子体处理条件下,微生物在基因层面的氧化应激和调控机制。冷等离子体的活性基团通过对细胞膜的作用,破坏LM的细胞活性,起到了抑制效果。
冷等离子体;单核增生李斯特菌;细胞膜;流动性;氧化损伤
0 引言
【研究意义】单核增生李斯特菌(,LM)是一种常见的人畜共患病革兰氏阳性致病菌,因耐低温(4℃)、抗碱盐以及抗高渗透压特性使其普遍存在于食品表面和环境中,对食品安全和人类健康造成了巨大的威胁[1]。传统的热杀菌技术包括巴氏杀菌、高温瞬时杀菌和微波杀菌法等是食品行业中常用的控制LM污染的方法,然而,这些热杀菌技术由于温度的升高,对食品的营养、质构和风味等造成了一定的影响[2]。因此,寻找一种有效的冷杀菌技术,研究其潜在的抗菌机制,对食品行业中LM的控制有重要的意义。【前人研究进展】目前,已经有研究人员应用不同的冷杀菌技术控制食品中微生物的繁殖,包括脉冲强光[3]、超高压[4]、超声波[5]和冷等离子体技术等,其中,冷等离子体杀菌技术因操作装置简单,不会引起处理样品升温,已在食品领域取得了广泛的应用[6]。冷等离子体对LM的杀菌效果已经得到了很多研究的验证,如Kim等[7]利用介质阻挡放电冷等离子体技术处理猪排,发现处理后猪排中的李斯特菌数量明显降低;李兆杰等[8]发现,在功率为120 W、电压10 kV和频率30—40 kHz条件下,4 min的冷等离子处理可以彻底杀灭LM。此外,冷等离子体对微生物作用机制也得到了初步研究,如LIN等[9]发现冷等离子体的活性成分能够抑制鼠伤寒沙门氏菌的新陈代谢、胞内蛋白、多糖和DNA的含量,进而导致细菌的死亡。细胞膜是隔离细菌与外部环境的重要屏障,对维持细菌的生理功能和外观形态起着重要的作用。遭遇外部压力和抗菌处理时,细菌细胞膜作为主要的作用位点,完整性、流动性和通透性会发生明显的改变,从而影响胞内物质如DNA、ATP、蛋白质和酶以及物质运输与信息交流[10]。同时,细胞膜是胞内活性氧产生的主要位点,一些环境因素如辐照、紫外线处理和脉冲照射等都会刺激胞内活性氧的产生,从而激活氧化压力造成细胞膜的氧化损伤[11]。为了感知和应对胞内活性氧造成的氧化损伤,LM已经进化出一些复杂的氧化还原调节基因。【本研究切入点】尽管冷等离子体对LM的杀菌效果已经得到了广泛的验证,但是冷等离子体对LM的杀菌机制却鲜有研究,尤其是冷等离子体基于细胞膜层面的破坏机制还未见报道。【拟解决的关键问题】本研究以LM为研究对象,优化冷氮源等离子体对LM的最佳抑制条件,从细胞膜层面揭示冷氮源等离子体的杀菌机制,研究其对细胞膜完整性、流动性和通透性的影响(图1)。此外,通过研究冷等离子体对细胞膜引起的氧化损伤以及对氧化还原相关基因表达的影响,为拓展冷等离子体的抗菌应用提供参考。

图1 冷等离子体对细胞膜的作用机制示意图
1 材料与方法
1.1 材料与试剂
CMCC(B)54002单核增生李斯特菌由丰晖生物科技有限公司提供,斜面保藏的细菌接种至液体蛋白胨酵母浸膏葡萄糖培养基中(PYG),37℃培养48 h到达对数期;蛋白检测试剂盒、细菌基因组DNA提取试剂盒,美国Sigma公司;8-苯胺-1-萘磺酸(ANS)、碘化丙啶(PI)、2',7'-二氯荧光黄双乙酸盐(DCFH- DA)、5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)、邻-硝基苯--d-半乳糖苷(ONPG),上海阿拉丁生物科技有限公司;磷酸二氢钾、磷酸氢二钠、氯化钠,国药集团化学试剂有限公司。
1.2 仪器与设备
介质阻挡放电(DBD)冷等离子体装置,苏州ATV电子技术有限公司;透射电子显微镜,德国蔡司公司;蛋白电泳仪、核酸电泳仪,北京六一生物科技有限公司;紫外可见分光光度计,上海精密仪器仪表有限公司;倒置荧光显微镜,日本奥林巴斯;电子自旋共振仪,德国布鲁克公司;气质联用仪,美国安捷伦公司。
1.3 方法
1.3.1 冷等离子体最佳抑制条件的优化 将对数期的LM菌悬液稀释后,加入到无菌PYG液体培养基中(总体积5 mL),菌体初始浓度为5.6 CFU/mL。随后立即置于冷等离子体设备中进行处理。使用氮气为激发气体,功率(180、200和220 W)、处理时间(50、60和70 s)和氮气流速(40、50和60 cm3∙min-1)为因素,残存菌数为因变量,应用Design Expert软件进行冷等离子体最佳抑菌条件(处理前后菌落数量变化最小)的优化,优化后的条件用于后续试验。
1.3.2 细胞膜的完整性
1.3.2.1 透射电子显微镜观察 冷等离子体处理后,对数期的LM菌悬液(试验组,~108—109CFU/mL)滴于铜网上面,与3%(v﹕v)的磷钨酸溶液混合染色5 min,晾干,使用透射电子显微镜观察冷等离子体对LM细胞膜完整性的影响[12]。未经冷等离子体处理的LM菌悬液作为对照组。
1.3.2.2 胞内蛋白质的泄漏 细胞膜的完整性也可以用胞内物质如蛋白质和DNA的泄漏来反映。蛋白质的泄漏使用聚丙烯酰胺凝胶电泳(SDS-PAGE)和蛋白质浓度的变化来检测。冷等离子体处理后,对数期的LM菌悬液(~108—109CFU/mL)离心、洗涤,收集菌体沉淀后重悬在1 mL的无菌PBS中。重悬液使用超声波细胞破碎仪进行破胞,离心,取上清液与4×上样缓冲液沸水浴中煮沸10 min。冷却后,加样到蛋白电泳仪中,80 V条件下泳动20 min后,调整电压至120 V进行SDS-PAGE试验[13]。至于蛋白质浓度的变化,将经过冷等离子体处理后的LM菌悬液离心、洗涤和重悬后,其蛋白质含量使用蛋白质检测试剂盒进行测定。未经冷等离子体处理的LM菌悬液作为对照组。
1.3.2.3 胞内DNA的泄漏 冷等离子体处理(试验组)和未处理(对照组)的LM菌悬液(对数期,~108—109CFU/mL)经离心、洗涤和重悬后,用基因组DNA提取试剂盒提取其中的DNA。使用紫外可见分光光度计在260 nm波长处测定不同样品中DNA含量的变化[14]。
1.3.3 细胞膜的流动性
1.3.3.1 细胞膜脂肪酸的变化 试验组和对照组的LM(对数期,~108—109CFU/mL)经离心洗涤后收集菌体沉淀,菌体沉淀置于冷冻干燥机干燥24 h。称取1 g干燥后LM加入35 mL的甲醇/氯仿(v﹕v,1﹕2)溶液,超声30 min,0.45 μm有机滤膜过滤,滤液旋转蒸发浓缩后进行氮吹,所得提取物即为磷脂。提取得到的磷脂加入2 mL的甲基化试剂(2 mol∙L-1NaOH-CH3OH),75℃加热20 min,将磷脂中的脂肪酸甲酯化[15]。脂肪酸甲酯用正己烷萃取,加样到气质联用仪(GC-MS)中,分析脂肪酸组分和含量的变化。GC-MS条件为:注射温度250℃,检测温度260℃,程序升温60℃保持3 min,5℃∙min-1加热到160℃,2℃∙min-1加热至220℃,然后10℃∙min-1加热到230℃并保持2 min。
1.3.3.2 1-苯胺-8-萘磺酸 (ANS)荧光 4 mL冷等离子体处理的LM菌悬液(试验组,~106CFU/mL)与20 μL的ANS溶液(8 mmol∙L-1)混合,置于暗处反应30 min。反应结束后,置于荧光分光光度计中,385 nm的激发波长和473 nm的发射波长处检测荧光强度[16]。未经等离子体处理的LM作为对照组。
1.3.4 细胞膜的通透性
1.3.4.1 碘化丙啶(PI)荧光 20 μL的PI溶液(20 mmol∙L-1)与4 mL冷等离子体处理的LM菌悬液(~106CFU/mL)混合,置于暗处反应30 min。使用倒置荧光显微镜获取不同样品的PI荧光照片,激发波长为400 nm,发射波长为615 nm[17]。未经等离子体处理的LM作为对照组。
1.3.4.2 电导率 不同处理的LM菌悬液(对数期,~108—109CFU/mL)离心后收集上清液。不同样品上清液的电导率由电导仪进行检测。
1.3.4.3 β-半乳糖苷酶活性 使用乳糖类似物邻-硝基苯--d-半乳糖苷(ONPG)检测细胞膜上-半乳糖苷酶活性的变化。将不同的LM菌悬液(对数期,~108—109CFU/mL)离心、洗涤和重悬后,加入ONPG溶液(30 mmol∙L-1,体积比1﹕20),置于暗处反应30 min。在420 nm波长处检测不同样品的紫外分光光度值[18]。
1.3.5 细胞膜的氧化损伤
1.3.5.1 胞内活性氧(ROS)荧光照片和荧光强度 使用2',7'-二氯荧光黄双乙酸盐(DCFH-DA)检测胞内活性氧的产生。5 mL的LM菌悬液(对数期,~108—109CFU/mL)经离心洗涤后收集菌体沉淀。菌体沉淀重悬于2 mL的DCFH-DA(10 μmol∙L-1)溶液中,置于暗处反应30 min,反应结束后立即置于冷等离子体装置中处理(试验组)。处理结束后,离心洗涤并重悬于等体积的PBS溶液中。使用倒置荧光显微镜在488 nm的激发波长和525 nm的发射波长处获取不同样品的荧光照片。不同样品的ROS荧光强度则用荧光分光光度计在488 nm的激发波长和525 nm的发射波长处检测。
1.3.5.2 电子自旋共振(ESR) 使用电子自旋共振仪检测ROS的种类。冷等离子体处理后,100 μL的LM菌悬液(对数期,~108—109CFU/mL)与20 μL 5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)混合,置于暗处反应30 min。反应结束后移入毛细管中,在ESR仪器中检测。检测条件为:中心场强3 510 G,扫描宽度100 G,频率9.85 GHz[19]。
1.3.5.3 实时定量聚合酶链反应(qRT-PCR) 使用qRT-PCR检测氧化还原相关基因和表达量的变化。不同LM样品的总RNA用RNA提取试剂盒提取。提取的RNA用逆转率试剂盒来合成cDNA。合成的cDNA作为qRT-PCR反应的模板来检测相关基因表达量的变化[20]。qRT-PCR反应条件为:95℃预变性15 min,95℃变性10 s,60℃退火20 s,72℃延伸30 s,40个循环。16S内参基因和相关基因的引物序列如表1所示。
1.4 数据分析
所有的数据在3次测试后以平均值±标准差的形式表示。使用SPSS软件中的单因素方差分析进行显著性分析,<0.05为差异显著。使用Design Expert软件进行响应面结果的处理。
2 结果
2.1 冷等离子体最佳抑制条件的优化和细胞膜完整性变化
由响应面分析法得出的最佳抑制条件是:功率182 W,处理时间67 s,氮气流速52 cm3∙min-1(图2),用此条件作为后续的全部试验。
未经冷等离子体处理的LM表面光滑,饱满圆润,有完整的细胞膜包裹在细菌的外面(图3-A)。但经过冷等离子体处理后,LM细胞膜表面观察到破损变形的结构和泄漏的胞内物质(图3-B),说明冷等离子体能够导致LM细胞膜完整性的破坏和变形。

表1 不同基因的引物序列
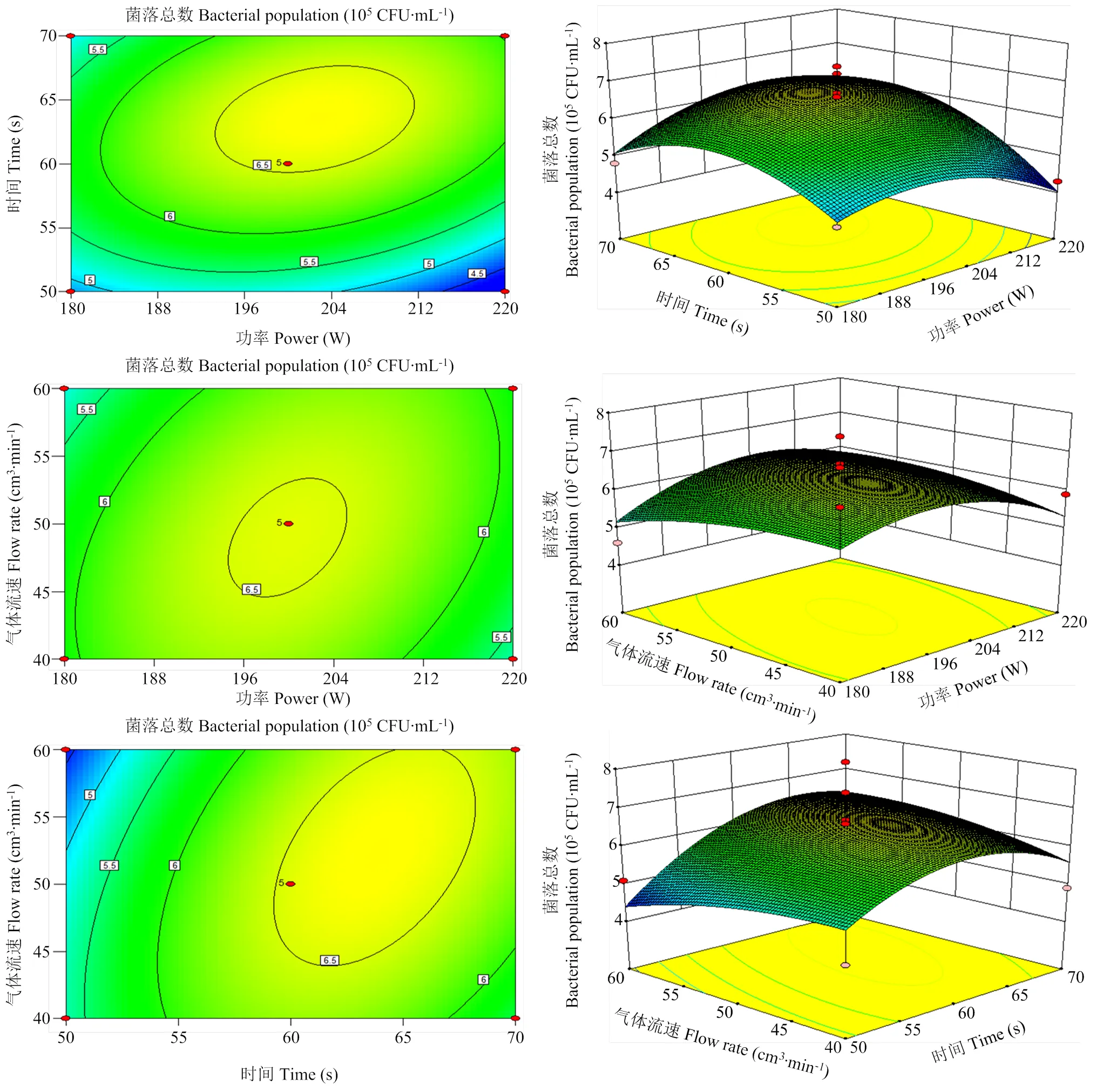
图2 功率、处理时间和气体流速影响等离子体抑制效果的响应面设计
胞内物质的泄漏也可以反映细胞膜完整性的破坏。由图3-C可知,经冷等离子体处理后(试验组),蛋白质条带的亮度低于对照组,说明冷等离子体导致了胞内蛋白质的泄漏。经等离子体处理后,LM内部的蛋白质含量从157 mg∙mL-1(对照组)下降到89 mg∙mL-1(试验组),胞内蛋白质出现了明显的泄漏(图3-D)。同样,经过冷等离子体处理后,胞内DNA的含量也发生了明显的变化。DNA含量从35 μg∙mL-1(对照组)下降到21 μg∙mL-1(试验组)。以上LM形态观察和胞内物质的检测说明冷等离子体破坏了细胞膜的完整性。
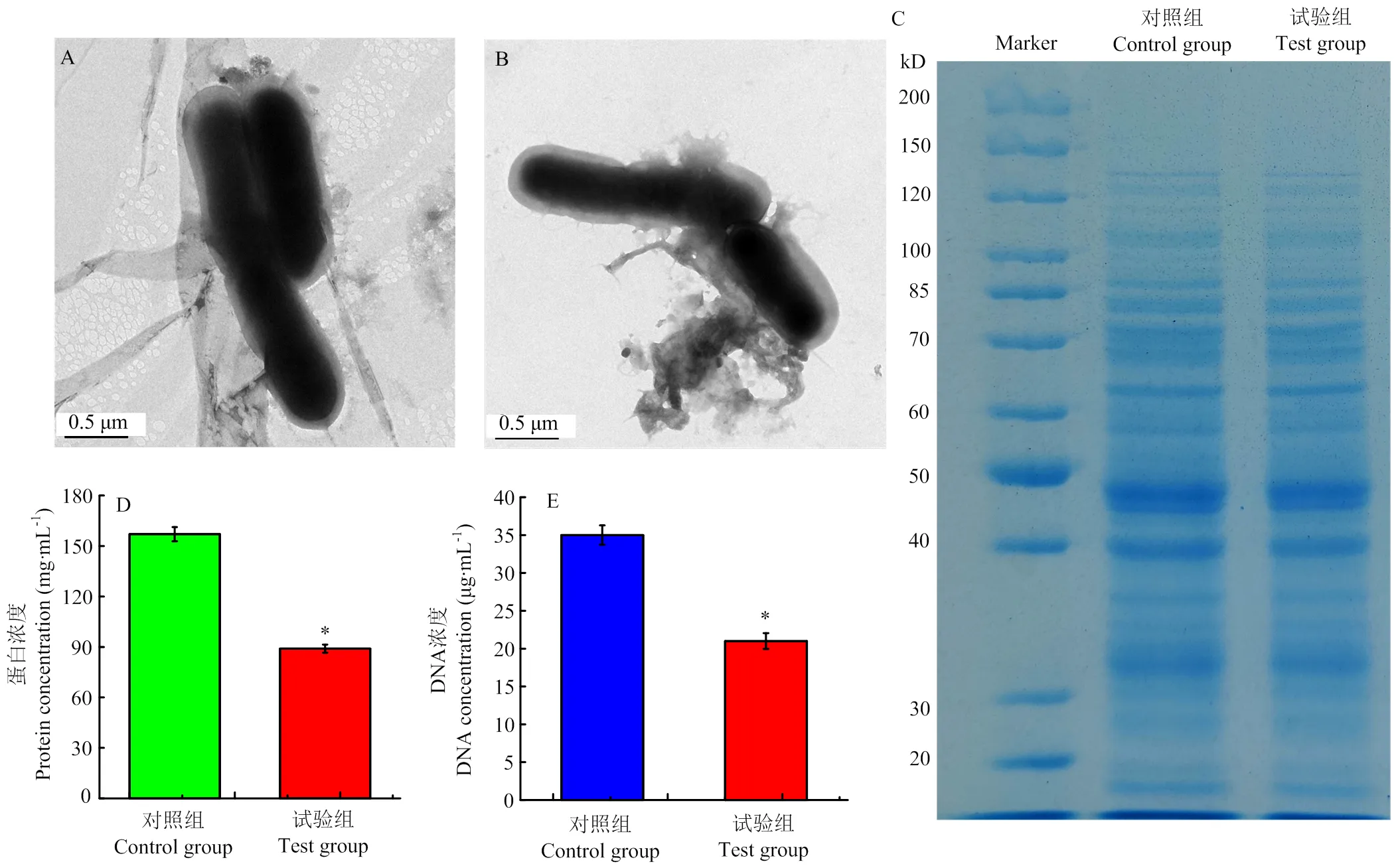
A:对照组的TEM图;B:试验组的TEM图;C:不同样品的SDS-PAGE结果;D:不同样品的蛋白质含量变化;E:不同样品DNA含量变化。*表示试验组和对照组差异显著(P<0.05)。下同
2.2 细胞膜的流动性
2.2.1 细胞膜脂肪酸分析 细胞膜的流动性对细菌的活性和生命力起到了至关重要的作用。细胞膜磷脂中不饱和脂肪酸含量的变化是预测细胞膜流动性变化的重要指标,细胞膜中不饱和脂肪酸含量越高,细胞膜的流动性也就越大[21]。由表2可知,经过冷等离子体处理后(试验组),细胞膜中不饱和脂肪酸的含量达到53.91%,比对照组高40.17%。同时,经过冷等离子体处理后,饱和脂肪酸的含量从53.68%下降到41.57%。说明经冷等离子体处理后,LM细胞膜的流动性明显增加。此外,经冷等离子体处理后,短链脂肪酸(C12和C14)的含量增加到8.13%。有研究表明短链脂肪酸含量的增加能够提高细胞膜的流动性[22],本研究结果说明冷等离子体处理提高了LM的膜流动性。
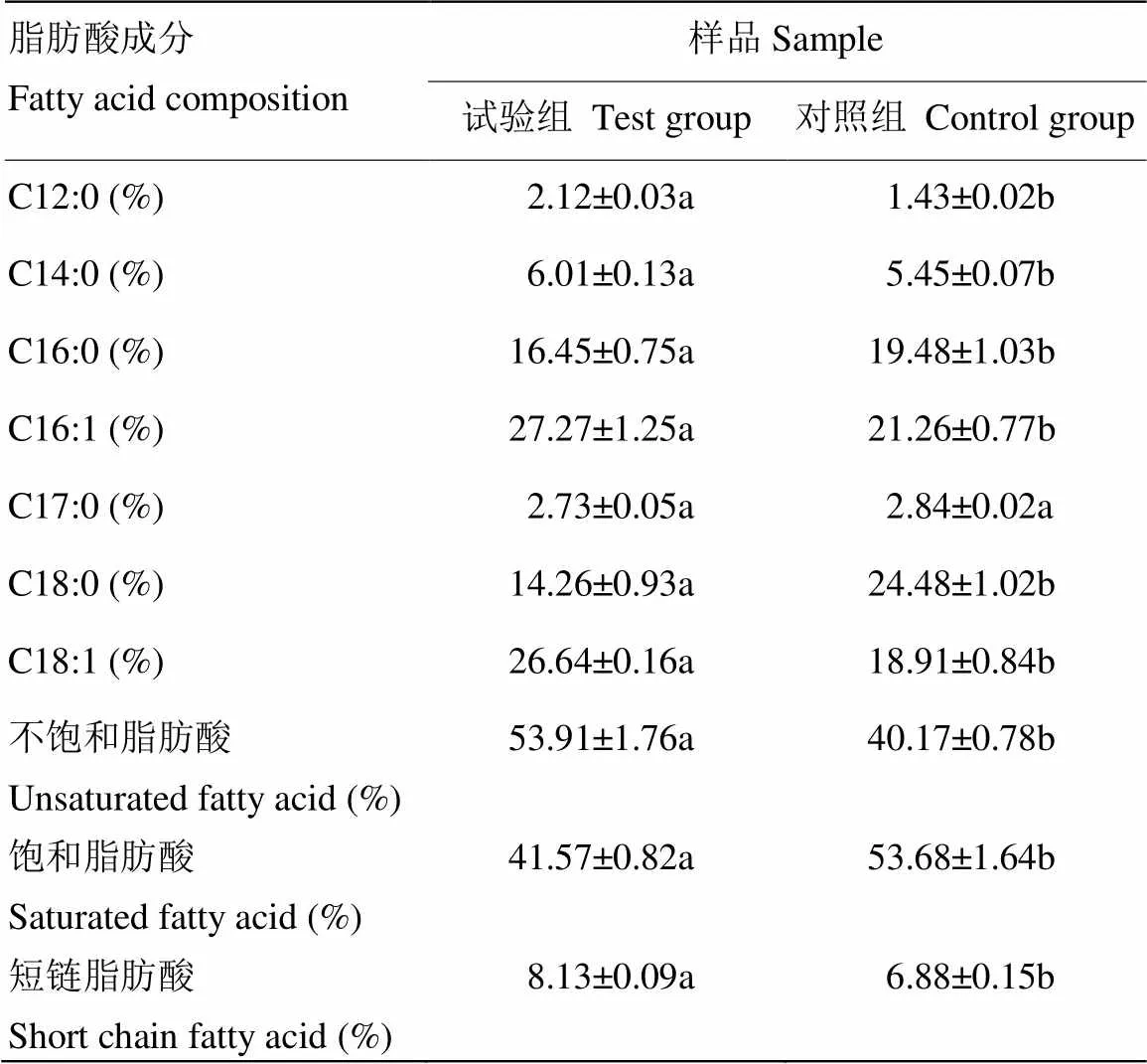
表2 不同样品的脂肪酸成分和含量
同一行中不同小写字母表示差异显著(<0.05)
Different letters in the same line means significant difference (<0.05)
2.2.2 ANS荧光 ANS荧光探针可以用来测定细胞膜的流动性。ANS能够和细胞膜的疏水区域结合,细胞膜的流动性越小,ANS就越容易与细胞膜结合,进而荧光强度也越高[23]。本研究利用ANS荧光强度的变化来反映细胞膜流动性的改变,由图4可知,试验组的荧光强度明显低于对照组,从8.99下降到3.73,说明冷等离子体处理后细胞膜的流动性增加。
2.3 细胞膜的通透性
2.3.1 PI荧光 碘化丙啶(PI)是一种膜不透性的荧光探针,能够与细胞内的遗传物质结合,发射出红色荧光。PI不能穿透完整的细胞膜,只有细胞膜的通透性提高后,PI才能进入细胞并与遗传物质结合[24]。因此,通过检测PI荧光反映细胞膜通透性的变化。图5-A中没有检测到红色的荧光,说明PI不能进入完整的细胞膜,进而不能和遗传物质结合。图5-B中观察到大量的红色荧光,说明冷等离子体处理后,细胞膜的通透性提高,大量的PI进入细胞内与遗传物质结合发射出红色的荧光。

图4 不同样品的ANS荧光
2.3.2 电导率和-半乳糖苷酶活性 细胞膜通透性的提高能够促进电解质和胞内离子的泄漏,进而提高菌悬液的电导率。由图5-C可以看出,对照组的电导率为0.15 mS∙cm,低于试验组的0.33 mS∙cm,说明冷等离子体处理后细胞膜通透性的提高。-半乳糖苷酶是一种位于细胞膜上的水解酶,能够水解乳糖生成半乳糖和葡萄糖。ONPG是一种乳糖类似物,能够被-半乳糖苷酶水解成半乳糖和O-硝基酚(ONPE),ONPE在420 nm波长处有特定的紫外吸收。通常情况下,ONPG透过细胞膜的速率很慢,但当细胞膜的通透性改变时,大量的ONPG迅速透过细胞膜,导致420 nm处紫外强度的增加[25]。对照组的OD420nm为0.274,而试验组的OD420nm为0.683,增加的紫外强度说明了细胞膜通透性的提高。
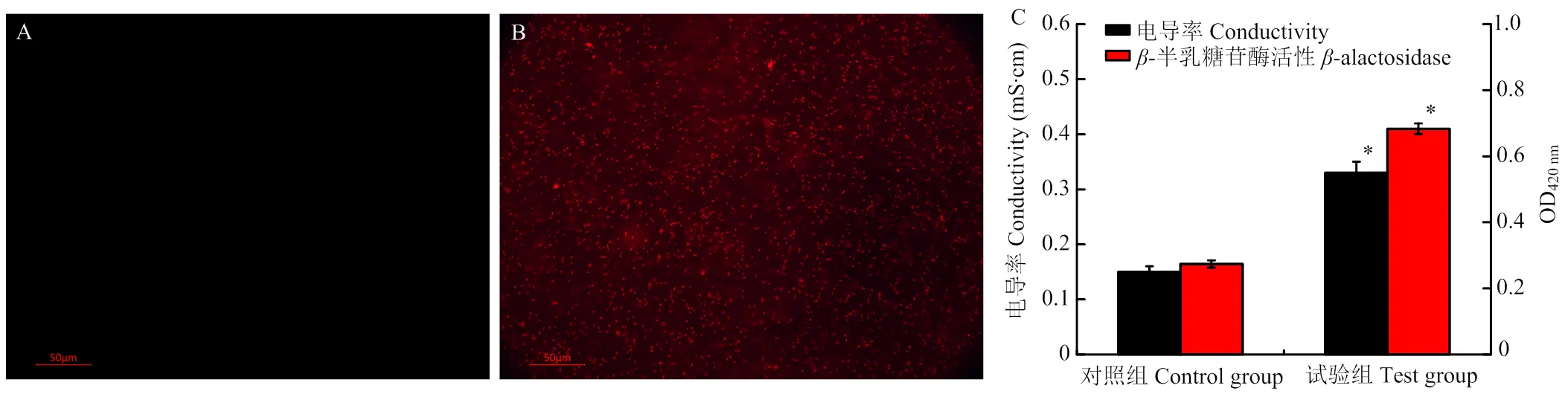
A:对照组的PI荧光图;B:试验组的PI荧光图;C:电导率和β-半乳糖苷酶活性的变化
2.4 细胞膜的氧化损伤
2.4.1 ROS荧光照片和荧光强度 本试验中,非荧光探针DCFH-DA用来检测细胞内的ROS水平。DCFH-DA可以被ROS氧化成绿色荧光物质 2',7'-二氯荧光素(DCF)。由图6可以看出,经过冷等离子体处理后,LM细胞内产生大量绿色荧光,这些绿色荧光是DCFH-DA被ROS氧化后产生的,说明冷等离子体刺激LM产生了大量的ROS,这些ROS会对细胞膜造成巨大的氧化损伤。由图6-D可以看出,对照组中的荧光强度在40 min内几乎没有变化,而试验组中的荧光强度从0.45增长到2.48(处理后20 min)和2.73(处理后40 min)。
2.4.2 ESR和qRT-PCR ESR仪可以检测未成对的电子,因此,可以利用ESR技术鉴定LM细胞内产生的ROS种类。由图7-A可以看出,对照组的ESR谱图里没有任何明显峰,说明对照组中没有检测到ROS的存在。试验组的ESR谱图中检测到6个明显峰(用*标记),这6重峰由烷基过氧化自由基、烷氧基自由基、烃基自由基和超氧自由基叠加造成[26]。
利用qRT-PCR技术检测和表达量的变化,从基因层面揭示细胞内ROS的产生机制。和对细胞内的氧化还原平衡具有重要影响。经过冷等离子体处理后,和相对表达量下降明显,分别比对照下降了43.29%和52.71%;而的相对表达量上调了89.42%(图7-B)。说明冷等离子体通过调节相关基因的表达破坏了LM细菌内的氧化还原平衡,进而刺激了ROS的大量产生。

A:对照组ROS荧光图片;B:CP处理20 min的荧光图片;C:CP处理40 min的荧光图片;D:ROS荧光强度

图7 ESR谱图(A)及perR、recA和sigB表达量(B)的变化
3 讨论
细胞膜是保证细菌生存的重要屏障,对细菌的物质交流和信息交换起着重要的作用。很多抗菌剂和杀菌装置的设计都以细胞膜作为主要的作用位点。细胞膜的完整性对保护细菌的胞内物质如蛋白质和DNA等有重要意义。一旦细胞膜的完整性遭到破坏,细胞的形态会发生变化,胞内物质发生泄漏。OLATUNDE等[27]发现冷等离子体处理破坏了一些革兰氏阴性菌的细胞膜,进而加速了胞内物质如脂肪、蛋白质和DNA的泄漏。本研究透射电镜图片显示,经冷等离子体处理后,LM细胞膜表面可观察到明显的破损结构,细胞膜的破损导致了蛋白质和DNA的泄漏,使胞内蛋白含量和DNA含量下降。
当遭遇外部极端环境和抗菌处理时,细菌细胞通常会主动改变细胞膜中脂肪酸含量和类型,进而改变细胞膜的流动性。不饱和脂肪酸有较低的熔融温度,因此,细胞膜中不饱和脂肪酸含量越高,细胞膜的流动性就越大。脂肪酸的成分和含量分析结果证明,冷等离子体处理通过刺激不饱和脂肪酸和短链脂肪酸含量的增加以及饱和脂肪酸含量的下降,间接增大了LM细胞膜的流动性。然而ZHAO等[21]报道了不一样的结果,他们发现酿酒酵母细胞膜经脉冲电场处理后,不饱和脂肪酸含量从71.14%下降到60.56%,饱和脂肪酸含量从23.6%增长到30.27%,说明脉冲电场降低了细胞膜的流动性。这种差异可能由菌种不同和处理方式不同引起,ANS荧光强度测定也证明了这个结果。冷等离子体处理后,荧光强度从8.99下降到3.73。细胞膜的流动性越大,ANS就越不容易与细胞膜的疏水区域结合,进而荧光强度也就越低。细胞膜的流动性对维持细胞的物质运输和信息交流起到了至关重要的作用,流动性的增大会导致细胞内外渗透压的失衡,加速胞内重要物质的泄漏,影响细菌细胞的生理活性。细胞膜流动性的增大提升了细胞膜的通透性,导致膜不透性的荧光探针碘化丙啶可以自由地穿过细胞膜,与细胞内的遗传物质结合并产生红色荧光。此外,通透性的增加导致了电解质和胞内离子的泄漏,菌悬液的电导率也随之提高。
细胞膜是胞内产生活性氧的主要位点,主要通过氧化呼吸链在细胞膜上进行积累。很多处理条件如紫外线处理、辐射等都会促进细菌细胞产生超过自身承受极限的ROS,从而破坏氧化还原平衡,造成细胞膜的氧化损伤[28]。REN等[29]发现抗菌剂蝶芪处理会刺激大肠杆菌和金黄色葡萄球菌细胞产生大量的ROS,这些ROS的产生与氧化应激基因的上调有关。荧光图片显示,经冷等离子体处理后,出现了大量的绿色荧光,这些绿色荧光由DCFH-DA经ROS氧化后产生的2',7'-二氯荧光素(DCF)导致,荧光强度增长,说明冷等离子体处理刺激了细胞膜上ROS 的产生和积累,改变了细胞膜完整性、流动性和通透性。ESR技术显示这些自由基可能是烷基过氧化自由基、烷氧基自由基、烃基自由基和超氧自由基,这些自由基的共同作用给细胞膜造成巨大的氧化损伤。
和是LM细胞内重要的氧化还原相关的基因,对维持LM的氧化还原平衡起着重要的作用。通过调节ROS敏感的转录抑制子的产生,从而解毒细胞内产生的内源性过氧化物和其他ROS[30]。而编码的活化剂能够催化细胞内的SOS反应,进而可以清除ROS和修复ROS造成的损伤[31]。同时,也对ROS造成的氧化损伤起到一定的调节作用[32]。qRT-PCR结果显示冷等离子体处理下调了和,上调了,说明ROS的产生与冷等离子体对这些氧化还原相关基因的调控有关,从基因层面揭示了ROS的产生机理。
4 结论
通过响应面试验设计,采用功率182 W,处理时间67 s,氮气流速52 cm3∙min-1的冷等离子体最佳抑制条件研究其对LM细胞膜完整性、流动性、通透性和氧化损伤的影响。经冷等离子体处理后,细胞膜表面可以观察到破损变形的结构,胞内蛋白质含量和DNA含量下降,细胞膜完整性被破坏。同时,经冷等离子体处理后,细胞膜磷脂不饱和脂肪酸含量增加,饱和脂肪酸含量降低,ANS荧光强度降低,细胞膜流动性增加。此外,冷等离子体增加了细胞膜的通透性,冷等离子体通过调节、和的相对表达量打破LM的氧化还原平衡,刺激了细胞膜上ROS的产生。
[1] 刘海泉, 赵强, 孙晓红, 吴启华, 潘迎婕, 赵勇. 多重PCR快速检测食品中单核细胞增生性李斯特菌. 中国农业科学, 2010, 43(23): 4893-4900.
LIU H Q, ZHAO Q, SUN X H, WU Q H, PAN Y J, ZHAO Y. Rapid detection ofin food by multiple PCR., 2010, 43(23): 4893-4900. (in Chinese)
[2] PARK S H, BALASUBRAMANIAM V M, SASTRY S K. Quality of shelf-stable low-acid vegetables processed using pressure-ohmic- thermal sterilization., 2014, 57(1): 243-252.
[3] ZHU Y L, LI C Z, CUI H Y, LIN L. Antimicrobial mechanism of pulsed light for the control ofO157:H7 and its application in carrot juice., 2019, 106: 106751.
[4] 杨天歌, 邓红, 李涵, 孟永宏, 雷佳蕾, 马婧, 郭玉蓉. 超高压杀菌处理冷破碎猕猴桃果浆的条件优化及其贮藏期杀菌效果. 中国农业科学, 2018, 51(7): 1368-1377.
YANG T G, DENG H, LI H, MENG Y H, LEI J L, MA J, GUO Y R. Optimization of ultra-high pressure sterilization conditions on the kiwi fruit pulp produced by cold crushing method and its sterilization effect during storage period., 2018, 51(7): 1368-1377. (in Chinese)
[5] 陶瑞, 史智佳, 贡慧, 杨震, 刘梦. 超声协同诱导剂对枯草芽孢杆菌芽孢致死的作用. 食品科学, 2018, 39(11): 95-100.
TAO R, SHI Z J, GONG H, YANG Z, LIU M. Inactivation ofspores by ultrasonic treatment combined with inducer., 2018, 39(11): 95-100. (in Chinese)
[6] 乔维维, 黄明明, 王佳媚, 严文静, 章建浩, 杨龙平. 低温等离子体对生鲜牛肉杀菌效果及色泽的影响. 食品科学, 2017, 38(23): 237-242.
QIAO W W, HUANG M M, WANG J M, YAN W J, ZHANG J H, YANG L P. Effect of cold plasma on sterilization and color of fresh beef., 2017, 38(23): 237-242. (in Chinese)
[7] KIM H J, YONG H I, PARK S, CHOE W, JO C. Effects of dielectric barrier discharge plasma on pathogen inactivation and the physicochemical and sensory characteristics of pork loin., 2013, 13(7): 1420-1425.
[8] 李兆杰, 杨丽君, 刘小菁, 王静, 刘玉敏, 李春喜. 辉光放电低温等离子体技术对微生物的杀菌动力学和杀菌机制. 食品科学, 2015, 36(11): 167-171.
LI Z J, YANG L J, LIU X J, WANG J, LIU Y M, LI C X. Bactericidal kinetics and mechanisms of low temperature glow discharge plasma., 2015, 36(11): 167-171. (in Chinese)
[9] LIN L, LIAO X, LI C Z, ABDEL-SAMIE M A, CUI H Y. Inhibitory effect of cold nitrogen plasma onbiofilm and its application on poultry egg preservation., 2020, 126: 109340.
[10] 张爱静, 李琳琼, 王鹏杰, 高瑀珑. 热胁迫对大肠杆菌细胞膜和膜蛋白的影响. 中国农业科学, 2020, 53(5): 1046-1057.
ZHANG A J, LI L Q, WANG P J, GAO Y L. Effects of heat stress on cell membrane and membrane protein of., 2020, 53(5): 1046-1057. (in Chinese)
[11] SANTOS A L, GOMES N C M, HENRIQUES I, ALMEIDA A, CORREIA A, CUNHA A. Contribution of reactive oxygen species to UV-B-induced damage in bacteria., 2012, 117: 40-46.
[12] 吴学友, 朱悦, 陈正行, 鞠兴荣. 乳酸菌细菌素Durancin GL对单增李斯特菌的抗菌活性及机制. 食品科学, 2019, 40(23): 73-78.
WU X Y, ZHU Y, CHEN Z H, JU X R. Antibacterial activity and mechanism of Durancin GL against., 2019, 40(23): 73-78. (in Chinese)
[13] ZHAO L, ZHANG H, HAO T Y, LI S R.antibacterial activities and mechanism of sugar fatty acid esters against five food-related bacteria., 2015, 187(15): 370-377.
[14] 李长城, 白伟娟, 贾真, 方婷, 陈锦权. 温度和盐含量对三文鱼中单增李斯特菌热失活的影响. 食品工业, 2018, 39(12): 50-53.
LI C C, BAI W J, JIA Z, FANG T, CHEN J Q. Effect of temperature and salt on thermal inactivation ofin salmon., 2018, 39(12): 50-53. (in Chinese)
[15] 王婷婷, 李春, 李佳栋, 杜鹏, 刘丽波, 徐占文, 杨雨泽. 乙醇胁迫对植物乳杆菌膜生理及粘附性的影响. 食品科学, 2019, 40(18): 63-69.
WANG T T, LI C, LI J D, DU P, LIU L B, XU Z W, YANG L Z. Effect of ethanol stress on membrane and adhesion of., 2019, 40(18): 63-69. (in Chinese)
[16] LI S G, HUANG Y, AN F P, HUANG Q, GENG F, MA M H. Hydroxyl radical-induced early stage oxidation improves the foaming and emulsifying properties of ovalbumin., 2019, 98(2): 1047-1054.
[17] CAI X T, WANG X, CHEN Y C, WANG Y D, SONG D F, GU Q. A natural biopreservative: Antibacterial action and mechanisms of ChineseHemsl. extract againstDH5α andspp., 2019, 102(11): 9663-9673.
[18] WASTON A L, CHIU N H L. Fluorometric cell-based assay for β-galactosidase activity in probiotic gram-positive bacterial cells-., 2016, 128(8): 58-60.
[19] ESCUDERO R, SEGURA J, VELASCO R, VALHONDO M, DE AVILA M, GARCIA-GARCIA A B, CAMBERO M I. Electron spin resonance (ESR) spectroscopy study of cheese treated with accelerated electrons., 2019, 276: 315-321.
[20] 李凤珠, 张玉礼杨吉霞. 运用实时荧光定量PCR法研究榨菜腌制过程中细菌和真菌的数量变化. 食品与发酵工业, 2019, 50(18): 58-64.
LI F Z, ZHANG Y L, YANG J X. Evaluation of quantity dynamics of bacteria and fungi during curing process of Zhacai by quantitative PCR., 2019, 50(18): 58-64. (in Chinese)
[21] ZHAO W, YANG R J, GU Y J, LI C Y. Effects of pulsed electric fields on cytomembrane lipids and intracellular nucleic acids of., 2014, 39: 204-213.
[22] LIU Z W, ZENG X A, NGADI M, HAN Z. Effect of cell membrane fatty acid composition ofon the resistance to pulsed electric field (PEF) treatment., 2017, 76: 18-25.
[23] GREBOWSKI J, KROKOSZ A, PUCHALA M. Membrane fluidity and activity of membrane ATPases in human erythrocytes under the influence of polyhydroxylated fullerene., 2013, 1828(2): 241-248.
[24] ANUVA S, BIJAN K P, NIKHIL G. Photophysics of DNA staining dye Propidium Iodide encapsulated in bio-mimetic micelle and genomic fish sperm DNA., 2012, 192(2): 58-67.
[25] LIU P, XIE J X, LIU J H, JIA O Y. A novel thermostable β- galactosidase fromcoagulans with excellent hydrolysis ability for lactose in whey., 2019, 102(11): 9740-9748.
[26] XIE Y F, JIANG S H, LI M, GUO Y H, CHENG Y L, QIAN H, YAO W R. Evaluation on the formation of lipid free radicals in the oxidation process of peanut oil., 2019, 104: 24-29.
[27] OLATUNDE O O, BENJAKUL S, VONGKAMJAN K. Dielectric barrier discharge cold atmospheric plasma: Bacterial inactivation mechanism., 2019, 39: 1-10.
[28] MOMTAHAN N, CROSBY C O, ZOLDAN J. The role of reactive oxygen species in icardiac maturation., 2019, 25(6): 482-493.
[29] REN X Y, AN P P, ZHAI X, WANG S, KONG Q J. The antibacterial mechanism of pterostilbene derived from xinjiang wine grape: A novel apoptosis inducer inand., 2019, 101: 100-106.
[30] RUHLAND B R, RENIERE M L. Sense and sensor ability: Redox-responsive regulators in., 2019, 47: 20-25.
[31] VAN Der VEEN S, VAN SCHALKWIJK S, MOLENAAR D, DE VOS W M, ABEE T, WELLS-BENNIK M H J. The SOS response ofis involved in stress resistance and mutagenesis., 2010, 156(2): 374-384.
[32] FERREIRA A, O'BYRNE C P, BOOR K J. Role of sigma (B) in heat, ethanol, acid, and oxidative stress resistance and during carbon starvation in., 2001, 67(10): 4454-4457.
Antibacterial Mechanism of Cold Plasma Against
DOU Yong1, YAO MiaoAi1, LÜ HuaiZhong1, HU PeiHong2, DONG Jing1
(1Department of Grain Engineering and Food & Drug, Jiangsu Vocational College of Finance & Economics, Huai’an 223003, Jiangsu;2Huai’an Zhengchang Feed Co., Ltd, Huai’an 223003, Jiangsu)
【】As a novel non-thermal sterilization technology, the cold plasma has been widely applied in food industry. The aim of this study was to explore the antibacteral mechanism of cold plasma against bacteria at cytomembrane level, thus providing a foundation for the application of the cold plasma in food industry. 【】In this study, the(LM) was selected as the test strain. After cold plasma treatment, the changes of morphology and intracellular materials were detected to reveal the integrity of LM cytomembranes. The changes of cell membrane fatty acid content and type, as well as the 8-aniline-1-naphthalene sulfonic acid (ANS) fluorescence intensity were also measured to detect the fluidity change of cytomembranes after cold plasma treatment. The changes of cytomembrane permeabilization were detected by propidium iodide (PI) fluorescence, conductivity and-galactosidase activity. Finally, in order to demonstrate the oxidative damage of LM cytomembrane caused by cold plasma treatment, the changes of reactive oxygen species (ROS) and reactive oxygen species related genes were detected as well. 【】After cold plasma treatment, damaged and deformed structures were observed on the surface of the LM cytomembrane, the contents of proteins and DNA were decreased by 68 mg∙mL-1and 14 μg∙mL-1, respectively, which showed that cold plasma destroyed the integrity of cytomembrane. After cold plasma treatment, the content of unsaturated fatty acids in LM cytomembrane increased from 40.17% to 53.91%, along with the decrease of saturated fatty acids from 53.68% to 41.57%. The ANS fluorescence intensity decreased from 8.99 to 3.73, indicating the increase of cytomembrane fluidity caused by cold plasma action. In addition, cold plasma treatment resulted in the penetration of PI and reacted with DNA to emit red fluorescence. By analyzing the changes of-galactosidase activity and conductivity (increased from 0.15 mS∙cm-1to 0.33 mS∙cm-1), it was concluded that the cold plasma enhanced the permeabilization of LM cytomembrane. The changes of ROS fluorescence intensity indicated that cold plasma stimulated the generation of ROS on cytomembrane, thus exerting oxidative damage to cytomembrane. Finally, the results of qRT-PCR showed that cold plasma down-regulated the expression ofandgenes by 43.29% and 52.71%, while up-regulated the expression ofgene by 89.42%, which disclosed the regulatory mechanism of oxidative stress in microorganism at genic level.【】Through the action on cell membrane of the active groups of cold plasma, the viability of LM was inhibited and eventually died.
cold plasma;; cytomembrane; fluidity; oxidative damages

10.3864/j.issn.0578-1752.2020.24.013
2020-04-17;
2020-06-10
江苏省政策性引导项目--苏北科技专项富民强县项目(SZ-HA2019011)、2018年江苏省“333”第五期人才资助项目、2016年江苏省“青蓝工程”资助项目(苏教师(2016)15号)、江苏财经职业技术学院优秀科研团队项目、2018年淮安市第二期“533英才工程”项目
作者及通信作者窦勇,E-mail:douyong1979@163.com
(责任编辑 赵伶俐)

