富铜微生物的筛选以及其培养条件优化
鲁 陈, 刁 欢, 丁小玲, 代张超, 闫一博, 李吕木*
(1.安徽农业大学动物科技学院,安徽合肥 230036;2.安徽新华学院药学院,安徽合肥 230081)
铜是动物的必需微量元素。一系列的试验证明,饲喂高出需要量的高铜日粮,可促进猪的生长,较为经济有效的饲喂量为110~250 mg/kg(Ma 等,2015;李永义等,2002;Hill等,2000)。 然而,目前高铜的来源主要是无机硫酸铜,因为其价格便宜。但是猪对其吸收率低,导致粪尿铜排泄多,对环境污染严重(Huang等,2007)。基于此,我国农业农村部2009年对饲粮中铜含量进行了限量规定,限定铜的最高添加量断奶仔猪为200 mg/kg,生长肥育猪为150 mg/kg,尽量降低残留和对环境的污染。与此同时,低残留的有机铜饲料添加剂先后被开发出来,如碱式氯化铜 (Guo等,2017)、氨基酸螯合铜 (Jarosz等,2017)、壳聚糖铜(Yue 等,2016)和酵母铜(Lim等,2006)等。但是这些有机铜源生产成本高(Feng等,2014)。因此,研发既高效又经济的饲用有机铜添加剂,对促进绿色饲料添加剂的发展具有重要的现实意义。Fomchenko(2015)等研究发现,微生物能富集转化无机铜为微生物有机铜,且具有比表面积大、吸附容量大、操作简单和成本低等优点,因此,微生物有机铜如酵母铜,受到人们的青睐,但这类高铜菌的筛选主要是利用传统的饲用微生物作为资源进行驯化,通过长时间铜诱导培养来获得高铜菌,这种获得性遗传的遗传稳定性差,易退化,富铜能力也会随之下降。为此,本研究拟从富铜土壤中筛选高铜菌株,以期获得将无机铜转化为微生物有机铜的高效菌株,为养猪生产提供高效廉价的新型有机铜添加剂。
1 材料和方法
1.1 主要仪器 火焰原子吸收光谱仪(德国耶拿分析仪器股份公司,型号:ZEEnit700p);恒温摇床(上海三发科技有限公司,型号:ZHP-250);烘箱(合肥达斯卡特科学有限公司,型号:DGTG82A);消化炉(上海科恒实业发展有限公司,型号:ML-3-4);pH计 (上海盛磁仪器有限公司,型号:PHS-25)。
1.2 筛选材料和培养基 筛选材料:安徽省铜陵市一废弃铜矿土壤。
NB培养基:牛肉膏5 g,蛋白胨10 g,氯化钠5 g,水 1000 mL,pH 7.2 ~ 7.4;PDA 培养基:马铃薯 200 g,葡萄糖 20 g,水 1000 mL,pH 7.0 ~ 7.2;固体培养基:由上述的培养基加入2%的琼脂制成。以上培养基均在121℃,灭菌30 min;含Cu2+培养基:将上述培养基灭菌后,加入无菌的硫酸铜溶液,分别配制浓度为 200、400、600、800 mg/L 和1000 mg/L的5种含Cu2+培养基。
1.3 菌株的分离和筛选
1.3.1 土样的采集及处理 刮去表层土壤,采集5~10 cm处土样约100 g于信封中保存备用。取土壤10 g,放入有90 mL无菌水的三角瓶中,振荡均匀。然后进行10倍梯度稀释,依次制备10-3、10-4、10-5、10-6、10-7稀释度的土壤稀释液。
1.3.2 富铜菌种的分离和筛选 在无菌条件下吸取0.1 mL相应浓度土壤稀释液,用涂布平板法涂布分别将细菌和真菌涂布在NB和PDA固体培养基上,NB固体培养基在37℃生化恒温培养箱培养2 d;PDA固体培养基在30℃生化恒温培养箱培养,培养3 d后观察,挑取不同形态单菌落进行纯化培养,编号并保存菌种。
将筛选出的菌株涂布到Cu2+浓度为200 mg/L的培养基中培养,记录耐受力高的菌株,并将耐受菌株再接种到Cu2+浓度为400 mg/L的培养基上培养观察。按此方法,依次将耐受菌株接种到Cu2+浓度为600、800、1000 mg/L的培养基进行筛选培养并观察其生长情况,逐步淘汰耐铜能力差的菌株,筛选出耐受力高的菌株。将耐受力高的菌株进行富铜转化率的复筛,最后选择耐铜力高的菌株进行形态学观察并送宝生物工程(大连)有限公司进行26S rDNA鉴定并测序,使用 NCBI中的Blast软件分析菌株测序结果。
1.4 胞内铜含量的测定 称取0.3 g左右于60℃完全干燥至恒重的菌体于烧杯中,加入10 mL混合酸(硝酸:高氯酸 4:1),置于消化炉上,消化至透亮,冷却。转移溶液至50 mL容量瓶中,加去离子水定容,然后用火焰原子分光光度计测量铜离子含量(Jorhem 等,2000)。
1.5 培养条件对无机铜转化为微生物铜的影响
1.5.1 铜浓度对无机铜转化为微生物铜的影响将种子液按1%的接种量接种在浓度为2、4、6、8、10 mg/L的PDA液体培养基进行培养,30℃,200 r/min条件下振荡培养5 d,三层滤纸过滤收集菌体,用生理盐水洗三次,菌体置于透析袋中用去离子水透析,直至透析袋外水中无铜离子。于60℃烘箱中烘至恒重,依方法1.4所示测定菌体的胞内铜含量。
1.5.2 菌液接种量对无机铜转化为微生物铜的影响 在500 mL的锥形瓶中加入200 mL铜含量为2 mg/L的PDA培养基,将菌液分别按接种量1%、3%、5%、7%、9%(V/V)接种,每组 3个平行,在30℃,200 r/min条件下摇瓶培养5 d,测定铜含量。
1.5.3 培养时间对无机铜转化为微生物铜的影响 在500 mL的锥形瓶中加入200 mL铜含量为2 mg/L的PDA培养基,将菌液按1%的接种量接种后,在 30 ℃,200 r/min 条件下,放置 2、3、4、5、6、7 d六种不同的培养时间摇瓶培养,每组3个平行试验,测定铜含量。
1.5.4 培养温度对无机铜转化为微生物铜的影响 在500 mL的锥形瓶中加入200 mL铜含量为2 mg/L的PDA培养基,将菌株按1%的接种量接种后,分别在 26、28、30、32、34 ℃五种不同温度下,200 r/min条件下摇瓶培养5 d,每组3个平行,测定铜含量。
1.5.5 pH对无机铜转化为微生物铜的影响 在500 mL的锥形瓶中加入200 mL铜含量为2 mg/L,pH 分别为 2.0、3.0、4.0、5.0、6.0、7.0 的 PDA 培养基,将菌株按1%的接种量接种后,每组3个平行试验,在30℃,200 r/min条件下摇瓶培养5 d后,测定铜含量。
1.5.6 正交优化培养条件 根据单因素试验结果,采用 L9(34)正交试验方法,对温度(A)、pH(B)、接种量(C)、培养时间(D)4 因素 3 水平进行优化。
1.6 转化率测定 转化率计算公式如下:
转化率/%=A/B×100;
式中:A为微生物胞内含铜量,mg;B为培养基中添加的无机铜量,mg。
1.7 数据统计与分析 采用 Microsoft Excel软件对试验数据进行初步整理,采用SPSS 20.0软件对微生物铜转化率进行单因素方差分析和多重比较,并以邓肯新复极差法对培养条件进行差异显著性多重比较,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 菌种的鉴定 在高铜土壤中筛选得到31株菌株(表1),其中细菌18株,真菌13株。其中能耐受培养基铜浓度为200 mg/L的菌株有细菌15株,真菌10株;能耐受培养基铜浓度为400 mg/L的菌株有细菌13株,真菌8株;能耐受培养基铜浓度为600 mg/L的菌株有细菌5株,真菌6株;能耐受培养基铜浓度为800 mg/L的菌株有细菌2株,真菌5株;能耐受培养基铜浓度为1000 mg/L的只有真菌4株,细菌均不能耐受。在此4株真菌中,长势最好的两株FT5和FT7经鉴定分别为青霉菌和黑曲霉菌。由于前者为非饲用微生物,不再用于后续研究。

表1 不同菌株对Cu2+的耐受性
耐铜真菌FT7,形态学观察菌株顶部形成球形顶囊,其上全面覆盖一层梗基和一层小梗,小梗上长有成串褐黑色的球状,直径2.5~4.0 μm。分生孢子头球状,直径700~800 μm,褐黑色。蔓延迅速,初为白色,后变成鲜黄色直至黑色厚绒状,背面无色或中央略带黄褐色。分生孢子头褐黑色放射状,分生孢子梗长短不一,顶囊球形,双层小梗,分生孢子褐色球形。其基因序列已经在Gen-Bank注册,登陆号为MG712304。
将FT7的测序结果输入GenBank,并用Blast软件进行同源性比较,挑选同源性高的菌株及同属其他种的菌株构建系统发育树如图1,与黑曲霉属的多个菌株具有同源性,与黑曲霉(Aspergillus niger strain JX999490.1)同源性达到100%,说明FT7为黑曲霉。
2.2 培养条件优化 由表2可见,随着培养基铜浓度逐渐增加,微生物富铜转化率逐渐降低,培养基铜浓度为2 mg/L时,微生物铜得率最高,为83.53%,培养基铜剩余量为0.33 mg/L,低于0.5 mg/L,达到污水排放标准(GB/T 8978-1996,1996),因此确定培养基铜的浓度为2 mg/L。
由表2可见,接种量会显著影响转化率(P<0.05),随着接种量的逐渐增大,富铜菌的富集转化率逐渐增加,接种量达3%时,随着接种量的增加,转化率达到稳定,最大转化率为84.96%,说明在菌种接种量为3%时,菌种数量和培养基营养物质的量达到最适合的比例,有利于菌体吸收培养基中的铜元素;培养时间也会显著影响转化率(P<0.05),随着培养时间的增加转化率逐渐增加,当培养5 d时,转化率达到一个峰值,转化率为85.14%,随后随着时间的增加转化率达到稳定,该结果也说明在菌体培养5 d后,菌体生长增加变缓,生长进入或达到稳定期,同时菌体对铜离子的富集达到最佳。
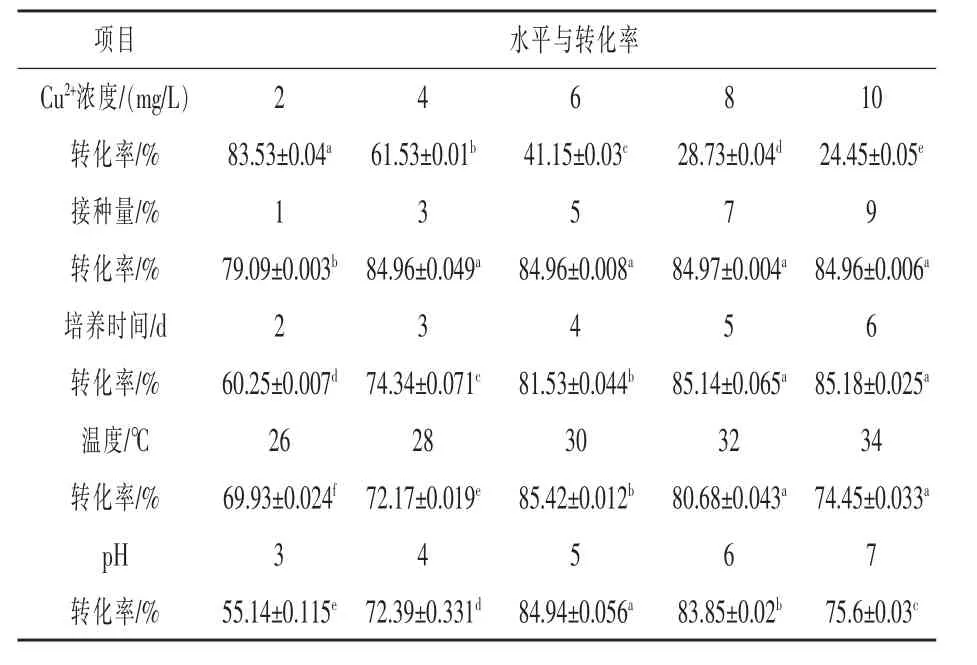
表2 培养基铜浓度、接种量、培养时间、温度和pH对微生物富铜转化率的影响
温度对转化率具有显著影响(P<0.05),26~30℃,随着培养温度的增加,转化率逐渐增加,30℃时转化率达到最大,为85.42%,随后随着培养温度增加,转化率逐渐降低;培养基初始pH对富集转化率也具有显著影响(P<0.05),开始随着pH逐渐增加,转化率逐渐增加,当初始pH为5时转化率最大,为84.94%,随后随着pH增加,转化率逐渐下降。
由表3正交试验结果可见,对转化率影响最大的是pH,其次是温度,最后是时间和接种量,即pH>温度>时间>接种量。因此得到最优组合为A1B2C3D3,即培养温度29.5℃、pH 5、接种量4%和培养时间5.5 d。验证该条件下的转化率为87.65%,高于正交试验中的所有组合,证明其确为最优组合条件。
由表4可知,温度、pH、接种量和时间都能极显著影响转化率(P<0.01),各水平之间差异显著(P<0.05)。
3 讨论
3.1 富铜菌的分离筛选与鉴定 一般在受重金属污染的地区都可以筛选到抗重金属的微生物,这些微生物都通过菌体表面电荷、离子泵、载体协助、脂类过度氧化和复合物渗透等完成对金属离子的吸附(Li等,2015;Xia 等,2013),并通过胞外吸附和胞内螯合完成富集 (Anahid等,2011)。因此,本研究以高铜土壤为原料进行富铜微生物筛选,最终筛得一株耐高铜真菌,耐铜量达到1000 mg/mL,说明有针对性的采集样本,可以提高筛选效率。
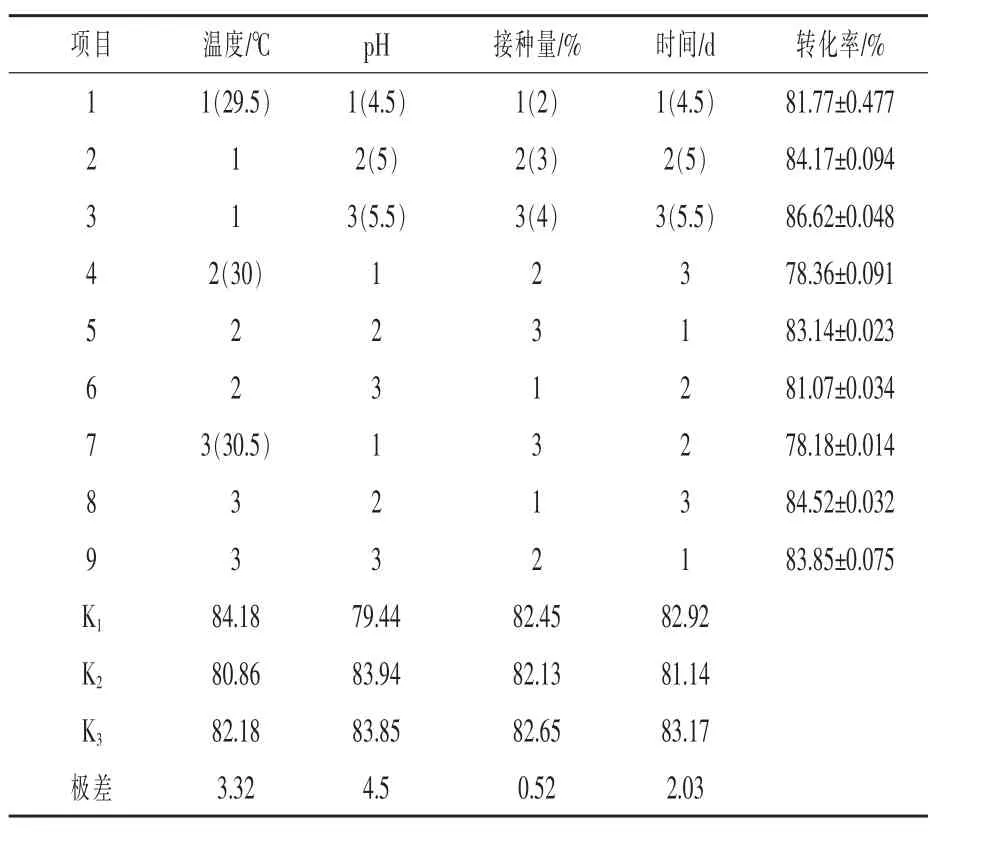
表3 正交试验结果与分析
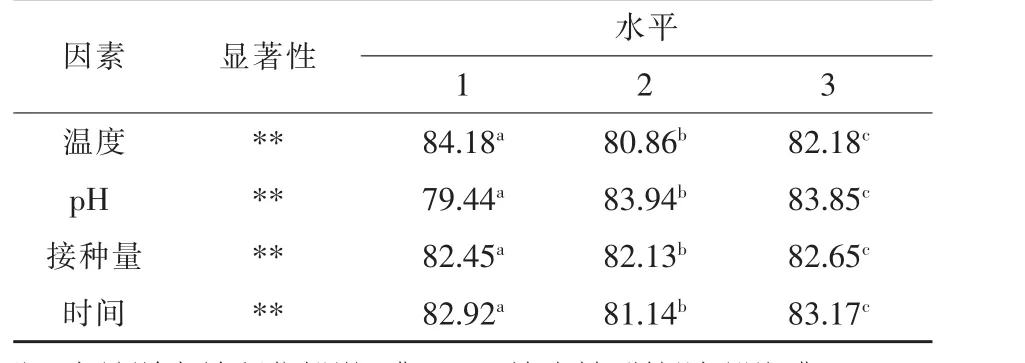
表4 Duncan’s多重比较
3.2 富铜微生物菌体的洗脱 目前对与洗脱活菌体的缓冲液报道较少,本试验以上清液中铜的浓度为指标,采用先通过生理盐水冲洗三遍,然后通过透析袋在去离子水中透析直到上清液中测不出铜离子,对富铜菌体进行洗脱,以洗掉菌体表面吸附不牢固的无机铜,确保得到都是微生物铜。菌体在吸附金属离子的过程中,金属铜离子通过与细胞表面特别是与细胞壁结构(蛋白质、多糖、脂类等)中的化学基团(如羧基、羟基、磷酰基、酰胺基、硫酸脂基、氨基、硫基等)的相互作用,吸附螯合到细胞表面(陈灿等,2006)。与同类其他文章通过EDTA缓冲液洗脱菌体相比,EDTA缓冲液螯合能力强,会去除螯合细胞壁上的金属铜。本试验采用的洗脱方法能更好地保留螯合在细胞表面的铜离子,可以获得更多的有机铜。
3.3 培养条件优化 菌液的接种量过多或过少都会影响转化率,本试验中,接种量过低(1%)时,铜转化率低,接种量逐渐增加达到一定量 (3%)时,转化率逐渐升高并达到稳定。这可能是由于Cu2+的浓度一定时,菌体数量增加,活性吸附点增多,菌体表面与金属离子接触和结合的机会也增加,必然有更多的Cu2+被吸附,相应地使Cu2+的吸附率增大;但超过一定范围后,随着菌体数量的增加,菌体细胞之间两性基团的相互结合作用不断增加,占据了部分有效的结合位点 (林海等,2013)。因而当菌液接种量一定时,转化率不会随着菌液添加量的增大而增大(∨Sillerová等,2012)。
培养温度不仅对微生物的生长和新陈代谢有影响,而且影响微生物细胞内酶的活性。因此,不同微生物富集转化铜的温度都不一样,如假单胞菌USTB-E,在温度为35℃时富集性能最好(王海鸥等,2011)。本试验获得的黑曲霉FT7最佳富集转化率温度为29.5℃,说明温度过高可能导致菌株内酶的活性降低甚至丧失,影响菌株的生长代谢,造成菌株FT7转化率低。温度过低,菌株生长缓慢并导致体内酶活性降低,从而减少菌体内代谢产物的生成和积累,降低微生物铜产生,减少积累量,降低转化率。
pH对微生物的生长影响显著,因为微生物生长过程中机体内发生的大多数酶促反应都需要一个适宜的pH范围,只有在合适的pH范围内,酶促反应的速率才会达到最高,低于或者高于这个范围,微生物的生长就会受到抑制。pH通过影响细胞质膜的通透性、膜结构的稳定性、物质的溶解性和表面电荷氧化还原电位来影响营养物质的吸收,从而影响物生物的生长速率(Liu等,2014;叶锦韶等,2011)。本试验初始pH为5时,转化率最大,为84.94%,随后随着pH的增加转化率下降,pH低于5时,随着pH的增加而转化率增加,说明该菌在碱性环境下转化率较差,在弱酸性条件下有较高富铜转化率。
4 结论
从高铜土壤中筛选得到一株真菌FT7,经分子生物学鉴定为黑曲霉。在铜浓度为2 mg/L的条件下,菌株FT7转化铜的最佳培养条件为温度29.5℃、pH 5、接种量4%和培养时间5.5 d,该条件下其转化率可达87.65%。

