国内外生产用传代细胞系致瘤性检验方法的比较与分析
王 磊,杨承槐,刘 莹
(中国兽医药品监察所,北京 100081)
1 概 况
自1981年,World Health Organization(WHO) 生物制品标准化专家委员会(Expert Committee on Biological Standardization,ECBS)第一次批准使用纯净的传代细胞系用于骨髓灰质炎疫苗的生产后,针对传代细胞系作为生产用细胞基质的安全性争论已经持续了近半个世纪[1]。对于如何评价作为生产用基质的传代细胞系是否安全依然是目前各国药品监管机构关心和讨论的重点问题之一。传代细胞系的安全性主要体现在两个方面:一是细胞本身是否纯净,有无携带外源因子;二是细胞及其组分(包括外源因子、细胞DNA和细胞裂解物等)是否具有致瘤性特性[2]。传代细胞系失去了细胞接触抑制的特性,具有体外无限增殖的能力,存在发生恶性转化和致瘤性风险。传代细胞系自身的致瘤性与否会直接关系到作为生产用基质的生物制品种类、质量标准制定等诸多方面[3-4]。在2010年第61届生物制品标准化专家委员会发布了关于生物制品生产用动物源性细胞基质技术指南(简称技术指南)即WHO动物细胞基质生产生物医药产品和细胞库特性的评价建议(Recommendations for the Evaluation of Animal Cell Culture as Substrates for the Manufacture of Biological Medicinal Products and for the Characterization)[5]。2013年,ECBS对其进行了修订,发布了最新版本的技术指南。该技术指南旨在为各国药品监管机构制定关于生产用细胞库的检定与特性描述的相关技术要求时提供必要参考。各国家可以结合自身情况,对技术指南内容做必要修改或者直接采纳作为本国技术要求[6]。下面对WHO技术指南中关于生产用传代细胞系致瘤性检验的相关要求进行介绍并同我国现行兽药典中的致瘤性检验要求进行梳理和比较,以期为完善我国生产用传代细胞系致瘤性评价的技术要求提供参考。
2 WHO技术指南与现行兽药典中关于致瘤性检验方法和检测对象的要求
由于WHO技术指南是生物制品生产用细胞基质的通用要求,因此,具有普适性,适用对象比较宽泛,主要包括新建二倍体细胞系(除公认无致瘤性细胞(如WI-38、MRC-5、FRhL-2))、传代细胞系(除了杂交瘤细胞和公认有致瘤性细胞系(如BHK-21、CHO、HEK293、CL27))、干细胞系。致瘤性检测方法分为两类,一是动物体内成瘤法(简称体内法);二是动物体外检测方法(软琼脂克隆形成实验)。我国兽用生物制品采用原代细胞和传代细胞系作为生产基质。原代细胞是公认不存在致瘤性的风险的基质。因此,我国兽药典中致瘤性检验的对象只包括了传代细胞系,并采用动物体内成瘤法作为检验方法[7]。
3 动物体内成瘤法
动物体内成瘤法是评价细胞系致瘤性与否的标准方法。该方法是按照规定选择动物的种类,以一定量的活细胞培养物或者裂解产物接种实验动物,培养一段时间后,通过剖检和病理学检查是否有肿瘤细胞生长来判定细胞的致瘤性。动物体内法具有检验敏感性好、判定结果直观等诸多优点,是细胞致瘤性检验的经典方法。
表1中对现行兽药典和WHO技术指南收录的采用动物体内成瘤法进行致瘤性检验的要求进行了简单梳理。WHO技术指南采用动物体内成瘤法评价细胞系致瘤性时,分为了两个层次进行评价即成瘤性检验和致瘤性检验。成瘤性检验是对传代细胞系活培养物在动物体内成瘤能力的检查,是细胞系本身生物特性体现。在成瘤性检验中产生的肿瘤细胞一部分来自接种的待检细胞活培养物,另一部分则来自待检细胞诱导实验动物细胞形成的。当某种特定的细胞系成瘤性检验呈阳性时,即开展致瘤性检验。WHO技术指南要求的致瘤性检验是检查细胞组分(包括细胞裂解物、细胞DNA和外源因子等)在动物体内是否可以诱导形成肿瘤,因此,致瘤性检验中产生的肿瘤细胞完全由待检细胞组分中包含的致瘤因子诱导实验动物细胞形成。
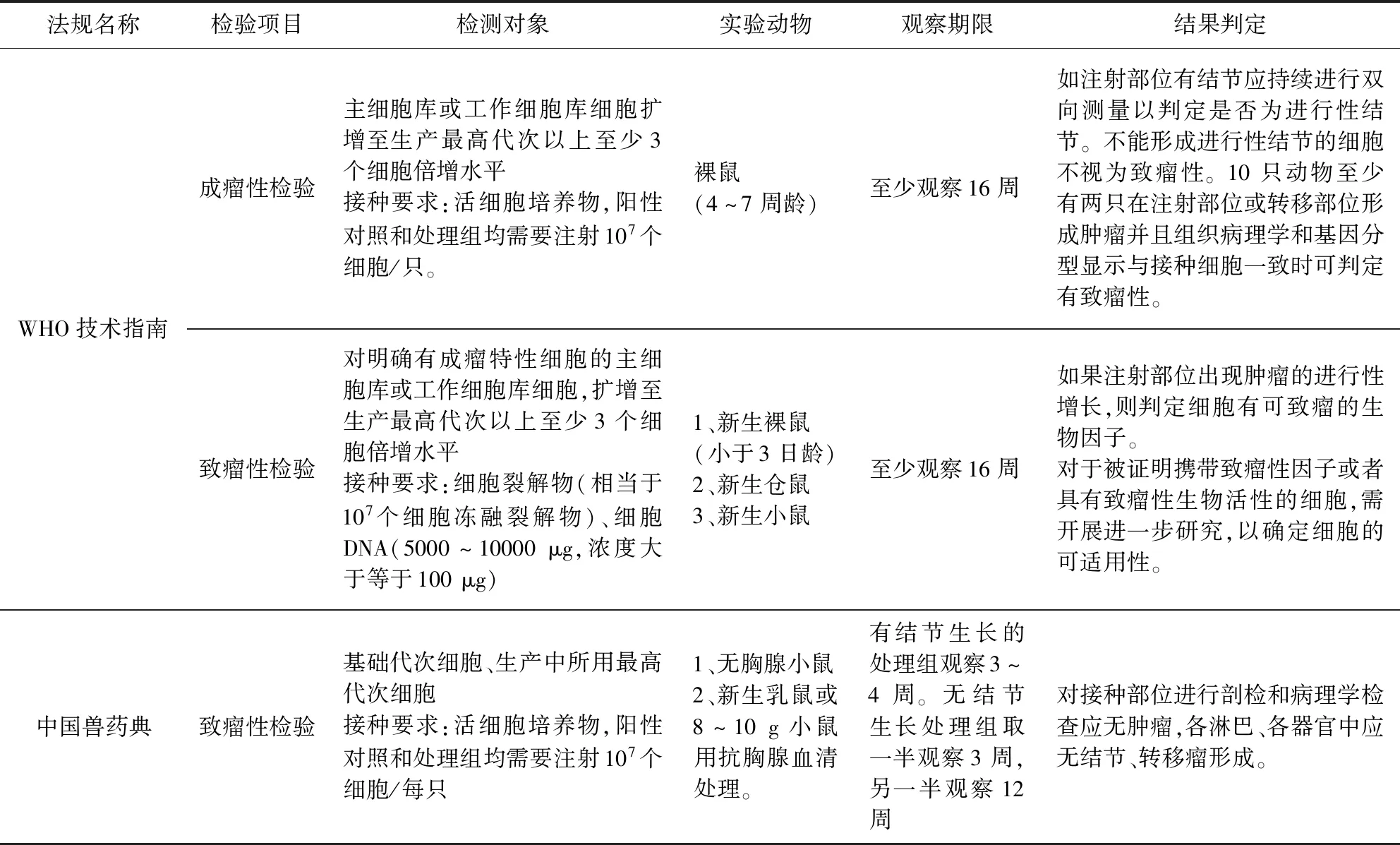
表1 现行兽药典与WHO技术指南在采用动物体内成瘤法进行致瘤性检验的要求[6-7]Tab 1 Requirements of Current Veterinary Pharmacopoeia and WHO technical guidelines for tumorigenicity test by in vivo[6-7]
现行版兽药典的致瘤性检验要求大致对应了WHO技术指南中成瘤性检验的方法。但是,目前在我国兽用灭活疫苗的研发和生产当中,使用了大量的成瘤性检验阳性的细胞(如BHK-21、PK-15、Marc-145细胞等)作为生产用细胞基质[8-9]。而现有方法还不能全面的了解和评估这些细胞在破碎裂解后是否依然会携带致瘤因子诱导宿主产生肿瘤。因此,建议参照WHO技术指南的方法,将成瘤阳性细胞检验进一步细化,评价成瘤阳性细胞组分(破碎裂解细胞或者细胞DNA等)是否完全不会携带致瘤因子,同时评价对生物制品的灭活工艺是否可以完全消除成瘤阳性或致瘤阳性细胞造成的潜在致瘤风险。
3.1 实验动物选用 目前在成瘤性/致瘤性实验规定的实验动物主要包括成年无胸腺小鼠、新生无胸腺小鼠和用抗胸腺血清/球蛋白处理的小鼠(新生乳鼠、仓鼠或8~10 g小鼠)。表2对于几种实验动物在致瘤性检验中的优缺点进行了比较。
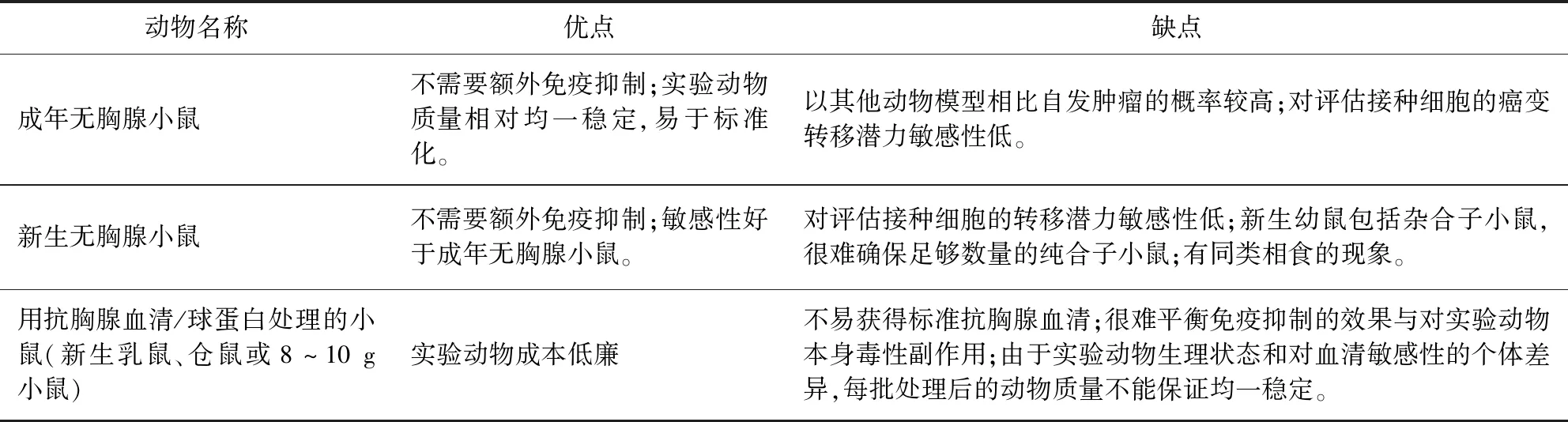
表2 实验动物模型在致瘤性检验中的优缺点比较Tab 2 Comparison of advantages and disadvantages of several experimental animal models in tumorigenicity test
WHO技术指南中成瘤性检验只要求成年的无胸腺小鼠。我国兽药典除此之外还补充了用抗胸腺血清处理的新生乳鼠或8~10 g小鼠亦可作为实验动物并对以上动物任选其一。不同实验动物对同一因素的反应虽然往往是相似的, 但有它的特殊性,因此,检验中常要选用那些对待检细胞最敏感的动物作为检验对象。成年无胸腺小鼠容易获得,可以满足多数常用生产用细胞的致瘤性检验。而抗胸腺血清/球蛋白处理的小鼠虽不易获得,但是是检测待检细胞癌变转移潜力的敏感模型,可以用于检测有潜在形成转移瘤风险的细胞系[7]。因此,我国兽药典在选用动物模型对传代细胞系进行致瘤性检验时,补充了其他可选择的实验动物,没有局限于无胸腺小鼠, 是有其科学性的。
3.2 结果判定 WHO技术指南的结果判定标准注重在一定时间内对注射部位产生的肿块动态生长过程的监测。肿块如果在观察期内可以自行消退或经双向测量判断为非进行性结节,那么判定为不具有致瘤性。10只动物至少有两只在注射部位或转移部位形成肿瘤,判定为致瘤。此外,在分析实验动物肿瘤的形成时,要求肿块的组织病理学和基因分型结果应接种细胞一致,就避免了由于实验动物模型自身的免疫缺陷造成自发形成肿瘤对检验结果的干扰,因此,更加科学。兽药典相比之下更加注重判定时间点的检查结果,3~5周时对实验动物进行剖检,即使有一只动物出现非进行性结节没有完全消退的情况,也应判定为有致瘤性,因此,兽药典结果判定更加严格。
4 体外检测方法
虽然动物体内成瘤法是致瘤性检验的“金标准”。但依然存在实验周期长、实验过程复杂、检验成本较高、实验动物质量不稳定等缺点。此外,用于体内法成瘤实验的动物模型体温37±1 ℃并不适用于所有传代细胞系的常规培养温度(如昆虫细胞SF9培养温度为28 ℃,禽类细胞DF-1的最佳培养温度为39 ℃),针对这类细胞动物体内法成瘤实验并不能全面的反映出细胞自身的致瘤特性。因此,WHO技术指南以动物体内成瘤法作为标准方法的基础上,还增加了一些体外检测方法加以辅助,以对特定细胞的致瘤性与否进行综合判定。
软琼脂克隆形成实验作为WHO技术指南推荐体外检测方法可检测细胞的致瘤性。该方法也是中国药典以及欧洲药典的推荐方法[10-11]。其利用了恶性转化细胞培养时细胞伸展性差、接触抑制消失,并不具备锚定依赖性,可以在软琼脂内增殖的原理。也常被用于肿瘤细胞的分离纯化、单克隆抗体杂交瘤细胞的克隆筛选和抗肿瘤药物的体外抑瘤活性的评价[12]。由于软琼脂克隆法过于敏感,并且其结果与动物体内成瘤法的结果的一致性和相关性还需进一步验证,因此,该方法只能作为检测某些不适用于动物体内成瘤法检验致瘤性的特定细胞系的补充替代方法。
5 其他问题及建议
WHO动物细胞基质生产生物医药产品和细胞库特性的评价建议,对生物制品生产用细胞基质的检定和安全性评价提供了非常有意义的参考。因此,建议根据WHO技术指南中采用动物体内成瘤法进行致瘤性检验的要求,结合我国实际情况对下一版兽药典中对传代细胞系致瘤性检验的要求进行进一步细化完善。由于,目前没有一种方法可以全面客观的评估所有传代细胞系的致瘤性风险。针对特定的细胞系根据其特点选择适合的检验方法显得尤为重要。因此,建议增加适当的体外检测方法作为补充评价的方法。
目前在国内,新兽用生物制品研发过程中对于生产用传代细胞系的致瘤性评价都是由研发单位自主完成。从最大限度降低农产品质量安全风险的角度考虑,建议对于初检成瘤性阳性的特定细胞,应送交国家指定机构完成进一步的安全性评价,以判定是否可以用于特定生物制品的生产。
以传代细胞系作为生产基质的兽用生物制品在新上市监测期内,应要求研发、生产企业收集新兽药的致瘤性风险信息资料。兽药管理部门也应与检疫部门、畜牧企业、屠宰企业和宠物医院联动,定期开展经济动物和伴侣动物的肿瘤病流行病学调查,汇总相关数据,以便综合分析研判疫苗用药与肿瘤发生的相关性,对成品兽用疫苗以及生产用细胞基质安全性评价方法的适用性、可行性提供技术参考,以最大限度的保障农产品质量的安全。

