部分血浆置换联合双重血浆分子吸附对慢加急性肝衰竭患者短期生存率的影响
陈黎 林杨 刘旭东 刘容 唐艳芳 刘丽
广西中医药大学附属瑞康医院肝病科(南宁530011)
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是在慢性肝病的基础上,多种诱因促发的以胆红素急剧升高和凝血酶原时间明显延长为表现的临床综合征,其特征在于潜在的慢性肝病迅速恶化,伴有多器官衰竭和较高的短期病死率。由于ACLF短期病死率较高、治疗手段匮乏及治疗效果不确切,使探索降低ACLF病死率的治疗方法及影响预后因素显得格外重要。目前,人工肝被认为是治疗ACLF效果较好且获益最多的一种治疗方案[1-3]。以往以血浆置换(plasma exchange,PE)为主的人工肝模式每次都需要消耗大量的血浆(2 500 ~3 000 mL),由于目前血浆供给日趋紧张,限制了临床的开展。前期临床应用的双重血浆分子吸附(double plasma molecular adsorption system,DPMAS)联合部分PE(血浆800 mL)作为一种创新型组合式人工肝模式,不仅可以缓解血浆置换模式所带来的血浆紧缺问题,降低胆红素的同时,也能清除体内各种毒素、炎症介质和细胞因子,补充凝血因子,改善凝血功能,促进肝脏功能恢复,二者联合在发挥彼此优势的同时相互弥补不足,实现治疗最大化[4],本研究着重探讨采取DPMAS联合部分PE模式或PE模式治疗ACLF患者疗效,对比两种方案对ACLF患者短期生存率的影响,以期为ACLF的治疗提供优选方案,现报道如下。
1 资料与方法
1.1 病例来源本研究回顾收集的53例患者均为2013年1月至2019年6月在广西中医药大学附属瑞康医院肝病科住院部接受人工肝治疗的慢加急性肝衰竭患者,采用DPMAS联合部分PE模式30例,采用PE模式23例。DPMAS联合部分PE模式组中男20例,女10例,平均年龄(49.3 ±12.08)岁;ACLF病程分期:早期13例,中期13例,晚期4例;病因分类:乙型肝炎19例,乙型肝炎合并酒精性肝病6例,药物性肝病5例。MELD评分为10 ~19分的有17例,20 ~29分的有8例,30 ~39分的有5例;PE模式组男20例,女3例,平均年龄(46.7±10.9)岁;ACLF病程分期:早期9例,中期7例,晚期7例。病因分类:乙型肝炎19例,乙型肝炎合并酒精性肝病6例,药物性肝病5例。MELD评分为10 ~19分的有13例,20 ~29分的有5例,30 ~39分的有5例。
诊断均符合2012年中华医学会感染病学分会肝衰竭与人工肝学组和中华医学会肝病学会重型肝病与人工肝学组《肝衰竭诊治指南(2012年版)》[1]中慢加急性肝衰竭诊断标准。
1.2 治疗方案两组患者入院后均在常规内科治疗的基础上,包括卧床休息、能量支持、退黄降酶等对症治疗等,同时应用人工肝机(伟力血液净化-人工肝支持系统-WLXGX-8888)进行PE模式或DPMAS联合部分PE模式的人工肝治疗。术前均建立深静脉血管通路,人工肝机连接血液净化体外循环管路(宁波天益医疗器械股份有限公司),使用含4%肝素钠盐水2 500 mL预冲管路。(1)PE模式:用血浆分离器(bellco microplas mps 05,国械注进20163454896,意大利贝而克有限公司)缓慢分离血浆2 500 ~3 000 mL,同时补充同型新鲜血浆2 500 ~3 000 mL,血流速度100 ~120 mL/min,治疗时间约2.5 h。(2)DPMAS序贯半量PE模式:血浆分离器(bellco microplas mps 05,国械注进20163454896,意大利贝而克有限公司)分离血浆后,经一次性使用血浆胆红素吸附器BS330(国械注准20163450373,健帆生物科技集团股份有限公司生产)及一次性使用血液灌流器HA330-Ⅱ型(国械注准20163451181,健帆生物科技集团股份有限公司生产)吸附血浆中胆红素及炎症因子等,血流速度100 ~150 mL/min,治疗时间不少于2.5 h,吸附血浆量约5 L。序贯血浆置换模式,拆除胆红素吸附柱及血液灌流器,继续分离血浆,同时补充同型新鲜血浆800 mL,治疗时间0.5 h,全部治疗时间3 h。根据患者自身的耐受情况、临床症状和体征以及血液生化指标的改善程度决定每次人工肝治疗间隔时间(2 ~4 d/次)。
1.3 观察指标(1)两组患者治疗4、12周累积生存率(因病情恶化自动出院的患者按病死统计);(2)两组患者人工肝治疗前及治疗后肝功能、血常规、电解质及凝血功能等指标。
1.4 统计学方法原始数据的收集整理录入采用Excel 2007版。采用SPSS 19.0统计软件包对所有数据进行统计分析。两组间的比较,计量资料服从正态分布的采用独立样本t检验,不服从正态的采用两独立样本的非参数Wilcoxon秩和检验,两独立样本计数资料采用卡方检验,两相关样本计数资料采用配对χ2检验。正态分布资料数据用均数±标准差表示,非正态分布资料数据用M(P25,P75)表示。P <0.05为差异具有统计学意义。
2 结果
2.1 两组人工肝第一次治疗后血清学指标比较两组人工肝第一次治疗后血清生化指标比较差异均有统计学意义(P <0.05)。见表1。
表1 两组第一次治疗后血清生化指标比较Tab.1 Comparison of serum biochemical indexes between two groups after the first treatment ±s

表1 两组第一次治疗后血清生化指标比较Tab.1 Comparison of serum biochemical indexes between two groups after the first treatment ±s
TBIL DBIL ALB PT WBC Ca[M(P25,P75)]PE组(n=23)237.07±120.29 163.27±72.61 32.62±2.67 15.77±1.61 6.71±1.43 1.54(1.25,2.12)DPMAS+部分PE组(n=30)175.35±66.33 124.58±56.24 28.13±3.22 17.88±0.91 9.60±4.43 1.81(1.60,2.37)t/z值2.216 2.187 5.398 37.055-3.354-2.649 P值0.034 0.033<0.001<0.001 0.002 0.008
2.2 两组不同模式人工肝对比4、12 周生存率差异见表2。
2.3 不同人工肝次数对ACLF 患者临床预后的影响见表3。
2.4 不良反应两组人工肝治疗过程中均对患者的生命体征及病情进行监测。病程记录(DPMAS联合部分PE)人工肝治疗组中,有2例患者在治疗过程中出现畏寒、恶心欲吐,但生命征稳定,经对症处理后2例患者症状缓解并完成人工肝治疗。
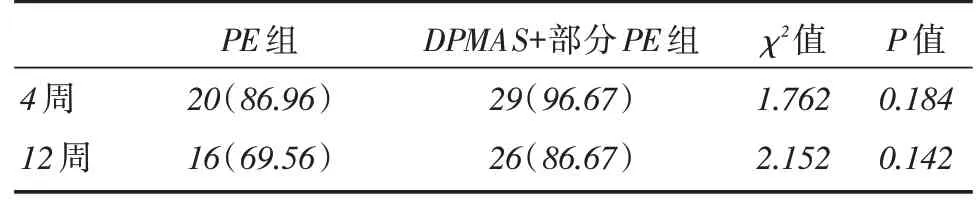
表2 两组不同模式人工肝4、12 周累积存活率Tab.2 The 4 and 12-week cumulative survival rates in two groups with different artificial liver models 例(%)
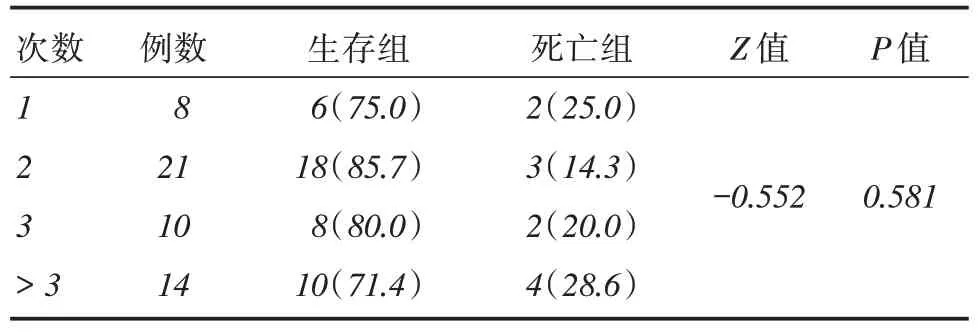
表3 人工肝治疗次数对ACLF 患者临床预后的影响Tab.3 The influence of artificial liver treatment times on the clinical prognosis of ACLF patients 例(%)
3 讨论
目前对于ACLF尚缺乏特异性治疗手段,主要的治疗方法有内科支持治疗、人工肝支持治疗以及肝移植,其中人工肝治疗被认为是效果确切且获益最多的方案[2-7]。非生物型人工肝主要包括血浆置换(PE)、双重血浆分子吸附系统(DPMAS)、血浆透析滤过(PDF)、分子吸附再循环系统(MARS)等模式。PE是近几十年来国内应用非生物型人工肝治疗的主要模式。PE可清除血浆中的毒性成分,补充凝血因子,改善凝血功能[8],改善生存率,研究显示血浆置换是提高肝衰竭患者生存率的唯一方法[9],但是采用此种模式治疗也有不足之处,由于每次置换消耗大量血浆,在血浆供给不足情况下限制了PE模式在临床上的应用[10]。而DPMAS模式对于毒素的吸附作用更强,因此与之相关的炎症损伤、肝细胞凋亡等控制更好[11-13],但术后凝血指标延长,考虑与DPMAS不能补充凝血因子,同时吸附凝血酶原等蛋白质成分有关[12],同样,血液灌流(HP)、血浆透析滤过(PDF)等人工肝治疗模式都存在着一定的不足,单一的人工肝治疗模式正逐渐被组合型非生物型人工肝所取代,将不同种类血液净化人工肝治疗模式联合应用,取长补短,优势互补,以满足不同个体的治疗需求已经成为非生物型人工肝新的发展趋势[14]。我院肝病科目前开展的人工肝模式主要有PE、DPMAS以及DPMAS联合部分PE模式。
本研究中所收集53例ACLF患者均采用人工肝治疗,依据实际选择治疗方案分为PE组和DPMAS联合部分PE组,肝功能、凝血功能是评估ACLF治疗效果的直观血清学指标,可评估治疗后的疗效,通过比较两组间第一次治疗后血清学指标发现,DPMAS联合部分PE组的TBIL、DBIL高于PE组(P <0.05);DPMAS联合部分PE组的WBC、PT、Ca显著高于PE组(P <0.01);DPMAS联合部分PE组的ALB显著低于PE(P <0.01),差异均有统计学意义。两组中PE组的TBIL从治疗前(371.68 ± 131.47)μmol/L下 降 至 治疗(237.07 ±120.29)μmol/L;DPMAS联合部分PE组的DPMAS从治疗前(368.21 ± 123.31)μmol/L下降至治疗后(175.35 ± 66.33)μmol/L,说明DPMAS联合部分PE模式对胆红素的清除作用要优于PE模式,这与张静等[15]学者的研究结果基本一致。有研究[14]表明,虽然DPMAS模式可以增加胆红素吸附能力,但DPMAS无法有效补充蛋白质和凝血因子等活性物质,甚至在治疗过程中会造成这些物质过分流失。这很可能是导致本研究中DPMAS联合部分PE组治疗后ALB水平较治疗前下降的原因。本研究中两组患者血清钙离子水平治疗后较治疗前均下降,但PE组较DPMAS联合部分PE组下降更为明显,这可能与董九香等[16]报道的大量输入新鲜冰冻血浆导致血液中一过性枸橼酸钙浓度偏高从而引起低血钙的结果相关。本研究结果显示,两组患者治疗后肝脏功能指标较治疗前明显改善,说明两种人工肝模式治疗ACLF患者均可以为肝功能恢复和肝细胞再生创造条件,且DPMAS联合部分PE组在清除胆红素方面效果优于PE组。与危敏研究报道一致[17],但临床上研究报道的DPMAS联合PE使用血浆量一般在1 000 ~1 500 mL(半量),甚至达到3 000 mL(等量)[18-19],本研究表明,部分PE使用800 mL的极低血浆量联合DPMAS仍能明显改善肝功能及凝血功能,临床疗效确切,提示血浆紧缺背景下可使用800 mL血浆进行部分血浆置换联合DPMAS治疗肝衰竭以提高临床疗效,进一步减少血浆用量并保证临床疗效。
人工肝在改善ACLF患者临床症状、体征及血清学指标的同时是否能提高患者生存率目前仍存在很大争议。一项Meta分析结果显示:虽然人工肝未在整体上提高肝衰竭患者存活率,但却可以提高ACLF患者的生存率[20]。另有国内的一项研究表明,与常规内科治疗相比,人工肝可以提高早、中期重型肝炎患者的生存率,但不能改变晚期患者的结局[21]。高海兵等[22]回顾性分析发现在内科治疗基础上,人工肝可以提高HBV-ACLF中期患者的短期生存率,但不同的人工肝治疗模式在提高短期生存率方面无明显差异。本研究中资料显示,PE组与DPMPS联合部分PE组患者4周累积生存率分别为86.96%和96.67%,两组对比差异无统计学意义(P >0.05);PE组与DPMPS联合部分PE组患者12周随访累积生存率分别为69.56%和86.67%,两组间差异无统计学意义(P >0.05)。提示两种人工肝模式虽然可以改善ACLF患者相关血清生化学指标,但对ACLF患者短期生存率影响并无明显差异。这与高海兵等研究结果相似[22-23],与相关文献不同[24-25],不排除与本研究样本量过少、人工肝干预时机的选择等因素相关。
为了了解人工肝治疗次数对ACLF患者临床预后有无影响,本研究对人工肝治疗的53例患者进行统计分析,结果显示,接受1次、2次、3次及3次以上人工肝治疗的患者生存率分别为75%(6/8)、85.7%(18/21)、80%(8/10)及71.4%(10/14)。不同人工肝治疗次数对比差异无统计学意义(P >0.05)。提示人工肝治疗次数与ACLF患者的预后无明显相关性。这与人工肝的理论支持存在偏差,究其原因,不排除可能为本研究所收集资料中接受人工肝治疗的患者入院时基础病情程度的不同所致。

