饲料中25-羟基维生素D3 的检测
刘泽辉,宣岩芳*,雷胡龙,黄志英,凌 超,赵志辉**
(1 上海市农业科学院农产品质量标准与检测技术研究所,上海201403;2 上海市农业科学院畜牧兽医研究所,上海201106)
维生素D 是动物机体维持正常生命活动所必须的营养素之一,不仅能调节机体钙磷代谢、促进骨骼发育[1],而且具有重要的抗氧化[2]和免疫调节功能[3-4],还有研究表明饲料中添加维生素D3可提高畜禽生产性能[5-6]、改善肉品质[7]。
饲料中添加的维生素D3主要有两种形式:维生素D3(又名胆钙化醇)和25-羟基维生素D3(又名骨化二醇)。 25-羟基维生素D3是维生素D3的活性形式。 被肠道吸收的维生素D3首先在肝脏中发生C25 羟基化,生成25-羟基维生素D3,并在肾脏线粒体中进一步转化为1,25-二羟基D3后被转运至小肠粘膜,促进钙磷吸收[6]、沉积和钙蛋白质的合成[8-9]。 25-羟基维生素D3不仅具有普通维生素D3的全部功能,还具有以下优势:作为一种活性形式吸收后不需要经过肝脏代谢和转化,直接供人或动物利用,缩短了维生素D3在机体的代谢过程,其生物学效价更高[7];25-羟基维生素D3具有更强的生理活性,参与了免疫细胞分化与功能调节,其在血浆中的含量是维生素D3营养状态的重要标志[10]。 因此,25-羟基维生素D3是饲料中更为有效的维生素D3的添加形式,并于1995 年获得美国食品药品管理局(FDA)认证,经美国FDA批准可以在畜禽饲料中使用的新型营养性添加剂。 我国于2014 年2 月1 日将其列入《饲料添加剂品种目录(2013)》(原农业部公告第2045 号),允许作为饲料添加剂使用。
目前,25-羟基维生素D3在畜禽养殖中应用十分广泛,在畜禽饲料生产中也多直接添加25-羟基维生素D3。 但是值得注意的是其生物学活性高的同时,其毒性也是VD3的5—10 倍[11],因此生产实践中要避免过量添加。 然而目前尚无饲料中25-羟基维生素D3的检测方法标准,而饲料生产企业质量控制和行业监测都迫切需要建立准确、可靠的饲料中25-羟基维生素D3的检测方法。 基于此,本研究对饲料中25-羟基维生素D3的检测方法进行研究,一方面可以满足目前动物精准营养研究的需要,另一方面也可为饲料质量安全监测提供参考。
1 材料与方法
1.1 试验材料
试验所用的配合饲料和预混合饲料样本从上海某饲料厂采集。
1.2 主要仪器与试剂
ACQUITY UPLC,紫外检测器TUV Detector,Empower 色谱工作站;XSelect HSS T3 色谱柱(5 μm,4.6 mm HSS T3),Talboys 数显多管涡旋混合器。
25-羟基维生素D3(C27H46O3,CAS 号63283-36-3,Dr.Ehrenstorfer 公司,纯度>98.1%);甲醇(色谱纯)、甲基叔丁基醚(色谱纯)、氯化钠(化学纯)和水(一级水)。
1.3 25-羟基维生素D3 标准溶液的配制
1.3.1 25-羟基维生素D3标准母液(1 000 mg∕L)的配制
称取25-羟基维生素D3约10 mg(准确到0.000 1 g),置于10 mL 棕色容量瓶中,加入5 mL 的甲醇,在超声波水浴中超声5 min 助溶,用甲醇定容至刻度,混匀配制为1 000 mg∕L 25-羟基维生素D3标准母液,-18 ℃以下保存,有效期6 个月。
1.3.2 25-羟基维生素D3标准储备液(100 mg∕L)的配制
吸取25-羟基维生素D3标准母液(1.3.1)10 mL 于100 mL 棕色容量瓶中,用甲醇稀释并定容至刻度,混匀配制为25-羟基维生素D3储备液,-18 ℃以下保存,有效期3 个月。
1.3.3 25-羟基维生素D3 标准工作液的配制
用甲醇将25-羟基维生素D3储备液(1.3.2)稀释得到质量浓度分别为0.05 mg∕L、1 mg∕L、2 mg∕L、10 mg∕L 和100 mg∕L 的标准工作溶液,现用现配。
1.4 试验样品的制备
按GB∕T 14 699.1 规定,取有代表性的饲料样品至少500 g,四分法缩减至100 g,磨碎,过0.28 mm 孔径样品筛,混匀装入密闭容器中,避光低温保存备用。
1.5 试验样品的前处理
称取维生素∕复合预混合饲料1 g,或配合饲料2 g(精确至0.000 1 g),置于50 mL 离心管中,加入10 mL蒸馏水,加盖涡旋混匀后置于Talboys 数显多管涡旋混合器上以2 500 r∕min 振摇15 min,取出加入1 g氯化钠混匀,再准确加入10.0 mL 甲基叔丁基醚,加盖涡旋充分混匀提取2 min 后,Talboys 数显多管涡旋混合器上以2 500 r∕min 振摇15 min,然后在3 000 r∕min 的转速下离心5 min。 精密吸取适量上清液(上层有机相)至10 mL 棕色玻璃管中,40 ℃水浴中N2吹干,取出用适量甲醇复溶,超声波水浴中超声2 min 助溶,涡旋混匀,过0.45 μm 有机系微孔滤膜,滤液供高效液相色谱仪分析。
1.6 液相色谱分析条件
流动相为95%甲醇水溶液(体积比95∶5),进样体积10uL;流速1 mL∕min,柱温30 ℃,检测波长265 nm,25-羟基维生素D3保留时间6.047 min。
2 结果与分析
2.1 提取试剂的选择
试验选择甲基叔丁基醚作为溶剂萃取试剂,与乙醚相比,甲基叔丁基醚的沸点没有那么低,特别是夏天气温较高时的提取操作,不容易像乙醚一样涡旋时溢出或放置时挥发而造成损失。
2.2 萃取过程的优化
由于预混合饲料和配合饲料中的组分复杂,在样品中加入适量的纯净水,一方面可以去除饲料中的水溶性杂质,另一方面可以将饲料样品充分润湿避免结块儿,为后续溶剂萃取作准备。
在溶剂萃取前需要加入适量加氯化钠,这是因为氯化钠会溶解到水中,使得水溶液的极性更强,从而加大和有机溶剂之间的极性差别,有助于水相和有机相分离,避免乳化。 且采用密度小于水的有机溶剂时,NaCl 溶解到水里之后加大了水相的密度,从而加大水相和有机相的密度差,加快了两相之间的分层。试验对比了萃取前加与不加氯化钠,由图1 可以看出,加氯化钠可以提高萃取效率,提高目标物的检测值。
2.3 HPLC 条件的优化
2.3.1 流动相的优化
试验比较了不同比例甲醇-水作为流动相对目标化合物的分离效果的影响,结果表明,采用甲醇∶水(V∕V) =95∶5可以更好地分离复杂基质中的目标物(图2、图3)。
2.3.2 色谱系统的适应性
采用1.6 的色谱条件,对畜禽预混合饲料和配合饲料中25-羟基维生素D3的含量进行检测,结果表明本试验所优化的色谱条件可广泛应用于各种饲料中25-羟基维生素D3的测定。
2.4 线性范围及定量限
将25-羟基维生素D3储备液配置成质量浓度分别为0.05 mg∕L、1 mg∕L、2 mg∕L、10 mg∕L 和100 mg∕L的标准工作溶液的标准工作溶液,然后以25-羟基维生素D3峰面积Y对质量浓度X(μg∕mL)绘制标准曲线,线性方程为:Y=2.90 ×104X+1.07 ×104,方程的决定系数(R2)为0.999 8,表明在0.05—100 μg∕mL范围内有良好的线性关系。 以信噪比(S∕N)≥10 计算,方法的定量限为0.3 mg∕kg。
2.5 加标回收率
取猪配合饲料和猪复合预混合饲料样品基质2 g,分别添加0.3 mg∕kg、0.6 mg∕kg 和3 mg∕kg 25-羟基维生素D3,进行加标回收率试验,每个添加水平重复6 次。 结果表明:25-羟基维生素D3的平均回收率为90%—97%(表1),相对标准偏差为1%—4%。 证实该方法的准确度较高,满足测定要求。
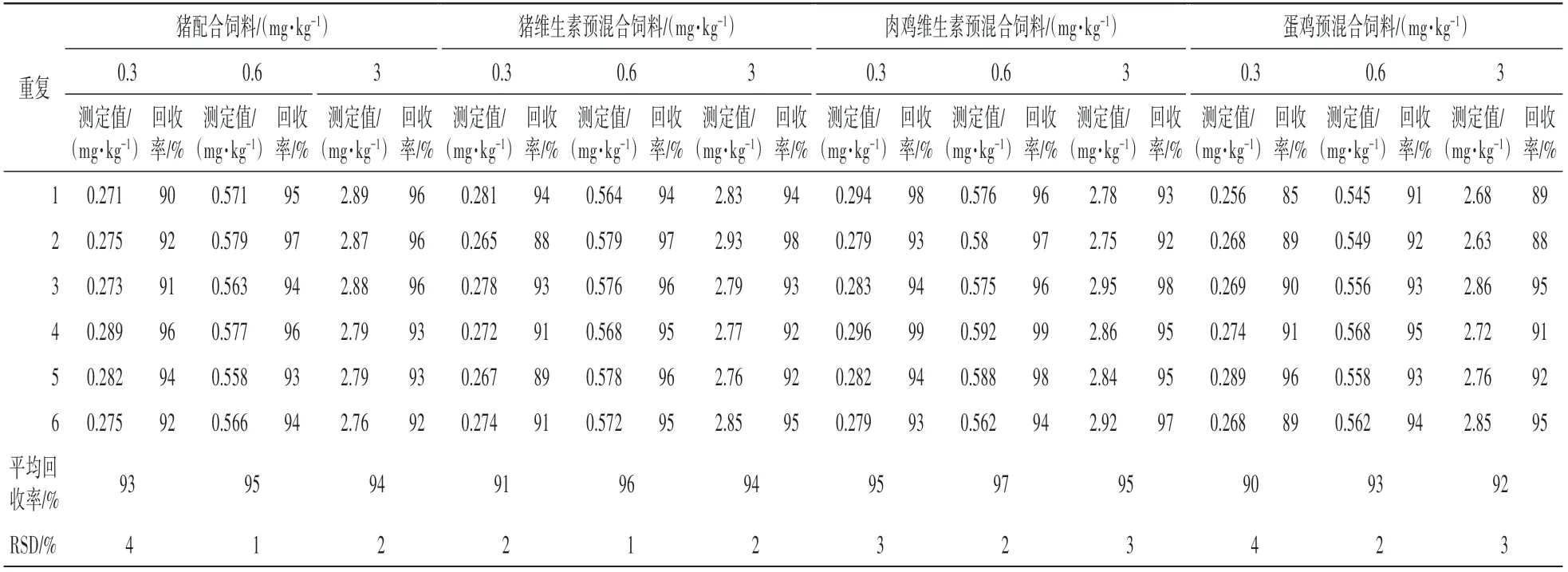
表1 不同饲料样品中25-羟基维生素D3 的添加回收率和相对标准偏差(n=6)Table 1 Recovery rates and relative standard deviations of 25-hydroxyvitamin D3 monohydrate in feeds(n=6)
2.6 精密度
取同一复合预混合饲料样品,重复测定10 次,样品中25-羟基维生素D3含量的相对标准偏差小于5%(表2),满足饲料中营养成分检测的要求。
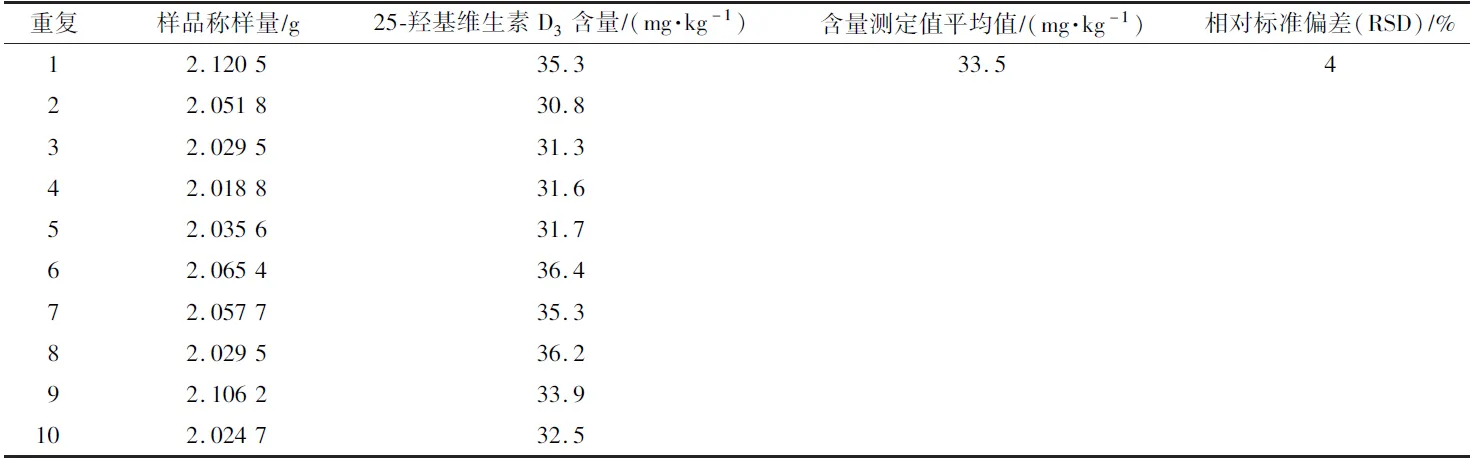
表2 复合预混合饲料中25-羟基维生素D3 含量的测定Table 2 Determination of 25-hydroxyvitamin D3 monohydrate in compound premix feed
2.7 方法适用性验证
选取添加了25-羟基维生素D3的饲料产品(蛋鸡维生素预混合饲料、蛋鸡复合预混合饲料、种畜禽维生素预混合饲料、种畜禽复合预混合饲料鸡饲料以及动物保健产品)进行了测定。 结果表明:应用本方法检测饲料中25-羟基维生素D3的含量其相对偏差均小于5%(表3),符合饲料检测标准要求。

表3 不同饲料样品中25-羟基维生素D3 的测定Table 3 Determination of 25-hydroxyvitamin D3 monohydrate in feeds
3 结论
试验结果表明,采用高效液相色谱法分析饲料中25-羟基维生素D3的保留时间重现性好,含量和峰面积比值之间呈良好的线性关系,加标回收率准确度高,精密度高。 该法测定饲料中的25-羟基维生素D3含量简便、快速、准确。

