基于ADNI 数据的海马结构亚区体积及Tau病变与认知损伤的相关性研究
盖新亭,吴琛,徐凯
阿尔茨海默症(Alzheimer’s disease,AD)是以认知功能减退为主要特征的中枢神经系统退行性疾病,是痴呆症的最常见类型之一[1]。随着β-淀粉样蛋白(amyloid β-protein,Aβ)、tau蛋白(T)和神经退行性病变(neurodegeneration,N)等为AD相关生物学标记物的AT[N]研究框架的提出,以上述3种病变为核心的研究成为近年来的热点[2]。其中,Aβ病变会导致其在神经元细胞外异常沉积形成老年斑,这种表现常用于判断患者是否已处于AD状态。相比Aβ的异常沉积,tau蛋白的异常磷酸化所形成的神经元纤维缠结(neurofibrillary tangles,NFTs)则与认知损伤、记忆退化等相关性更高,能够反映AD的疾病进程,因而受到越来越多的科研工作者的关注[3-6]。
海马结构作为情绪、记忆、认知、空间导航等基本脑功能的中枢区域,其损伤与多种神经精神类疾病如AD、帕金森病、抑郁症和癫痫等联系紧密[7]。与健康老年人相比,AD患者的海马结构及其周围区域均表现出明显的体积减小[9-12]。因此,海马结构的萎缩常用来作为神经退行性病变的生物学标记物,参与AD疾病的临床诊断及相关研究[8]。
然而,现阶段用于AD相关海马结构的研究手段相对单一,大部分研究都专注于整体海马结构的分析,基于其亚区结构和功能改变与认知损伤、tau蛋白病变的相关性的研究目前相对匮乏[13]。一方面在于海马结构的亚区分割相对较难,现有的自动化分割技术获得的结果比较粗糙[14]。即使采用手动分割的方法,也需要高分辨率磁共振图像作为前提,且可重复性欠佳。另一方面,tau蛋白是近年来发现的新型生物学标记物,其与海马结构尤其是局部亚区结构相关性的研究相对较少。因此,本研究中自阿尔茨海默症神经成像计划(Alzheimer's Disease Neuroimaging Initiative,ADNI)数据库中筛选出进行了高分辨率T2WI扫描的143例样本,利用自动化海马结构亚区分割软件分割海马结构亚区并计算各亚区体积及其与tau病变程度与认知损伤之间的相关性[15],同时观察不同Aβ状态下,海马结构各亚区的体积差异和半球差异,旨在为与海马结构相关的AD研究提供解剖学参考。
材料与方法
1.研究对象
本实验所用数据均来自于ADNI数据库(http://adni.loni.usc.edu),所有被试签署了知情同意书。ADNI数据库的建立,主要是测试能否通过结合MRI、PET、各种生物学标记物以及临床神经症状评估等多种手段来评估认知功能正常(normal cognitive,CN)、轻度认知障碍(mild cognitive impairment,MCI)和早期AD的疾病进程。纳入标准:除AD之外无其它神经精神类疾病;具有完整的tau-PET、amyloid-PET、T1WI和T2WI(特定的海马高分辨率成像序列,用于海马结构的自动分割)数据。其中,amyloid-PET图像,T1WI及T2WI检查与tau-PET扫描的时间间隔小于一年。所有被试需由专业临床医师进行临床量表测评,ADNI选择老年痴呆症认知功能评估量表(Alzheimer’s disease assessment scale-cognitive,ADAS_cog)。最终,从ADNI数据库中筛选出2017年2月-2018年6月符合条件的143例被试样本,包括CN 87例、MCI 46例和AD 10例。
2.图像采集方法
使用Siemens Prisma 3.0T磁共振扫描。3D矢状面T1WI:TE 3.0 ms,TR 2300.0 ms,层厚1.2 mm,矩阵240×256×176。冠状面T2WI:海马结构专属高分辨率扫描序列,TE 50.0 ms,TR 8020.0 ms,层厚2.0 mm,矩阵448×448×30。
Tau-PET:Philips Gemini PET成像仪,示踪剂为18F-AV-1451,层厚2.0 mm,矩阵128×128×90。Amyloid-PET:Philips Gemini PET成像仪,示踪剂为18F-AV45,层厚2.0 mm,矩阵128×128×90。
更多关于图像采集所用序列及预处理的信息详见ADNI系统(http://adni.loni.usc.edu/methods/documents/mri-protocols)。
3.图像后处理
使用海马亚区自动分割(Automatic Segmentation of Hippocampal Subfields,ASHS)软件(http://picsl.upenn.edu/software/ashs/),将海马结构自动分割为CA1、CA2、CA3、下托(subiculum,Sub)、内嗅皮层(entorhinal cortex,ERC)、Brodmann35区(BA35)、Brodmann36区(BA36)、齿状回(dentategyrus, DG)和海马旁回(para-hippocampal cortex,PHC)共9个亚区(图1)。其中因CA2区域结构较小,本研究中将其与CA3合并处理以便于后续的统计分析。Tau-PET图像利用FreeSurfer 6.0软件的PetSurfer程序进行处理,通过Desikan-Killiany图谱获取ROI,并配准到T1WI图像空间,以小脑灰质作为参照,计算全脑PET信号的标准化摄取比值(standard uptake value ratio,SUVR),并结合上面所得8个海马结构亚区的分割结果,计算每个亚区的SUVR,作为反映tau病变程度的指标。
4.统计分析
每例被试的Aβ状态由加州大学伯克利分校实验室提供,以Aβ-SUVR=1.11为阈值,全脑平均SUVR大于该阈值则定义为Aβ状态异常。首先,利用双样本t检验,对比不同Aβ状态下,8个亚区海马结构的体积差异和tau-SUVR的差异;然后,利用偏相关分析,在控制年龄、性别、受教育程度、以及APOE基因型(记录等位基因ε4的数量,0表示不含等位基因4,1表示含有1个,2表示含有2个)等相关因素的情况下,计算ADAS_cog评分与不同亚区海马结构的体积和tau-SUVR的相关性。上述统计结果经FDR多重比较进行校正,以P<0.05为差异具有统计学意义。
结 果
所有被试的基本临床资料见表1。与Aβ正常组相比,Aβ异常组的年龄更大、携带载脂蛋白E(apolipoprotein E,APOE)的等位基因ε4的比例更高、ADAS_cog评分也更高(得分越高,认知受损越严重)。两组被试的受教育程度和性别分布的差异无统计学意义(P>0.05)。

表1 所有被试的基本临床资料
不同Aβ状态下海马亚区体积和tau蛋白病变程度的比较结果见表2。各亚区体积的比较:与Aβ正常组相比,Aβ异常组仅表现为左侧海马CA1区的体积明显降低(P<0.05);左侧其它亚区及右侧各亚区的体积在两组间的差异均无统计学意义(P>0.05)。tau病变的比较:除左侧海马CA1区的SUVR升高而右侧无明显变化外,其它亚区左、右两侧的表现类似,下托、内嗅皮层、BA35、BA36以及海马旁回这5个亚区(双侧)均表现为Aβ异常组的SUVR明显升高(P<0.05)。
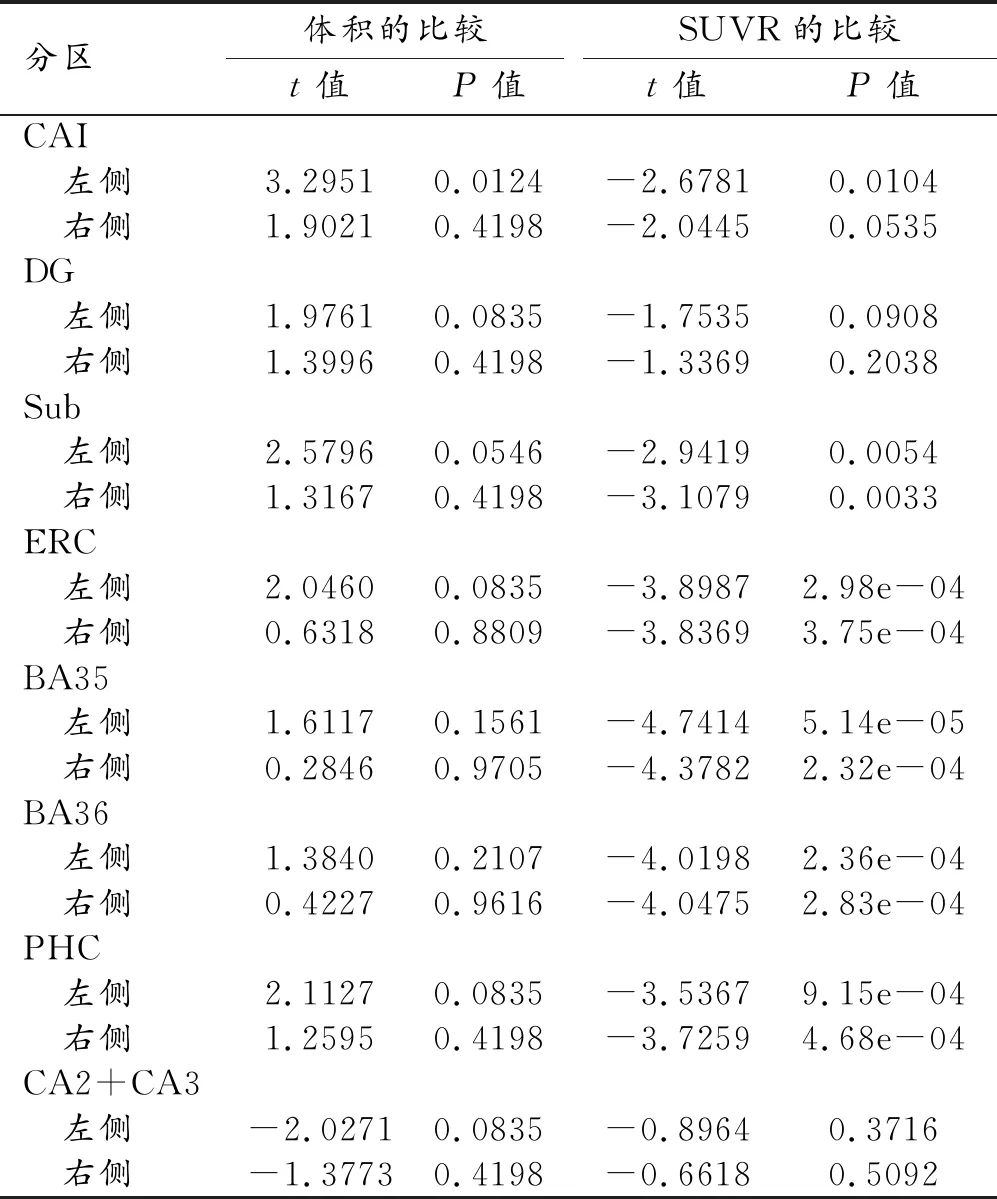
表2 Aβ正常组与异常组的海马各亚区体积和tau病变程度的比较
3.相关性分析
Aβ正常组:海马各亚区体积和tau-SUVR与ADAS_cog评分的相关性分析结果见表3。左侧海马仅内嗅皮层区的tau-SUVR与认知损伤程度(ADAS_cog评分)呈正相关(P<0.05);右侧海马则表现为内嗅皮层和BA35区的tau-SUVR与认知损伤程度呈正相关(P<0.05)。
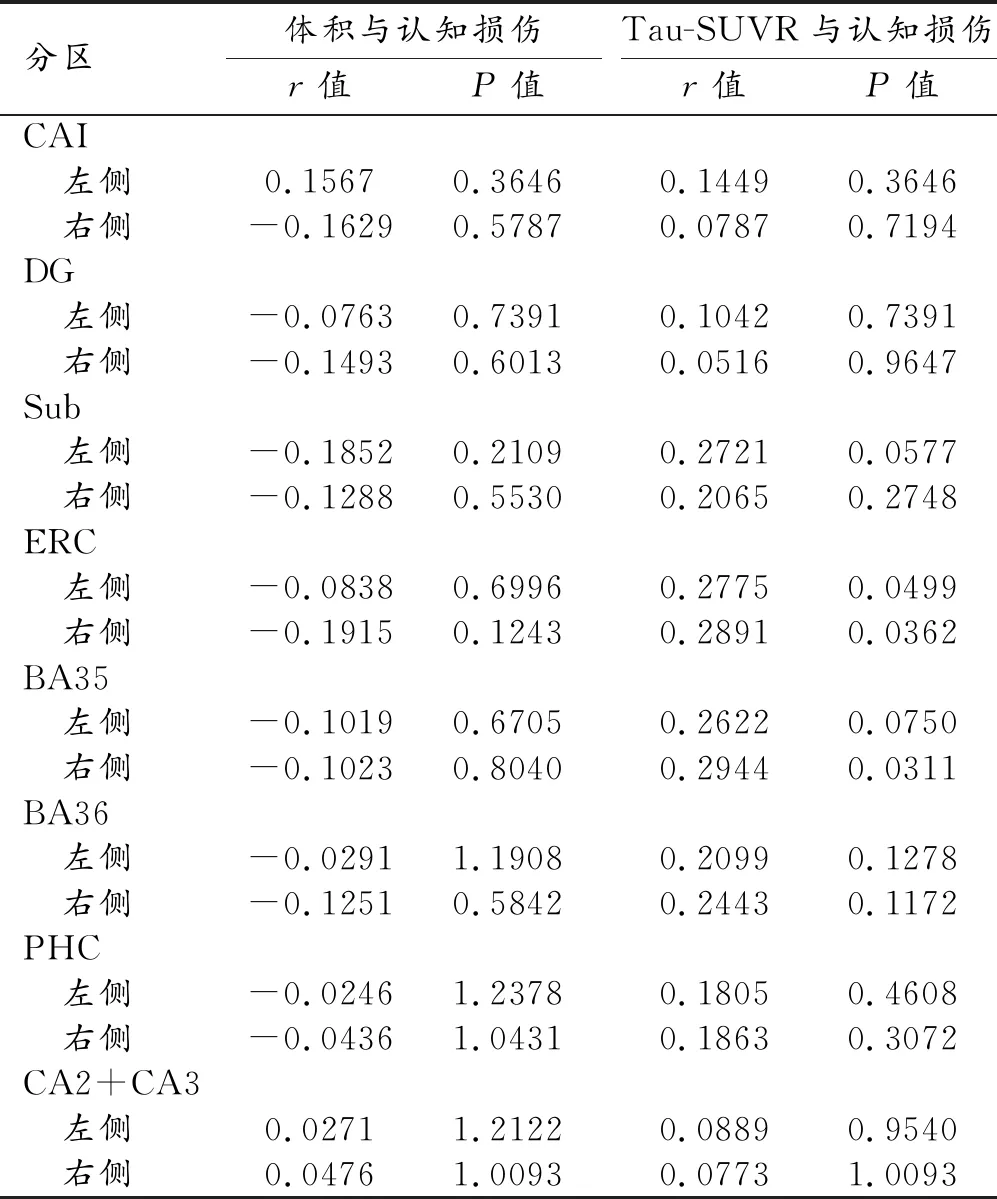
表3 Aβ正常组海马结构各亚区体积及tauSUVR与认知损伤的相关性
Aβ异常组:海马各亚区体积和tau-SUVR与ADAS_cog评分的相关性分析结果见表4。左侧海马结构的CA1、下托、内嗅皮层、BA35、BA36和海马旁回等区域的tau-SUVR与认知损伤程度呈正相关(P<0.05),BA36区的体积与认知损伤程度呈负相关(P<0.05);右侧海马则表现为内嗅皮层、BA35、BA36和海马旁回等区域的tau-SUVR与认知损伤程度呈正相关(P<0.05),海马旁回的体积与认知损伤程度呈负相关(P<0.05)。
讨 论
海马结构的萎缩,是以AD为代表的神经系统退行性疾病的生物学标记物,常用来评估疾病的发展阶段和严重程度。近年来,以Aβ和tau蛋白病变为核心的研究加深了人们对AD的认知[16-17]。因此,结合体积变化或脑皮层厚度变化,观察Aβ和tau蛋白病变在关键脑区如海马结构的发生与发展,受到越来越多的科研工作者的关注[18]。
Amyloid级联瀑布学说指出,Aβ病变是AD的先决条件,是判断患者是否已处于AD状态的生物学标记物[5]。与健康人群相比,Aβ异常者有更严重的皮质萎缩、代谢减退和认知功能损伤[19-20]。从正常老化到临床诊断为AD的发病过程中,颞叶内侧以及大脑新皮层区域表现出tau蛋白病变的加重,且该变化与Aβ状态是否异常呈正相关[4,21-22]。在本研究中,我们将所有被试分为Aβ正常和异常两组,发现Aβ异常组的年龄更大、认知功能评分更低、tau蛋白病变程度更严重,进一步说明了Aβ病变可导致疾病程度的加重。与Aβ正常组相比,Aβ异常组除CA1区域之外,其他亚区没有表现出明显的体积降低。而tau蛋白病变加重则出现在多个亚区。此外,Aβ正常组中海马结构各亚区的体积与认知损伤程度之间无显著相关性,而tau蛋白病变则表现为在两侧内嗅皮层和右侧BA35区与认知损伤程度之间具有相关性。Aβ异常组的左侧BA36区及右侧海马旁回的体积与认知损伤程度之间具有相关性,而tau蛋白病变与认知损伤程度相关的区域明显增多。综合以上结果,说明与tau蛋白病变相比,海马结构体积的降低可能存在一定程度的滞后性。结合Jack等[23]提出的AD疾病发展规律曲线,tau蛋白病变可能在尚未出现脑皮层萎缩以及未表现出临床症状之前就已存在[24],本研究结果与之类似。
AD是一个经历较长发病过程的神经系统退行性疾病,在出现临床症状前,可能有十年甚至几十年的缓慢发展期,因此对于此疾病的早发现和早预防就显得尤为重要[25-26]。随着PET成像技术和示踪标记物的发展,使得在体监测Aβ和tau蛋白病变成为可能。其中,tau蛋白病变程度与认知损伤程度表现为显著正相关关系,常用于评估AD的严重程度[4]。本研究结果表明,Aβ正常组左侧海马结构的内嗅皮层区域的tau-SUVR与认知损伤程度呈正相关,而右侧的海马结构则表现为内嗅皮层和BA35区的tau-SUVR与认知损伤程度具有相关性(表3)。说明tau病变在Aβ出现异常之前就已经发生了,并与认知损伤程度相关联。而内嗅皮层在海马结构左、右两侧均表现为tau病变与认知损伤程度之间具有相关性,说明该区域在AD发病过程中最易受损且最早发生病变,对此尚需进一步深入研究来验证。
半球差异是脑科学研究中的常见现象,尤其对于海马结构而言,因其左右两侧功能的差异,常表现出不同程度的半球差异[27-29]。本研究中Aβ正常组和异常组对比发现,左侧海马结构CA1区的体积减小和tau病变均表现为异常组更加明显,说明左侧海马结构可能受到更多的损伤。更进一步分析发现,Aβ异常组中认知功能损伤程度与tau病变的相关性表现出一定程度的半球差异,左侧具有相关性的区域较右侧更多。而体积变化与认知损伤程度具有相关性的亚区则表现的较为分散,其相关性是否存在半球差异尚需进一步的实验结果支持。综上可知,海马结构的体积变化在ADNI人群中存在半球差异,表现为左侧体积萎缩更加明显;而与认知损伤程度的相关性方面,尤其是在Aβ异常组中,左侧海马结构的tau病变与认知损伤程度的相关性表现得更明显。
研究尚存在一定的不足之处。首先,ADNI是一个公共数据库,主要是观察并搜集老年人群中AD相关的临床特征和疾病发生发展情况的相关信息,ADNI的特点之一是大部分受试者的临床诊断为CN或MCI,而AD患者所占比例则相对较低,即使是临床诊断为AD的受试者,也基本为轻度AD。因此基于ADNI数据库的研究均存在AD患者样本量不足的问题;此外,ADNI数据库并未提供被试的利手信息,这对于海马结构等可能存在半球差异的脑结构的研究可能造成不可预知的影响。
总之,在与AD相关的进程中,一方面tau蛋白病变的出现可能早于海马体积的减小;另一方面,tau蛋白病变和海马结构体积减小可能存在半球差异,表现为左侧更加明显。尤其是tau病变,在Aβ正常组中就已经出现在内嗅皮层区域,说明此区域可能是最易受损部位。而在Aβ异常状态下,tau蛋白病变和海马体积的减小均表现为不同程度的加重。这些研究结果或可为将来研究AD疾病的早期诊断和预防提供相关的神经解剖基础,并进一步为临床诊疗提供参考。

