运用静息态功能MRI评估慢性耳鸣患者突显网络功能
陈晓晖,张健,李澄
慢性主观性耳鸣是指不存在任何外界声音刺激下耳内听到振铃或嗡嗡声的主观感觉,在65岁以上的成年人群中发生率为9%~12%。中重度耳鸣患者除听觉系统症状外,还伴有焦虑、抑郁、注意力下降和认知障碍等神经系统症状[1]。尽管耳鸣为外周神经系统疾病,手术治疗并不能很好缓解耳鸣症状,提示中枢神经系统可塑性起着关键性作用[2]。既往的电生理及神经影像研究结果表明耳鸣与中枢神经系统异常神经活动有关,包括自发放电、神经同步和拓扑属性的异常等[3]。
突显网络的主要节点位于背侧前扣带回及双侧前脑岛,与皮层下及边缘系统存在结构和功能连接,并参与调解内部和外部刺激,包括来源于听觉通路的信息[4]。突显网络相关脑区可以对听觉和视觉刺激做出反应,且随着视听觉刺激的加强,前脑岛和背侧前扣带回的激活更加明显[5]。最重要的是,突显网络的功能是保证其它神经网络功能(如默认网络,执行控制网络等)的正常发挥[6]。但是突显网络与耳鸣相关的神经精神症状之间是否存在相关性及其潜在的发生机制等尚有待进一步探究。
静息态功能MRI通过血氧饱和水平依赖(blood oxygen level dependent,BOLD)成像原理,可获得神经活动的时间与空间分布情况,从而能较直观地显示神经系统病变,基于种子点的功能连接分析方法应用较为广泛、便捷,已被应用于众多精神疾病发生机制的研究中。本研究采用功能连接分析方法来评估耳鸣患者突显网络的功能改变,探索其在耳鸣相关精神疾病中的作用。功能连接指脑内具有相似功能特性的空间远距离脑区间血氧信号波动的一致性及其与神经生理活动时间的相关性。
材料与方法
1.伦理申明
本研究经本院伦理委员会审查通过(伦理号:2016ZDSYLL031.0)。每例受试者在参与本研究前签署书面知情同意书。
2.临床资料
2016年12月-2018年12月在本院耳鼻喉科招募31例慢性耳鸣患者,同期招募33例健康被试作为对照组。采集所有被试的详细临床基本资料,包括年龄、性别、教育程度、既往病史和家族史等。
患者组的纳入标准:①临床诊断明确的慢性耳鸣患者;②年龄20~70岁;③受教育年限>9年;④耳鸣病程>6个月。排除标准:①有梅尼埃病、听觉过敏或搏动性耳鸣病史;②有耳部手术史或卒中病史;③既往有中枢神经系统疾病或精神疾病;④有脑外伤史;⑤合并严重的心、肝或肾疾病、慢性消耗性疾病、甲亢或甲减;⑥有痴呆家族史;⑦有酒精和/或药物依赖史,服用过改善认知及抗抑郁和抗精神病药物;⑧有MRI扫描禁忌证。
对耳鸣患者进行爱德华耳鸣残疾问卷表(tinnitus handicap questionaire,THQ)调查来评估耳鸣严重程度,主要针对社会功能、精神功能和身体功能三大方面[7]。
由一位耳鼻喉科医师使用GSI-61听力计对每例患者进行纯音测听来评估双耳在频率为0.25、0.50、1.00、2.00、4.00、6.00、8.00、10.00、12.00和16.00kHz条件下的听力阈值(图1)。
在安静环境下,由一位神经内科医师对每例患者进行神经量表评估。采用蒙特利尔认知评估量表来评估被试的整体认知情况,采用焦虑自评量表及汉密尔顿抑郁量表评估被试的心理精神状态。排除整体认知得分<50分、焦虑量表得分>50分和抑郁量表得分>7分的被试。
3.MRI检查方法
使用Siemens Magnetom Verio 3.0T MR成像仪。扫描过程中要求被试安静平躺在扫描床上,保持头和身体不动,闭眼并保持清醒,避免思考特殊的事情。使用专业防噪声耳塞以减弱扫描过程中的噪声(约减弱32分贝)。
主要扫描序列及参数如下:结构像的采集采用SPGR序列T1WI,TR 1900 ms,TE 2.48 ms,翻转角90°,视野256 mm×256 mm,矩阵256×256,层厚1 mm,176层,扫描时间约4分钟;BOLD功能像的采集采用EPI序列,层厚4.0 mm,TR 2000 ms,TE 25 ms,翻转角90°,视野240 mm×240 mm,矩阵64×64,36层,共采集240个时间点,扫描时间为8分6秒。
4.图像后处理
对MR结构像原始数据的后处理基于VBM8软件包(http://dbm.neuro.uni-jena.de/vbm),将T1WI图像分割成灰质、白质和脑脊液三种成分,并配准到MNI空间,使用6mm的平滑核进行平滑,主要步骤包括空间标准化、分割、调制和平滑,与既往的研究中的后处理方法和步骤基本类似[8]。
对MR功能像原始数据的预处理基于SPM12的静息态数据处理助手软件包(DPARBI V3.0),具体步骤:①将DICOM格式的原始数据转换成NIFTI格式;②去除静息态数据中前10个时间点的数据;③时间校正;④头动校正,去除x、y、z轴方向上位移超过2 mm、三维旋转角度超过2°的被试的MRI数据;⑤空间标准化,将校正后的数据标准化到MNI模板;⑥去线性漂移;⑦采用6 mm半高带宽进行平滑;⑧滤波,频率为0.01~0.08 Hz。
根据斯坦福大学神经精神疾病实验室公布的开源功能影像数据提取突显网络的三大重要节点:背侧前扣带回、左侧前脑岛和右侧前脑岛[9]。通过REST软件包(http://www.restfmri.net)将这3个ROI作为种子点进行功能连接分析,并使用BrainNet Viewer软件包(http://www.nitrc.org/projects/bnv/)将有统计学差异的脑区投射到大脑3D容积再现图像上(图1)。我们选择突显网络节点作为种子点进行功能连接分析,并比较耳鸣组及对照组的功能连接矩阵,多重比较校正P<0.01、体素数>50为差异具有统计学意义。
5.相关性分析
对功能连接的分析结果进行多重比较校正(P<0.01,体素数>50)。提取功能连接差异有统计学意义脑区的时间序列与耳鸣量表、耳鸣病程等临床资料进行皮尔森相关性分析,此分析由SPSS 18.0软件完成。
结 果
1.基本临床资料
本研究中共纳入31例耳鸣患者及33例健康志愿者,所有被试的认知量表得分均>50分,焦虑量表得分均<50分,抑郁量表得分均<7分。
两组被试的基本临床资料的比较见表1。两组被试的年龄、性别和受教育程度等基本人口统计学资料相匹配(P>0.05)。耳鸣组的病程(42.6±41.4)个月。耳鸣程度的评估:THQ总得分41.4±19.7,社会功能评分为11.4±6.4,精神功能评分为16.7±11.0,身体功能评分为16.5±8.2。

表1 两组被试基本临床资料的比较
患者组和对照组中大脑灰质体积分别为(579.7±25.8)和(572.4±23.0)mm3,白质体积分别为(530.0±24.5)和(527.8±24.7)mm3,组间差异均无统计学意义(t=1.195,P=0.237;t=0.359,P=0.721)。
所有被试的听力正常,测试频段(0.25~16.00 kHz)内听阈均<25分贝(图2)。
2.功能连接分析
耳鸣患者的背侧前扣带回与左、右侧眶额皮层的功能连接程度均增加,而与右侧中央前回和右侧顶下小叶的功能连接程度降低;左侧前脑岛与左侧小脑VIIb叶的功能连接程度增加,而右侧前脑岛与全脑的功能连接程度无明显改变(表2和图3)。
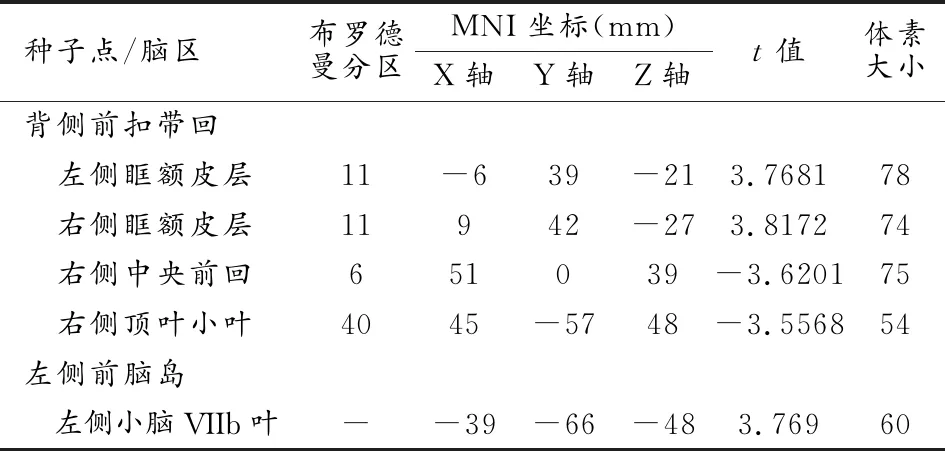
表2 耳鸣组功能连接异常脑区的相关指标
3.相关性分析
皮尔森相关性分析结果见图4。背侧前扣带回-顶下小叶功能连接程度与耳鸣病程(r=-0.538,P=0.002)和耳鸣THQ总得分(r=-0.559,P=0.001)呈负相关,背侧前扣带回-中央前回功能连接程度与THQ总得分呈负相关(r=-0.479,P=0.006)。
讨 论
本研究证实慢性主观性耳鸣患者的静息态突显网络相关功能连接存在异常,且与耳鸣病程及耳鸣量表评分之间具有显著相关性,为耳鸣的潜在神经发病机制提供证据。
大脑功能异常可能与结构异常息息相关。有文献报道,耳鸣患者的部分脑区内灰质体积减小,包括额上回、下丘、海马、腹内侧前额叶皮层、前扣带回、伏隔核、下丘和赫氏回[10]。也有研究发现,与正常对照相比,耳鸣患者的颞上回和颞中回的体积增加。但是本研究中并未发现耳鸣患者的大脑灰、白质体积有异常改变,笔者认为可能的原因为:①文献报道的发生大脑结构改变的研究样本主要为耳鸣伴高频段听力损失的患者,而本研究中招募的耳鸣患者听力均正常;②可能存在受试者的异质性;③不同的磁共振分析方法。此外,我们的结果提示:在听力正常的耳鸣患者中,异常功能连接可能先与结构改变。
我们发现耳鸣患者左右两侧眶额皮层与背侧前扣带回功能连接增加。视觉和听觉任务可激活背侧前扣带回,且激活程度也随着任务难度的提升而明显增加,提示背侧前扣带回参与感觉调节及认知处理[5]。脑电图研究也发现背侧前扣带回参与对耳鸣的感知[11],而且背侧前扣带回的β波与耳鸣量表评分呈显著正相关。另外,针对耳蜗植入者的神经影像学研究表明背侧前扣带回可感受声音刺激及参与双流听觉处理[12],从而说明选择背侧前扣带回作为种子点的科学性。眶额皮层处于大脑前额叶,与下丘脑、纹状体、海马和杏仁核存在解剖结构连接,已经被证实参与精神分裂症、抑郁、双向情感障碍、创伤后应激综合征等精神疾病[13]。最新证据表明视听觉任务招募腹内侧前额叶皮质,而且与健康对照相比,于耳鸣患者中该脑区的招募更显著[14],提示腹内侧前额叶皮层在耳鸣病程中的重要性。因此推测眶额皮层可能参与耳鸣导致的神经精神症状,但是本研究中并没有发现眶额皮层-背侧前扣带回功能连接的增加与耳鸣的临床特征之间具有显著相关关系。后期我们需要设计针对眶额皮层的研究来深入挖掘眶额皮层的具体角色。
本研究结果显示,耳鸣患者背侧前扣带回与右侧中央前回之间有功能连接减弱,且这种功能连接减弱与THQ得分呈负相关。THQ得分反映出受试者耳鸣严重程度,评估耳鸣对患者的社会功能、精神功能和身体功能的影响[15],可见耳鸣严重程度越高,背侧前扣带回-中央前回功能连接越弱。我们认为耳鸣患者神经冲动传入减少,导致到达低位脑干及听觉皮层的神经冲动相应减少,从而影响听觉脑区与非听觉脑区之间的功能耦合[16]。传统观念认为中央前回是运动区,有证据表明中央前回也参与听觉信息的处理,正如我们先前的研究中发现耳鸣患者的丘脑-中央前回的功能连接显著减弱[9]。但是,突发性耳聋患者的PET检查结果显示发病72小时内中央前回的葡萄糖吸收率明显增高,而且与言语辨别任务的得分之间呈正相关[17]。与有正常听力的非诵读困难者相比,先天性耳聋和诵读困难患者在音韵判断任务中中央前回激活明显[18]。因此,我们的研究也证实了中央前回是引起耳鸣的机制之一。此外,精神分裂患者中央前回体积降低,并与运动相关的认知功能存在有一定相关性[19],所以我们推测中央前回可能参与了耳鸣相关的负性情绪调控,未来的研究可以关注在这一方面。
本研究结果显示,耳鸣患者的顶下小叶与背侧前扣带回之间存在功能连接减弱。顶下小叶解剖结构复杂、功能多样,参与多种感觉、知觉及认知功能的调控,同时也是默认网络和控制网络的重要节点。搏动性耳鸣患者顶下小叶的低频振幅和局部一致性较健康人群明显增加[20]。脑电图研究发现耳鸣患者的顶叶小叶的α波和β波降低[21]。搏动性耳鸣由明确血管因素导致,是一种有节律的耳鸣,多数与心脏跳动次数一致,磁共振检查往往会发现乙状窦、头颈部动静脉等血流动力学异常,与主观性耳鸣存在区别,其并不是来源于大脑皮层的异常神经活动[22,23]。但是,研究表明搏动性耳鸣患者也存在神经功能不足,尤其在情绪、认知等相关网络,因此主观性耳鸣和搏动性耳鸣可能共享部分脑区功能异常[24]。
此外,我们发现随着耳鸣病程的延长,顶下小叶-背侧前扣带回连接降低显著(r=-0.538,P=0.002);且耳鸣量表得分越高,顶下小叶-背侧前扣带回功能连接越弱(r=-0.559,P=0.001)。以上证据表明研究顶下小叶在耳鸣中的受损模式是必要的,且与耳鸣严重程度呈明显相关性,但是其具体的受损模式我们尚不清楚。基于顶下小叶结构与功能的复杂性,我们认为可以将顶下小叶的各个亚区作为感兴趣区,在亚区水平上系统、细致地探讨耳鸣患者顶下小叶各亚区的功能连接损害模式。
与既往的研究结果相一致,本研究结果显示耳鸣患者的小脑亦参与了脑功能异常重塑过程。小脑有大量的传入、传出纤维,形成“运动环路”和“前额叶环路”,为小脑在高阶网络发挥作用提供结构及功能基础。小脑与下丘、耳蜗核、内侧膝状体、上橄榄核和听觉皮层存在直接和间接的结构连接[25],说明小脑可接收外周器官的信号,调节听觉中枢的活动。既往有研究发现小脑单极梳状细胞可上调谷氨酸能传递,并参与耳鸣的病理生理过程[26]。电生理研究发现绒球旁小叶整合来自前庭与听觉中枢的信息,也参与耳鸣的发生发展[27]。有关严重耳鸣患者SPECT成像的研究结果显示小脑血流明显增加[28]。从另一个方面来看,在许多精神疾病(包括精神分裂症、抑郁、焦虑和神经退行性病变)的相关研究中,均提示小脑的灰质体积、血流量及神经活动存在异常[29]。在本研究中,耳鸣患者的左侧前脑岛与左侧小脑VIIb叶的功能连接明显增多。小脑VIIb位于小脑后叶,参与高级功能调控,小脑后叶的损伤则会导致认知与情感障碍[30]。而小脑参与耳鸣病程的潜在病理生理学机制有待进一步探究。
本研究存在一定的不足之处。第一,作为横断面研究,样本量较小,患者的年龄跨度较大,并不能作为佐证功能磁共振成像与耳鸣机制的直接证据,因此后期需要扩大样本量并控制混杂因素来进行前瞻性研究;第二,后续研究需要进一步关注耳鸣患者的脑岛及背侧前扣带回各亚区与全脑之间的功能连接改变,并可采用格兰杰因果分析尝试阐述因果关系;第三,听力正常的耳鸣与听力损失的耳鸣可能存在不同的神经重塑机制,后续研究中应该招募不同的耳鸣患者来探究听力损失在耳鸣疾病中的作用机制;第四,虽然本研究中采用耳塞和耳机来降低磁共振设备的扫描噪声,但是并不能完全隔绝噪声。扫描噪声有可能成为一个外界刺激因素,从而影响神经活动与不同脑区间的神经同步性。
综上所述,本研究以突显网络为切入点,运用静息态功能MRI技术及功能连接分析定位了听力正常的耳鸣患者基于种子点的异常神经同步性,主要包括眶额皮层、中央前回、顶下小叶及小脑,并进一步挖掘异常的功能连接属性与临床耳鸣特征的潜在关系。脑功能的异常特征或可成为耳鸣患者神经症状治疗靶点,并用于疗效评估及预后监测。

