固有淋巴细胞在早期肠源性脓毒症免疫抑制中的作用机制研究
杨登元,沈晓菲,陆晓峰,赵 阳,夏雪峰,管文贤,杜峻峰
肠源性脓毒症是普外科常见的重症疾病,发病率高,预后较差,其在早期存在的免疫抑制是导致预后不佳的主要因素[1-2]。中性粒细胞在肠源性脓毒症中的生存时间显著延长,然而自身功能却出现明显改变,在脓毒症模型中,中性粒细胞能够上调程序性死亡配体1(programmed death ligand 1, PD-L1)的表达,抑制淋巴细胞的功能[3];而在临床研究中,重症脓毒症患者的外周血中性粒细胞PD-L1表达水平与疾病严重程度呈正相关[4]。因此,中性粒细胞表达PD-L1是诱导其他免疫细胞功能抑制,推动脓毒症免疫抑制状态的重要环节。然而,中性粒细胞在脓毒症患者中上调PD-L1表达的具体机制尚不清楚。固有淋巴细胞(innate lymphoid cells, ILCs)是最近发现的一类免疫细胞群体,在受到外源致病菌或炎症刺激后,可通过表面的相应受体启动快速免疫应答,因此对于早期免疫应答起到了至关重要的调控作用[5]。虽然ILCs是组织定居细胞,但是研究人员发现,在人类外周血中稳定存在各亚型ILCs,提示其也能参与系统性免疫应答[6]。肠源性脓毒症患者在早期就存在复杂的细胞因子网络,不同亚型的ILCs可以被不同细胞因子激活,与此同时,激活的ILCs也能通过分泌细胞因子与蛋白促进疾病的发展。因此,ILCs可能是脓毒症早期疾病进程中的关键细胞群体。本研究利用健康志愿者及肠源性脓毒症患者外周血,提取免疫细胞后分析ILCs的变化及其对于中性粒细胞和肠源性脓毒症免疫抑制的潜在调控作用。
1 资料与方法
1.1一般资料 选取2019年1月—9月南京大学医学院附属鼓楼医院胃肠外科收治的7例因结肠穿孔所致肠源性脓毒症患者,脓毒症的诊断依据最新Sepsis-3的诊断标准:序贯器官衰竭评估评分≥2分;所有患者在入院24 h内即进行评分,年龄46~68岁,男3例,女4例。选取7例同期的健康志愿者,其中男4例,女3例,年龄38~72岁,既往无严重心、肝、肾、内分泌及免疫系统疾病,无放化疗及免疫调节药物或激素服用史。健康志愿者与肠源性脓毒症患者一般资料比较差异无统计学意义(P>0.05),具有可比性。无论是患者还是志愿者都签署知情同意书。
1.2外周血处理 获取健康志愿者及肠源性脓毒症患者外周血10 ml,加入Ficoll分离液,按照外周血∶PBS∶Ficoll分离液4∶4 ∶6的比例进行离心,室温,30 min,上升速度最大,下降速度最低;离心后获取薄雾状中间层细胞,进行洗涤。
1.3流式细胞术及体外刺激共培养 人类外周血ILC2(2型固有淋巴细胞):CD45+Lineage-IL-7Rα+CRTH2+;分选后的细胞利用20%细胞培养基在体外使用人白介素-12(interleukin-12, IL-12)及IL-33刺激,浓度均为50 ng/ml,刺激3 d后分别获取细胞和上清液以备检测,细胞利用BD公司FACS CantoⅡ检测,上清液应用R&D公司生产的γ干扰素(interferon-γ, IFN-γ)试剂盒进行检测;在部分实验中,加入流式细胞术分选的中性粒细胞,再培养12 h后检测中性粒细胞表面PD-L1的表达。
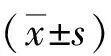
2 结果
2.1肠源性脓毒症患者外周血ILCs亚群的变化 无论是健康志愿者还是肠源性脓毒症患者,外周血内均存在3型ILCs:ILC1、ILC2和ILC3。见图1A。与健康志愿者比较,肠源性脓毒症患者外周血ILC1比例显著上升,而ILC2的比例则显著下调(P<0.05),ILC3的比例则变化不显著(P>0.05)。见图1B和表1。提示在肠源性脓毒症早期,ILCs的亚群就存在显著变化,可能对疾病的发生发展起到推动作用。
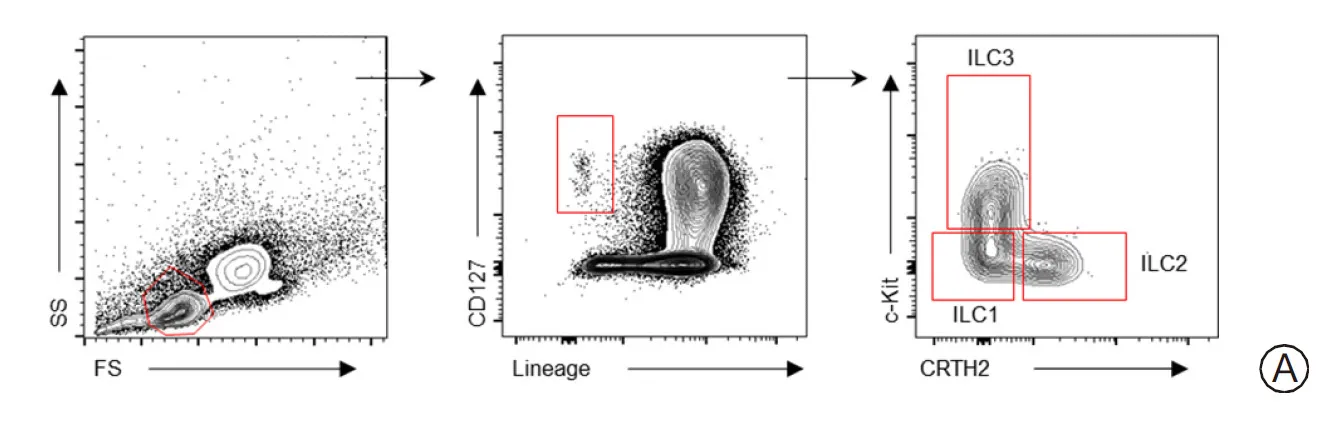
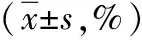
表1 健康志愿者及肠源性脓毒症患者外周血ILCs亚群比较
2.2肠源性脓毒症患者外周血中性粒细胞PD-L1表达情况 分析健康志愿者与肠源性脓毒症患者外周血中性粒细胞发现,健康志愿者外周血中性粒细胞几乎不表达PD-L1,然而在肠源性脓毒症患者体内,中性粒细胞PD-L1表达显著上调。见图2A。在过去研究中,巨噬细胞和树突状细胞是表达PD-L1的主要固有免疫细胞群体,然而在肠源性脓毒症早期,中性粒细胞是表达PD-L1最显著的细胞群体(P<0.05)。见图2B。提示PD-L1对后续免疫抑制的发生起到重要推动作用。
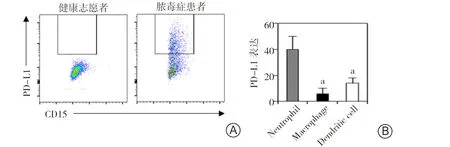
图2 健康志愿者及肠源性脓毒症患者外周血中性粒细胞PD-L1表达情况
2.3肠源性脓毒症患者中性粒细胞PD-L1表达水平与ILC1比例的相关性 为了探索ILC2与ILC1比例的变化,尤其是ILC1比例的显著上调是否对肠源性脓毒症免疫抑制产生影响,本研究对中性粒细胞PD-L1表达水平与ILC1比例进行相关性分析,发现中性粒细胞PD-L1表达水平与ILC1比例呈正相关(R2=0.5959)。见图3。提示ILCs可能参与中性粒细胞在肠源性脓毒症早期上调PD-L1的表达。
2.4体外IL-33和(或)IL-12刺激ILC2可以转变为ILC1 为了探索ILC1比例增加的原因,及其是否能直接作用于中性粒细胞,促进PD-L1的表达并导致脓毒症免疫抑制,本研究首先运用体外实验,探索ILC2是否能被诱导转变为ILC1,将获取的外周血ILC2在体外分别运用IL-33、IL-12及IL-12+IL-33刺激,发现在体外IL-12或IL-12+IL-33刺激下,ILC2确实能够转变为ILC1,ILC1特征性转录因子T-bet高表达(P<0.05),上清液亦可检测到高水平的IFN-γ(P<0.05)。当将中性粒细胞与由ILC2转变而来的ILC1共培养后,中性粒细胞PD-L1的表达显著上调(P<0.05)。见图4。提示肠源性脓毒症早期,ILC2能转变为ILC1,促进中性粒细胞表达PD-L1,推动肠源性脓毒症免疫抑制的产生。
3 讨论
深入阐明肠源性脓毒症的病理生理过程是治疗疾病,改善预后的前提。目前学者们一致认为,肠源性脓毒症是病原菌与机体免疫系统相互较量的过程;机体在抗菌的同时启动促炎反应,作为一种代偿机制,机体内同时或相继出现抗炎反应:效应性T细胞出现凋亡、中性粒细胞功能失调、内毒素重新整合、MHC-2类分子在抗原提呈细胞表面表达下调、调节性T细胞以及髓系抑制性细胞比例上调等。因此部分学者认为增强机体免疫功能、逆转肠源性脓毒症早期即存在的免疫抑制才是新的治疗方向[2]。ILCs作为最近新发现的免疫细胞群体,数量虽少,但是因其在炎症与感染早期能够被快速激活,成为现今免疫细胞群体的关注焦点;然而其在肠源性脓毒症中扮演的角色尚未阐明。本研究初步证实,在肠源性脓毒症早期,ILCs各亚群就存在变化,ILC1的比例显著上调,而ILC2的比例则显著下调,进一步的体外实验表明,ILC1比例的上调可能与ILC2/ILC1转化有关;本研究还发现,肠源性脓毒症患者外周血中性粒细胞在早期就显著上调PD-L1的表达,并且其表达水平与ILC1的比例呈现显著的正相关;进一步的体外共培养实验证实,ILC2转变为ILC1后,确实能显著上调肠源性脓毒症患者外周血中性粒细胞PD-L1表达。因此上述结果提示,ILCs在肠源性脓毒症早期就存在ILC2/ILC1转化,促进中性粒细胞表达PD-L1,从而推动免疫抑制的产生。
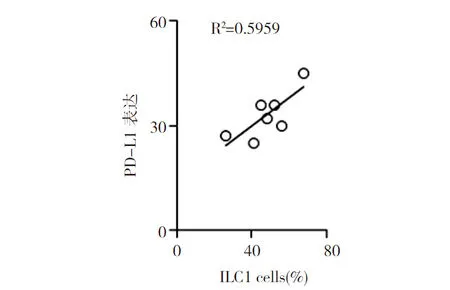
图3 肠源性脓毒症患者中性粒细胞PD-L1表达水平与ILC1比例的相关性
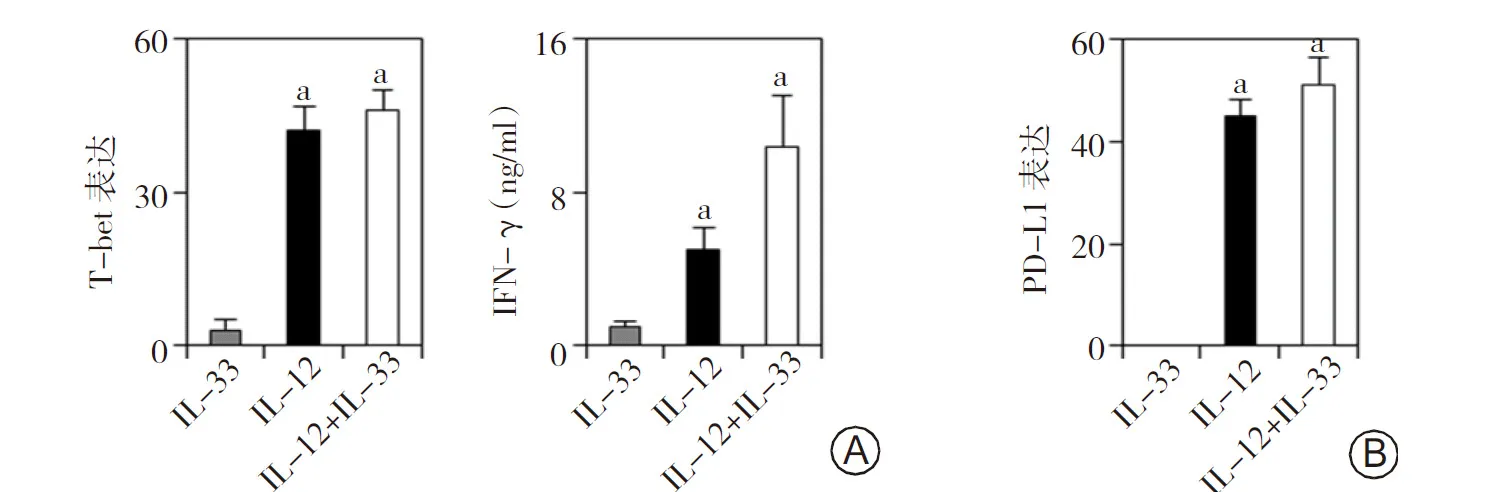
图4 体外IL-33和(或)IL-12刺激ILC2后T-bet、IFN-γ以及中性粒细胞PD-L1表达情况
中性粒细胞作为体内数量最多的免疫细胞群体,在脓毒症中的作用一直是研究的热点。由于中性粒细胞的生存期限与其他免疫细胞尤其是记忆性细胞相比,相对短暂,因此过去认为中性粒细胞主要是终末效应性细胞,对于其他细胞的调控作用甚微。然而最近的研究表明,在炎症状态下,中性粒细胞在外周循环及感染灶都能与获得性免疫细胞(例如T淋巴细胞)相互联系,并且对T淋巴细胞的功能进行调控。中性粒细胞能通过分泌活性氧和精氨酸-1对淋巴细胞的功能起到负调控作用[7]。PD-L1作为下调淋巴细胞免疫功能的重要抑制性分子,是表达于T淋巴细胞表面PD-1的配体,一旦与PD-1结合能启动T淋巴细胞凋亡与功能抑制。随着研究的深入,研究人员发现哮喘患者痰液中性粒细胞及HIV感染患者外周血中性粒细胞能高表达PD-L1,并对淋巴细胞功能起到抑制作用[8-9];而在脓毒症中,无论是动物模型还是人类试验结果均证实,中性粒细胞在早期就能通过表达PD-L1诱导T细胞的凋亡,促进免疫抑制的产生,然而调控肠源性脓毒症早期中性粒细胞上调PD-L1的细胞学机制尚未揭示。本研究结果则初步证实,ILCs是肠源性脓毒症早期诱导中性粒细胞上调PD-L1表达的主要细胞群体。
ILCs对于中性粒细胞的调控主要集中在ILC3,其通过分泌粒细胞集落刺激因子和IL-17A,对中性粒细胞在体内的稳态发挥调节作用[10];而在重症哮喘这一炎症疾病状态下,ILC2可以转变为分泌IL-17A的炎性ILC3,促进中性粒细胞在重症哮喘状态下肺部的浸润,促进哮喘的急性发作[11]。ILCs是否能通过其他调控机制介导与中性粒细胞间的相互作用尚不明确,基于ILCs和中性粒细胞均是机体抵御外界病原菌侵入的首道防线,探索二者在炎症状态下,例如脓毒症模型中的相互作用,或许是新的思路。另外,不同亚型ILCs在依靠分泌多种细胞因子和蛋白发挥作用的同时,也能相互转化[12]。这种转化被认为是机体免疫系统为了适应外界刺激而产生积极有效的免疫应答,例如在肠道损伤与感染中,肠道ILC3也可以转变为ILC1,促进免疫应答的发展[5];然而这种ILCs间的转化如无法得到逆转,也会出现有害的一面,例如在慢性阻塞性肺疾病中,ILC2可以转变为分泌IFN-γ的ILC1,加重呼吸道损伤[13]。在克罗恩病患者的肠道组织中,发现存在分泌IL-13及IFN-γ的ILCs,并且其数量及比例与疾病的严重程度呈正相关[14]。本研究则发现,在肠源性脓毒症早期,ILC2可以转变为分泌IFN-γ的ILC1,推动肠源性脓毒症免疫抑制的产生。这一结果,为ILCs在疾病状态下的相互转化理论做出了有效扩充,下一步深入探索调控ILCs间相互转化的内在分子机制,将为早期阻断肠源性脓毒症免疫抑制的产生,改善患者的预后提供新的方向。

