子宫内膜癌患者血清PTEN与TK1水平变化及其阳性表达与预后的关系
朱婕曼,陈丽华
子宫内膜癌是临床上引起女性死亡的主要恶性肿瘤,发病率有逐年升高的趋势[1-2]。子宫内膜癌早期症状不明显,而临床诊断时患者通常处于中晚期,预后较差[3]。目前,对子宫内膜癌发病的分子作用机制尚不十分清楚,临床上主要通过手术或化疗进行治疗[4]。人第10号染色体缺失的磷酸酶与张力蛋白同源物基因(gene of phosphate and tension homology deleted on chromosome ten, PTEN)及胸苷激酶-1(thymidine kinase 1, TK1)是与肿瘤发生、发展、转移和凋亡密切相关的生物大分子,而且可能是治疗恶性肿瘤的潜在靶点[5-6]。但是目前尚未见到PTEN、TK1在不同临床分期子宫内膜癌患者血清中的表达情况及其与临床病理分级的相关性报道。故此,本研究回顾性分析88例子宫内膜癌患者的临床资料,分析不同临床分期患者血清中PTEN、TK1表达情况,并探讨患者预后与PTEN、TK1表达的相关性,以期为子宫内膜癌的临床诊断及治疗提供参考依据。
1 资料与方法
1.1一般资料 选取我院2016年6月—2018年6月诊治的88例子宫内膜癌患者作为子宫内膜癌组,所有患者均经病理学检查确诊。排除标准:①并发其他类型恶性肿瘤者;②伴严重代谢系统疾病者;③伴严重认知功能障碍者;④伴严重心肾功能障碍者;⑤至随访截点时脱落病例;⑥临床资料不完整者。纳入患者年龄48~66(57.8±8.7)岁;根据国际妇产科联合会颁布的临床分期标准进行分期[7],其中Ⅰ期患者25例(28.41%),Ⅱ期患者24例(27.27%),Ⅲ期患者16例(18.18%),Ⅳ期患者23例(26.14%);病理类型均为子宫内膜样腺癌,病理分级[8]:G1级31例(35.23%),G2级30例(34.09%),G3即27例(30.68%)。另选取2017年2月—2019年7月在我院行健康体检且身体健康的女性85例作为对照组,年龄48~65(57.5±8.9)岁。本研究经医院医学伦理委员会审批同意进行。
1.2观察指标 本研究分析不同临床分期以及不同病理分级子宫内膜癌患者血清中PTEN及TK1表达水平。采用免疫组织化学染色法检测子宫内膜癌患者留存的病理组织标本PTEN及TK1阳性表达情况,并通过电话、门诊复查等方式进行随访,随访时间截止至2019年6月,分析子宫内膜癌患者预后与癌组织PTEN及TK1阳性表达的关系。
1.3治疗方法 88例子宫内膜癌患者中Ⅰ期患者25例给予子宫病灶扩大切除+盆腔、腹主动脉旁淋巴结切除术;其余患者均给予子宫病灶扩大切除+盆腔、腹主动脉旁淋巴结切除术联合术后放化疗。所有患者术后均给予我院自制中药汤剂(黄芪、党参、人参、灵芝等)提高机体免疫力治疗。
1.4检测方法 抽取子宫内膜癌患者清晨空腹静脉血5 ml,2000 r/min离心15 min后,取上清液保存于4℃保藏箱中待测,同时调取对照组体检时留取的血清标本。检测时采用酶联免疫吸附法测定血清中PTEN及TK1水平。PTEN蛋白酶联免疫吸附检测试剂盒购自Omega公司;TK1蛋白酶联免疫吸附检测试剂盒购自R&D公司。所有检测操作均严格按照试剂盒说明书进行。
1.5免疫组织化学染色及判读方法 取子宫内膜癌患者留存的病理标本,经二甲苯脱蜡、梯度乙醇脱水后,于枸橼酸钠中行抗原热修复,3%过氧化氢中消除内源过氧化物酶活性,添加山羊血清封闭后,加入PTEN、TK1一抗于4℃孵育过夜。以PBS液作为阴性对照,添加兔抗鼠IgG孵育后PBS液洗涤3次,后行DAB显色,于光镜下观察。根据着色细胞数及染色程度确定PTEN、TK1的表达水平:着色细胞数<10%或未染色,记为(-);着色细胞数为10%~20%而染色弱至中等,记为(+);着色细胞10%~20%且染色强,或着色细胞20%~50%而染色弱至中等,记为(++);着色细胞20%~50%而染色强,或着色细胞>50%,记为(+++)。其中(-)和(+)定义为低表达,(++)和(+++)定义为高表达。
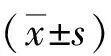
2 结果
2.1子宫内膜癌组和对照组血清PTEN及TK1水平比较 与对照组比较,子宫内膜癌组血清PTEN及TK1水平明显升高(P<0.05)。见表1。
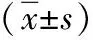
表1 子宫内膜癌组和对照组血清PTEN及TK1水平比较
2.2不同临床分期子宫内膜癌患者血清PTEN及TK1水平比较 不同临床分期子宫内膜癌患者总体血清PTEN及TK1水平比较差异有统计学意义(P<0.05);且随着临床分期的进展子宫内膜癌患者血清PTEN及TK1水平亦逐步升高(P<0.05或P<0.01)。见表2。
2.3不同病理分级子宫内膜癌患者血清PTEN及TK1表达水平比较 不同病理分级子宫内膜癌患者总体血清PTEN及TK1水平比较差异有统计学意义(P<0.05);且随着病理分级的加重子宫内膜癌患者血清PTEN及TK1水平亦逐步升高(P<0.05)。见表3。
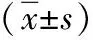
表2 不同临床分期子宫内膜癌患者血清PTEN及TK1水平比较
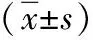
表3 不同病理分级子宫内膜癌患者血清PTEN及TK1水平比较
2.4子宫内膜癌患者癌组织PTEN及TK1表达与预后的关系 子宫内膜癌组PTEN高表达52例,低表达36例;TK1高表达55例,低表达33例。截止至2019年6月,子宫内膜癌PTEN高表达者存活率为63.46%(33/52)明显低于低表达者的存活率88.89%(32/36),差异有统计学意义(χ2=7.124,P=0.008);子宫内膜癌TK1高表达者存活率为63.64%(35/55)明显低于低表达者的存活率90.91%(30/33),差异有统计学意义(χ2=7.946,P=0.005)。
3 讨论
子宫内膜癌是发生于子宫内膜上皮的恶性肿瘤,多发于绝经期和绝经后女性,严重影响患者的生活质量和生存状态。子宫内膜癌早期无明显症状,患者通常是在行妇科检查或普查时发现。子宫内膜癌患者一旦出现症状,多表现为出血、阴道排液、疼痛和腹部包块等。但目前关于子宫内膜癌的发病机制尚不完全明确。
新近有研究指出,PTEN参与调控了恶性肿瘤的发生、发展及转移等过程,且可能与上皮-间质转化过程相关[9-10]。在分析子宫内膜样癌及其前驱病变PTEN的表达及意义时发现从单纯性增生、复杂性增生、子宫内膜上皮内瘤变到子宫内膜样癌,PTEN的缺失率逐渐升高[11]。在对新辅助化疗前后子宫内膜癌患者PTEN的变化及预后分析时也发现,子宫内膜癌患者实施新辅助化疗效果显著,能够有效降低患者血清PTEN水平,降低术后复发率,延长患者生存期,且不良反应少,其表达水平与子宫内膜癌患者预后密切相关[12]。既往研究也从细胞水平证明了PTEN与肿瘤细胞凋亡的关系,金雀异黄素可能通过上调Egr1/PTEN信号通路的表达抑制PI3K/Akt信号通路的激活诱导SKOV3细胞凋亡,进一步影响了凋亡相关基因Bcl-2、Bax及Caspase-3的表达[13]。本研究也发现,子宫内膜癌患者血清PTEN水平明显升高,且随着患者临床分期及病理分级的升高,血清PTEN水平也逐步升高;随着癌组织PTEN阳性表达的增强患者生存率降低。提示血清PTEN水平与子宫内膜癌患者临床分期及病理分级密切相关,且癌组织阳性表达越强患者的预后越差。
既往研究也证实,TK1可作为临床诊断恶性肿瘤的重要参考指标,且与患者的临床分期及预后有密切的相关性[14-15]。叶伟等[16]研究发现,上皮性卵巢癌患者TK1水平较健康者升高,并与患者临床分期呈正相关。张鸿艳[17]也证实,血清TK1表达与宫颈癌的发生密切相关,是患者预后不良的风险因素。且邹振武等[18]研究也发现,联合检测血清TK1、癌抗原19-9对鉴别诊断胰腺癌、胰腺炎具有较高的临床价值。本研究结果也证实,与对照组比较,子宫内膜癌组血清TK1水平明显升高,且随着患者临床分期及病理分级的升高,血清TK1水平逐步升高;随着癌组织TK1阳性表达的增强患者生存率降低。提示血清TK1水平与子宫内膜癌患者临床分期及病理分级密切相关,且癌组织阳性表达越强患者预后越差。
综上所述,血清PTEN及TK1水平与子宫内膜癌患者的临床分期及病理分级密切相关,且癌组织PTEN及TK1阳性表达越强患者预后越差。在以后的研究中将进一步探索血清PTEN及TK1水平联合其他相关因子在子宫内膜癌诊断中的效果,为增强临床无创诊断水平、早期发现肿瘤并采取积极的治疗措施提供可靠依据。

