前列腺癌中热休克蛋白27作用的研究进展
陈 贤,郭文静,杨礼亮,周煜新,郭青龙
(中国药科大学江苏省肿瘤发生与干预重点实验室;天然药物活性物质功能研究实验室,南京210009)
热休克蛋白(heat shock proteins,HSPs)是一类受热休克或其他应激源诱导激活并参与蛋白折叠和成熟的大家族蛋白,包括HSP27、HSP40、HSP60、HSP70、HSP90和大型HSPs[1]。热休克蛋白在细胞增殖、分化和癌变中发挥着重要的作用,并且可以作为肿瘤诊断、疾病进展评估的生物标志物和肿瘤治疗的靶点,具有潜在的临床应用价值[2]。在肿瘤细胞中,HSPs 协助肿瘤特异性蛋白折叠并表现出抗凋亡特性,而HSPs 的表达监测已在乳腺癌、卵巢癌、前列腺癌、骨癌和泌尿癌等许多肿瘤的临床诊断中发挥了作用[3]。
前列腺癌(prostate cancer,PCa)是男性高危肿瘤之一,在老年男性当中具有较高的发病风险。先前有研究表明西方国家的前列腺癌发病率最高,但最近的报告指出包括中国在内的许多世界其他国家及地区前列腺癌发病率也在不断增长[4]。在各种治疗方案中,雄激素剥夺疗法被认为是转移性PCa患者的标准治疗方案,且在大量病例中产生了良好的效果[5]。然而患者体内肿瘤可能会在去雄治疗后的短时间内发展为去势抵抗性PCa(castration-resistant prostate cancer,CRPC),最终导致治疗失败和患者死亡[6]。为了提高PCa 患者的生存率,包括多西他赛和强的松在内的多种化学与激素疗法进入了临床研究,但总体治疗效果不能令人满意,因此针对前列腺癌去势抵抗与耐药分子机制的研究十分重要[7]。
前列腺癌中的HSP27 是肿瘤进展的关键调节者,可促进雄激素受体折叠和核内运输,并且可作为确定PCa 分期状态的有效预后工具。患者群体的异质性和预后状态是高危疾病治疗的关键因素,如有的PCa 患者具有致死表型,而有的可能在肿瘤发展的初级阶段就能治愈,故将HSP27 作为预后诊断工具具有十分重要的临床价值。本文综述了HSP27 在前列腺癌中的作用,包括HSP27 受诱导产生的机制、抗凋亡能力及其在肿瘤进展与耐药中的具体功能。此外,本文总结了靶向HSP27治疗的研究成果,并将其作为治疗CRPC 的一种有效策略。
1 HSP27的分类与结构
HSPs 一般根据相对分子质量进行分类,其中大多数属于HSP27、HSP40、HSP60、HSP70、HSP90和大型HSPs(HSP110 和葡萄糖抑制蛋白170、GRP170)。大部分HSP 蛋白是具有ATP 酶活性的ATP 依赖性蛋白,而HSP27 属于ATP 非依赖性蛋白[8]。人类HSP27 属于由11 个成员组成的小型热休克蛋白家族,大小范围为12 kD~43 kD,其特征是晶体域的独特保守区域,该保守氨基酸序列位于可变的N端与C端结构域之间(图1)。目前研究的热点是HSPB1(HSP27)、HSPB4(αA 晶体蛋白)和HSPB5(αB 晶体蛋白或CRYAB),这些分子通过与异常折叠的蛋白质或疏水肽结合,防止它们在细胞内聚集从而发挥伴侣功能[9]。sHSPs 在许多肿瘤类型中都存在高表达,并且HSP27 被认为是与PCa相关的核心sHSP[10]。
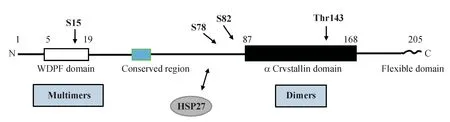
Figure 1 Structure of human HSP27
与大多数小型热休克蛋白相似,HSP27能够形成相对分子质量接近800 kD~1 000 kD的同质或异质低聚复合物。位于N 端区域的3 个丝氨酸残基(Ser15、Ser78 和Ser82)的磷酸化是影响HSP27 寡聚状态和伴侣功能的关键翻译后修饰过程,而磷酸化位点Thr143 位于α-crystallin 域[11]。一般认为,较大的ATP 非依赖性HSP27 低聚物能够结合错误折叠的蛋白并阻止其聚集,而小的低聚物则会促进错误蛋白的泛素化和降解[12]。人类HSP27由位于染色体7q11.23的人类HSPB1基因编码,该基因包含3 个外显子和两个HSEs(heat shock elements,热休克元件)。 HSE 中的第1 个HSF(heat shock factors,热休克因子)结合位点位于外显子1 上游约200 bp 处,第2 个则位于第1 个内含子内,二者分别与HSFs 1和2结合。Hemin 处理和热休克能够触发HSF1 与HSE 结合并诱导HSP27表达。HSP27 能与多种分子相互作用,如β-连环蛋白(β-catenin)、组蛋白去乙酰化酶6(HDAC6)、转录激活因子2(STAT2)和procaspase-3[13];它还在神经退行性疾病、缺血、动脉粥样硬化和肿瘤等多种疾病中发挥着作用[14]。
2 HSP27与肿瘤
正常细胞具有独特的细胞保护机制,以承受各种压力条件。非应激细胞表达足以维持蛋白质组和细胞稳态的基础水平的热休克蛋白,而应激细胞表达更高水平的热休克蛋白从而保护重要蛋白免受毒性物质的伤害。HSP27 在很多肿瘤细胞中高表达,帮助折叠癌蛋白并维持其稳定性,抑制其在肿瘤微环境中的聚集或水解,从而成为代谢调节的必要元素[15]。
2.1 HSP27在肿瘤的作用
HSP27 在调控肿瘤的发生、发展、转移、细胞凋亡、耐药等方面具有重要作用,可作为疾病预后不良的指标。抑制HSP27可以逆转上皮-间质转化(EMT)、降低基质金属蛋白酶(MMP)活性并抑制肿瘤细胞的增殖、迁移和侵袭[16]。HSP27 也是整合素连接激酶(ILK)的靶点,能够促进膀胱癌细胞的迁移[17]。此外,HSP27 过表达与上皮性卵巢癌的腹膜转移相关[18]。外周血中的HSP27 通过增加血管内皮生长因子(VEGF)基因转录,促进乳腺癌细胞中VEGFR2 的活化,从而促进血管生成和细胞迁移[19]。这些发现提示HSP27 在调节肿瘤细胞生长、侵袭和转移方面有直接作用。
2.2 HSP27的分子调控机制
研究发现HSP27 在肿瘤细胞中可通过抑制p53 介导的p21 表达,调控p53 信号通路,从而抑制细胞衰老[20]。Cayado-Gutiérrez 等[13]发现乳腺癌细胞中HSP27 的下调可诱导肿瘤抑制基因PTEN 和其磷酸酶同源物的表达,提示HSP27 负调控PTEN。Zhang 等[21]研究报道,HSP27 可通过激活AP-1 在肺癌中促进肿瘤细胞增殖,从而导致化疗抗性与预后不良。CXC 趋化因子受体1 型(CXCR1)可以促进肿瘤的发生发展,并在晚期胃腺癌中过度表达,胃癌细胞中CXCR1 基因的敲除下调了HSP27 的表达,提示CXCR1、HSP27 与胃癌发生相关[22]。其他研究表明HSP27 可与细胞色素c 结合 调 节 其 抗 凋 亡 作 用,例 如,Bruey 等[23]发 现HSP27与细胞色素c的结合阻止了细胞色素c与凋亡蛋白酶激活因子-1(APAF-1)和procaspase-9 的相互作用,从而抑制了caspase激活。此外,可溶性环氧化物水解酶抑制剂t-AUCB 阻断HSP27 的激活后可以增加caspase-3 的活性,进而诱导胶质母细胞瘤细胞的凋亡[24]。还有研究发现食管鳞状细胞癌的干细胞特征和异常的代谢重编程取决于HSP27-AKT-HK2 途径,靶向HSP27 和HK2 可能成为治疗食道癌的新型治疗策略[25]。
2.3 肿瘤中HSP27的磷酸化效应
HSP27 在人类肿瘤中的表达水平已经得到了深入的研究,其异常表达与肿瘤的侵袭性、化疗的耐药性以及患者预后不良有关。然而,在肿瘤中对HSP27 磷酸化作用的相关研究报道较少。事实上,各种刺激物可以诱导HSP27 中丝氨酸残基15、78 和82 的磷酸化,这种翻译后修饰影响了HSP27的一些 细 胞 功 能[26]。 正常情况下,磷酸化的HSP27 具有抗增殖和抗凋亡作用,并参与血小板颗粒分泌和肌动蛋白丝动力学;HSP27 的异常磷酸化水平与病毒感染、肿瘤异质化、皮肤自身免疫性疾病和肾脏疾病有关[27-28]。
Yin 等[29]在胃癌中研究发现HSP27 上82 号丝氨酸上的磷酸化对TIIA 响应,从而诱导活性氧的产生和未折叠蛋白反应,并且HSP27 的磷酸化能够调节转录因子HSF1。Okuno 等[30]回顾性地评估了吉西他滨治疗前获得的49份活检胰腺癌组织样品,发现化疗前p-HSP27的高表达与更长的生存期相关,表明p-HSP27 表达可用于预测胰腺癌的预后。Guo 等[31]研究证明在胰腺癌细胞系中过表达HSP27 增强了肿瘤对吉西他滨的敏感性,并认为HSP27 的非磷酸化形式是使药物敏感性增强的重要原因。但Kang 等[32]的另一项研究认为,相对于HSP27 本身在细胞中的含量,磷酸化与非磷酸化HSP27间的比值更为重要。总而言之,HSP27磷酸化在肿瘤生理学中的确切作用尚不完全清楚,但是磷酸化HSP27 可能抑制细胞凋亡,并在HSP27的核转运与核保护中发挥重要作用。
3 HSP27与前列腺癌
HSP27 在PCa 细胞中的一个重要作用是其能帮助折叠和支持雄激素受体(AR)运输。AR 是睾酮和双氢睾酮的甾类受体转录因子,在前列腺癌,尤其是在去势抵抗性前列腺癌中起重要作用[33]。因此,探索HSP27 作为AR 伴侣蛋白的机制及作用功能,为进一步靶向HSP27 治疗前列腺癌和逆转耐药提供了新的研究思路。
3.1 HSP27在前列腺癌中的生物学作用
3.1.1 调节AR 信号通路 在前列腺癌细胞中AR 是一种客体蛋白,可与HSP90、HSP70 和HSP40(图2)以及诸如p23、FKBP-52 和α-SGT 等伴侣蛋白相互作用[34]。胞质AR 与HSP70 和HSP40 结合,在与HSP90和其他伴随物结合后,HSP70和HSP40发生解离。HSP90 能维持适当的AR 构象,保证其与配体二氢睾酮具有高亲和力,AR 与二氢睾酮的结合会导致其磷酸化并形成二聚体。随后,HSP27与AR 同型二聚体结合,支持其转运到细胞核。在细胞核中AR 可以结合雄激素反应元件(ARE)的特定DNA 序列,这些结合位点位于某些基因的启动子序列中,从而可以调控其他基因的转录活性[35],这种作用方式是经典的AR信号传导途径。
除经典途径外,研究结果还表明:雄激素及其他类固醇激素刺激能够使AR 定位于膜脂质筏的微区并与AKT 相互作用,激活AKT 信号传导[36-37]。Li 等[38]的 研 究 发 现,膜 相 关AR 可以 通 过激 活HSP27 来增强胞内AR 的活性和核输入,从而进一步增强经典AR 作用。因此,当AR 通路持续激活时,HSP27 可以作为抗CRPC 治疗的理想靶点。已有研究发现HSP27 磷酸化抑制剂KRIBB-3 和NFκB 抑制剂BAY 11-7082 联用能使前列腺癌细胞中AR 和AR-V7 表达水平显著下调,并且对HSP27 的抑制作用能够通过对NF-κB 途径抑制而增强[39]。此外,抑制HSP27也会限制PCa中其他肿瘤蛋白的致癌能力,并改变CRPC 细胞中相关的信号传导和转录网络[15]。
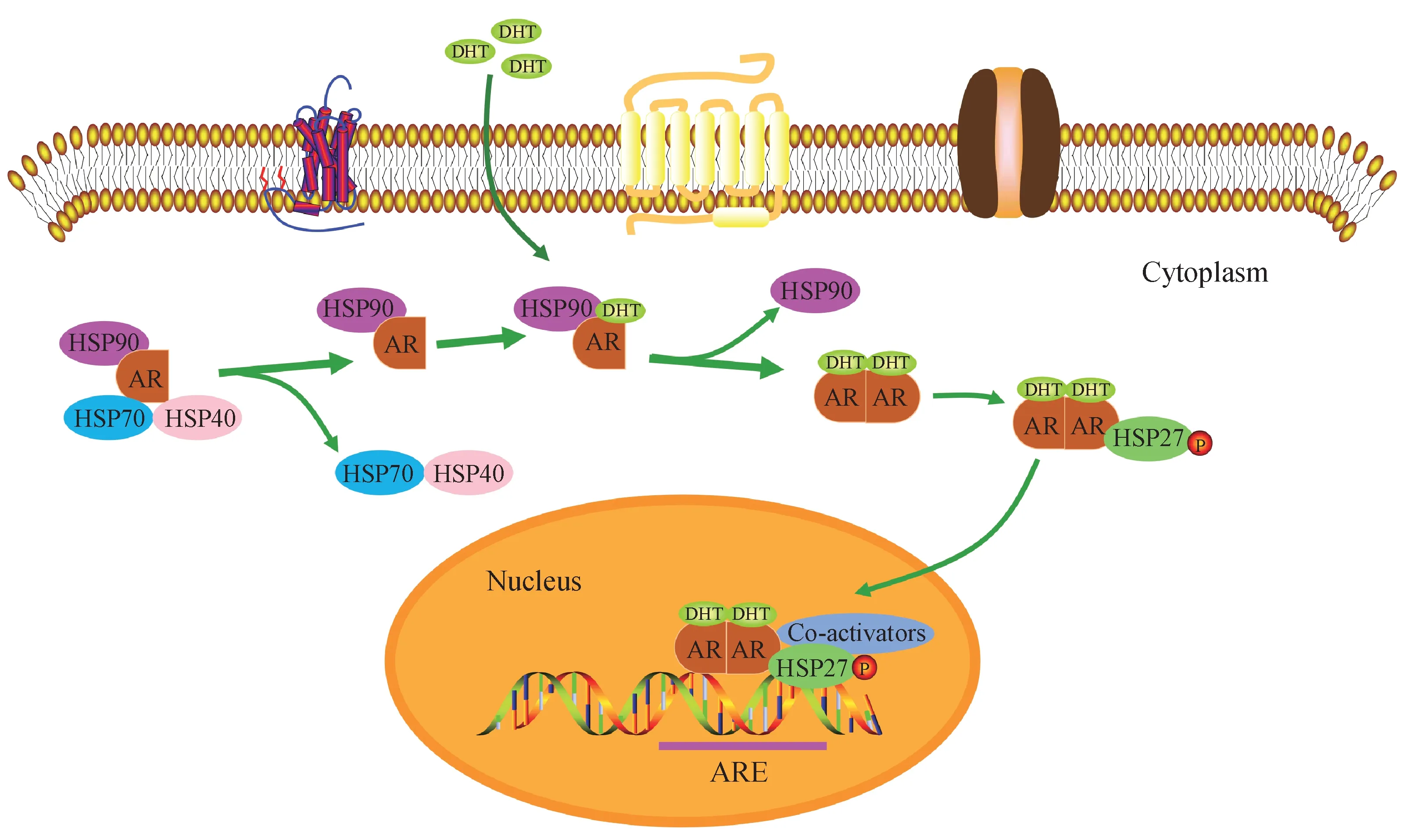
Figure 2 Proposed roles of HSP proteins in the regulation of AR signaling
3.1.2 抗凋亡与促增殖效应 HSP27磷酸化后会形成伴侣分子寡聚物调节多种细胞存活相关信号通路,HSP27 能够与细胞色素c 结合并抑制caspase 活 化 和 细 胞 凋 亡[40]。 并 且,HSP27 能 与STAT3、eIF4E 和TCTP 相互调节,对雄激素剥夺和紫杉烷类细胞毒性药物诱导的凋亡发挥抵抗作用[41]。研究发现当抑制STAT3、eIF4E 或TCTP 时,HSP27 的抗凋亡作用严重受损,这表明它们在HSP27 诱导的细胞保护中发挥作用[42]。Zoubeidi等[43]研究认为HSP27 能以IGF-I 依赖的方式促进ERK 和Akt 磷酸化,维持BAD/14-3-3 复合体稳定性,降低细胞凋亡率。Hayashi 等[44]报道HSP27 可以控制磷酸化蛋白-15(PEA-15)的活性,从而促进细胞增殖并抑制Fas 诱导的细胞凋亡,并且LNCaP细胞中HSP27 的过表达可使Akt 介导PEA-15 在Ser116 位磷酸化,磷酸化的PEA-15 不再与ERK 结合,而是与Fas相关死亡域蛋白(FADD)结合,导致细胞凋亡被抑制,该研究认为在具有PTEN 缺失及Akt 高表达的患者中使用HSP27 抑制剂会产生积极的治疗效果。这些结果提示HSP27 在PCa 细胞中具有双重抗凋亡和促增殖活性,并具有良好的临床应用前景。
3.1.3 介导耐药性产生 临床研究发现在进行雄激素剥夺或化学药物治疗后,前列腺癌细胞中HSP27 表达显著增加并作为细胞保护性伴侣分子发挥作用,使细胞具有耐药性[45]。Cui等[46]研究证明HSP27 与神经内分泌PCa 细胞(NEPCa)的耐药有关,具有化疗抗性的NEPCa 细胞很可能是在雄激素剥夺治疗后产生的,他们甚至可以使邻近的PCa 细胞产生耐药性。 由NEPCa 细胞分泌的PTHrP 被发现能调节邻近的PCa 细胞的p38/MAPK/HSP27信号,而这些信号分子的激活能够通过增加AR 的核易位与上调p21 来影响AR 的活性,最终导致包括多西他赛在内的许多抗肿瘤药物耐药。Ketteler 等[47]研究发现整合膜蛋白caveolin-1 缺失型细胞的ASMase 活性和神经酰胺生成增加,导致MAPK/HSP27/AKT 信号传导途径改变,最终使肿瘤细胞的凋亡敏感性增强,达到逆转耐药效果。此外,有研究发现HSP27 能够与真核翻译起始因子4E(eIF4E)相互作用,减少eIF4E 的泛素化和蛋白酶体降解,保护蛋白质合成的起始过程,从而提高去势或化疗过程中细胞在应激状态下的存活率[48]。Ziouziou等[49]通过BRET分析与分子模拟相结合的方法找到了一种2,3-二氧吩嗪类衍生物,它能够有效地抑制肿瘤细胞活性并通过干扰HSP27/eIF4E相互作用而增加化疗敏感性。
3.1.4 促进细胞迁移和侵袭 HSP27 的表达增加与前列腺癌发展为易转移扩散的CRPC 有关。有研究报道HSP27 能通过翻译控制PCa 中的相关肿瘤蛋白(如TCTP)表达,从而促进肿瘤恶性发展[41]。并且HSP27 能够促进前列腺癌细胞的转移,通过MMP-2 增加细胞侵袭性[50]。例如,Lee等[51]发现HSP27 能够调控前列腺癌中TGF-β 通路增强MMP-2 的活性,并通过调节STAT3 依赖性MMP-2 表达来增强细胞迁移和侵袭。并且,由EGF 诱导的AKT、GSK3β 磷酸化以及β-catenin 核转运需要HSP27 参与,沉默HSP27 能够降低βcatenin 的EGF 依赖性磷酸化,增强β-catenin 的泛素化和降解,阻止β-catenin 核易位及与Slug 启动子的结合,进而调节前列腺癌中EGF/β-catenin 介导的上皮间质转化(EMT)过程[52]。此外,HSP27还能够通过激活IL-6-STAT3-Twist 信号通路来调节EMT[53]。
3.2 HSP27作为前列腺癌的预后标志物
虽然HSP27 在各种肿瘤类型中都有表达,但许多研究认为HSP27 是PCa 的一个独特而重要的标志物。HSP27 在PCa 细胞中的表达增加间接反映了肿瘤的转移趋势以及不良的预后状态。最近的蛋白组学研究表明,HSP27、ALDH6A1 与抗增殖蛋白可作为3 种生物标志物来监测前列腺肿瘤早期和晚期的状态变化[54]。在局部进展性PCa 患者中发现HSP27 的高表达与预后不良有关,即使在缺乏典型ETS 基因重排的病例中也有发生CRPC的高风险[43,55]。HSP27 在大量CRPC 病例中持续过表达,并且很多病人在雄激素剥夺治疗后HSP27水平也出现了相应的升高[56]。
3.3 以HSP27为靶点的前列腺癌治疗方法
与HSP90 和HSP70 不同,HSP27 由于其结构中缺少ATP 结合域,不适合作为小分子抑制剂的直接作用靶点。其他靶向机制,如Dong 等[57]将HSP27 作为CRPC 的治疗靶标,把siRNA 压制成纳米颗粒,制造出两亲性磷脂肽树状聚合物(AmPPDs)保护siRNA 靶向HSP27 而不被酶降解。反义核苷酸也被运用其中,通过与HSP27 的mRNA 结合阻止其翻译,从而抑制HSP27 在PCa 细胞中的表达,达到抑制肿瘤的作用。例如,OGX-427 是一种作用于HSP27 的反义寡核苷酸,能够促进LNCaP 细胞中AR 的降解,经OGX-427 处理的LNCaP细胞异种移植的小鼠肿瘤细胞凋亡增加,转移潜能降低,且血清PSA 水平显著降低[53]。研究发现包括自噬抑制剂在内的PCa 治疗组合方案既能增强OGX-427 的促凋亡作用,又能抑制肿瘤的生长,提示自噬很可能是HSP27耗竭的代偿反应[58]。
Nappi 等[59]发现12 个HSP27 二聚体可组成球形单体复合物,在其末端结构域之间存在由丝氨酸残基组成的磷酸化口袋,通过荧光共振能量转移(FRET)和荧光偏振(FP)分析的组合筛选鉴定出伊维菌素(IVM)。IVM 能够特异性结合HSP27复合物的磷酸化口袋,抑制MAPKAP2 介导的HSP27 磷酸化和解聚,进而阻断HSP27 调节的存活信号及癌蛋白相互作用,在前列腺癌和EGFR/HER2 驱动的肿瘤模型中增强了抗AR 和抗EGFR药物的活性。
HSP27 作为伴侣分子协助前列腺癌中AR 的核转位与功能激活,并促进AKT 的磷酸化,而AR与AKT 信号网络在前列腺癌糖酵解作用中发挥着重要作用[60]。最近研究发现汉黄芩素类衍生药物FV-429 能够通过影响p-HSP27 与AR 间的相互作用,抑制AR 入核与磷酸化激活,并扰乱AKT/HK2调控的前列腺癌糖酵解功能,进而促使前列腺癌细胞代谢紊乱与凋亡,达到抑制肿瘤效果。
近年来,靶向HSP27 寡聚化方法的出现使以HSP27 为靶点的治疗有更多的选择,像zerumbone(ZER)这样的小分子通过其半胱氨酸残基的交联导致HSP27 的二聚改变,从而抑制HSP27 低聚化,增加肿瘤细胞对放疗的敏感性[61]。利用计算药物重新定位的方法,Heinrich 等[62]识别出6 种化合物,其中5 种可以结合HSP27 并限制其伴侣活性,体外研究表明这些化合物具有减弱肿瘤细胞耐药的作用,这些方法可能适用于今后PCa的靶向治疗研究。
4 结 论
HSP27在肿瘤发生中发挥重要作用,并且与前列腺癌转移以及去势耐药相关,可作为潜在的临床生物标志物,用于前列腺癌患者的诊断和预后标记。此外,HSP27还可作为前列腺癌治疗的潜在靶点,有助于新型化疗药物的开发。
然而,现阶段研究还没有完全解释清楚肿瘤细胞和正常细胞对HSP 的不同需求,而进一步的研究可以为开发更有效、毒性更小的新型抗肿瘤HSP27 抑制剂找到一个治疗窗口。现研究开发的一些HSP 抑制剂缺乏令人满意的抗肿瘤活性,且具有一定的器官毒性,而对一种HSP 的抑制可能会刺激其他HSP 过度表达,从而减弱单一HSP 抑制剂的抑制作用。例如,HSP27的抑制会刺激热休克反应,导致其他HSPs 的过表达。因此,联合使用不同的HSPs 抑制剂可能是提高肿瘤治疗疗效的一种良好策略,而进一步了解HSP27 的功能和分子机制对于提高前列腺癌诊断的准确性和开发更有效的化疗药物具有十分重要的意义。

