肿瘤的近红外光免疫治疗研究进展
李 芳,辛俊勃,施 秦*,毛成琼
(1江苏医药职业学院药学院,盐城224005;2维克森林大学医学院肿瘤生物学部,美国温斯顿塞勒姆27157)
光动力学治疗(photodynamic therapy,PDT)是将光吸收剂与非电离光的物理能相结合进而杀死细胞。但是,它在肿瘤治疗中并不常用,原因是非靶向的光吸收剂也能够被正常组织摄取,经光照后即可引发严重的副作用[1]。为此,寻求光吸收剂肿瘤靶向传递的新策略是当前研究的热点。
近红外光免疫治疗(near infrared photoimmunotherapy,NIR-PIT)是一种新兴的靶向肿瘤治疗方法,通过将单克隆抗体(monoclonal antibody,mAb)与光吸收剂IRDye700DX(IR700)偶联形成抗体-光吸收剂结合物(antibody-photoabsorber conjugate,APC)(图1-A),经近红外(NIR)光活化导致细胞坏死或免疫原性死亡[2]。与常规的肿瘤治疗手段不同,NIR-PIT 不仅可以特异性地杀死肿瘤细胞,还能够有效控制和治疗肿瘤转移[3-4]。目前,已有NIR-PIT 制剂进入临床试验阶段,如靶向EGFR 的cetuximab-IR700 被用于不可手术治疗的头颈癌的临床研究,Ⅰ期与Ⅱ期临床试验均非常成功,已于2019 年进入快速追踪的全球Ⅲ期临床试验阶段。早期临床数据显示,NIR-PIT 治疗复发性头颈癌的效果优于二、三线疗法[5]。鉴于NIR-PIT 在肿瘤靶向治疗中的巨大潜力与应用前景,本文将从NIRPIT 的要素、影响因素、抗肿瘤作用机制、存在问题及对策等方面进行总结。
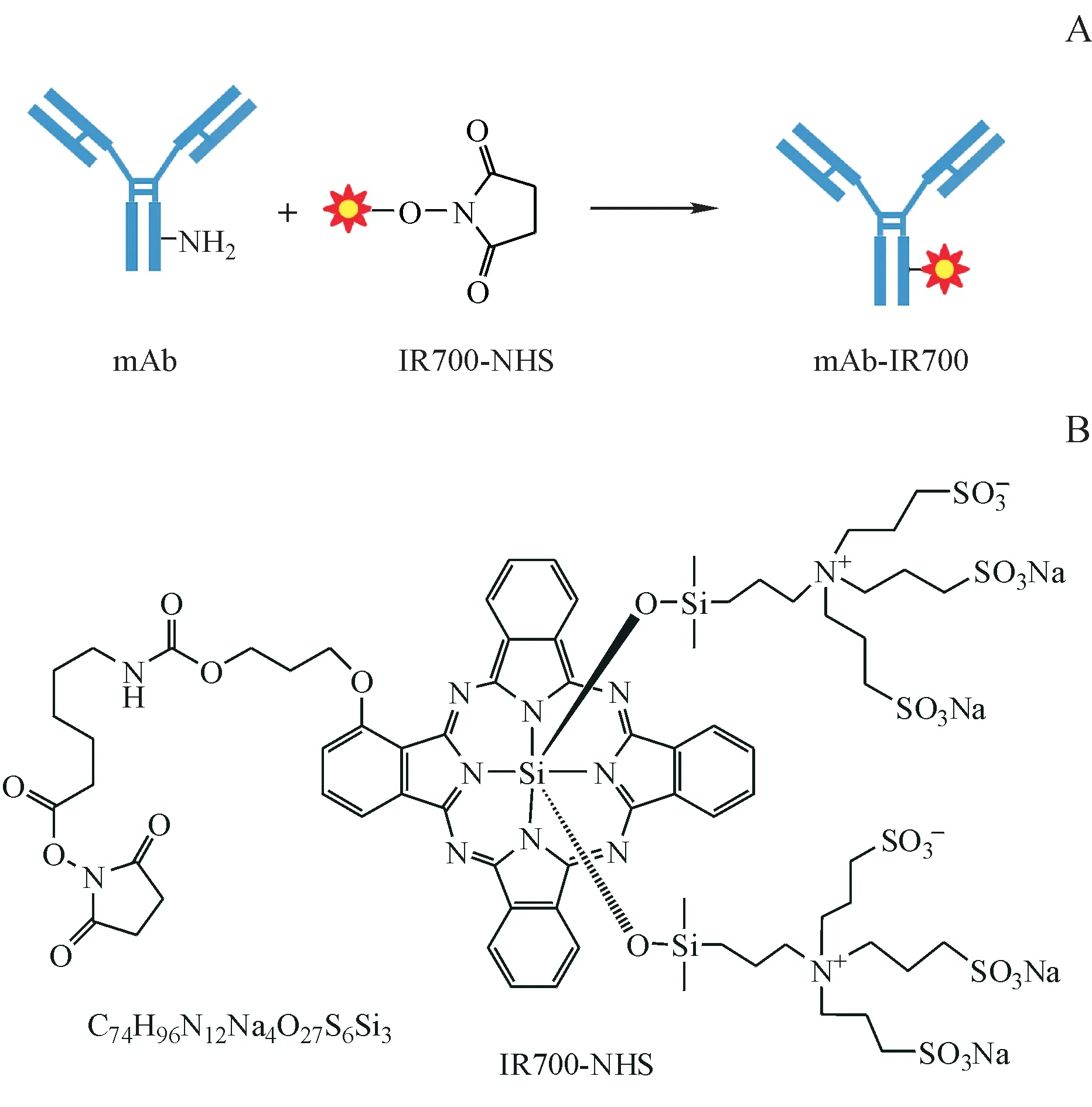
Figure 1 Components of Near infrared photoimmunotherapy (NIR-PIT)A: Synthetic strategy of antibody-photoabsorber conjugate; B: Structure diagram of IR700-NHS
1 NIR-PIT的要素
NIR-PIT 需要mAb、光吸收剂与NIR 光3 个要素,是将抗体静脉注射的特异性与光吸收剂经NIR光照射后的急性毒性相结合的一种靶向光动力学疗法,也是近年肿瘤治疗研究中的热点之一。虽然大多数的APC 还处于实验室或动物研究阶段,但前期的研究结果均证实了NIR-PIT 能够高效杀灭靶肿瘤细胞,且不会破坏非靶肿瘤或正常组织。
1.1 mAb
在现有靶向治疗中,mAb 治疗的历史最为悠久。截至2018 年5 月10 日,FDA 已批准80 个治疗性mAb,但其使用剂量较大,成本非常高。也有研究将低剂量的mAb 用作传递放射性核素、化学药物或生物毒素等的载体[1],结果显示其靶向性能优良。由于mAb 的肿瘤特异性高,通过与肿瘤细胞表面的抗原相结合,可使NIR-PIT 具有肿瘤靶向性,从而克服了传统PDT 缺乏特异性、副作用大的缺陷。研究还发现,mAb 在临床上也会出现耐药性,如trastuzumab[6]、cetuximab[7]等。另外,mAb 进入体内后,首先与血管周围的靶细胞结合,这种高亲和力会导致抗体被困在血管周围间隙而不能进一步渗透到肿瘤。但是,NIR-PIT 可以解决这个问题,给予光照后,NIR-PIT 会迅速对该层细胞造成毒性作用从而引起血管周围细胞突然坏死与血管完整性丧失。此时,肿瘤组织间隙液压下降,血管扩张且通透性显著增加,更有助于APC 进入肿瘤深处[8],也有望克服mAb的耐药性问题。
目前,文献报道的抗体主要靶向EGFR[9]、HER2[4]、TROP2[10]、CD47[11]、CD146[12]、DLL3[13]等,涉及的肿瘤有卵巢癌[14]、胃癌[15]、膀胱癌[16]、黑色素瘤[12]等。
1.2 光吸收剂
虽然靶向光疗概念的提出已经有30 多年了,但是传统PDT 中使用的光吸收剂仍大多为选择性差疏水性大的小分子。它们不仅能够与肿瘤细胞结合,也可以和包括皮肤、其他上皮表面在内的正常细胞结合而引起不必要的光毒性。尽管学者们尝试将多种常规光吸收剂与mAb 相结合以改善其选择性,然而效果并不明显,尤其在其体内疗效评价上。
IR700 是一种具有高消光系数和中荧光量子产率的硅酞菁染料,NIR光激发波长为690 nm。它对自然光具有光化学稳定性,即便在高染料/蛋白比时也不会聚集,且无非特异性的蛋白结合[17]。因其水溶性好,故而不易进入细胞[18]。将IR700连接到抗体形成APC 后,APC 静脉注射的药代动力学与抗体相似,从而实现肿瘤的高靶向浓集和最小的非靶向结合。与抗体-药物结合物(antibodydrug conjugate,ADC) 如 Kadcyla®(trastuzumab emtansine,T-DM1)相比,ADC会因为药物在血液的过早释放而造成脱靶毒性[19],而APC 选用的光吸收剂IR700无暗毒性,与APC分离后可通过尿液排泄,故而APC 的安全性更好[20]。不仅如此,IR700还具有荧光成像功能,在肿瘤治疗中借此可以确定光照部位,从而减少非相关组织的光暴露,同时可以非侵入性地监控治疗效果。
1.3 NIR光
NIR光疗本身不是热疗或破坏性疗法,因此可以安全地输送到正常组织而没有毒性。波长在700 nm 附近的NIR 光在活组织内表现出较高的光学穿透力,因为在此波长下,内源性发色团(水、血红蛋白、胶原蛋白等)的吸收度极低。除了借助mAb 的主动靶向性外,还可通过控制光照部位,选择性活化靶部位的APC 而杀死肿瘤细胞。NIRPIT 使用的NIR 光是非电离的,对DNA 无损伤,能够穿透至组织内1 ~2 cm处[21],比传统PDT中用的较低波长光的组织穿透性更好(紫外或可见光的穿透深度为1 ~3 mm),故而适合于肺癌[4]、弥漫性腹膜卵巢癌[14]的治疗。但是人体肿瘤往往在皮肤下的深层组织,NIR光的穿透性相对于临床需要仍然是有限的,为此,NIR-PIT 还仅适用于NIR 光可以照射到的浅表性肿瘤的治疗[14]。
2 NIR-PIT抗肿瘤效果的影响因素
研究表明,影响PIT 抗肿瘤效果的因素涉及APC 浓度、光剂量、光源的功率密度等[22]。在体外细胞培养模型上,当NIR 光剂量固定为2 J/cm2时,Pan-IR700 在0.3 ~3 μg/mL 质量浓度范围内与细胞死亡率呈正单指数相关(图2-A),但继续增加APC 的质量浓度(高于3 μg/mL),细胞死亡率并没有变化,这是由于此刻细胞膜抗原已达饱和。当APC 质量浓度固定,以100 mA 连续波、400 mA 连续波与1 733 mA 脉冲波3 种功率设定分别给予0.2 ~5 J/cm2的光剂量,3 种LED 光功率下均可观察到死细胞比例随着光剂量增加而升高,但3种功率水平对细胞死亡率没有明显影响(图2-B)。将Pan-IR700 浓度与光剂量的乘积(1.5 J·μg·mL-1·cm-2)作为有效剂量参数,3 组不同的Pan-IR700 浓度与光剂量但乘积相同的组合的细胞死亡率无显著性差异(图2-C)。体内原位乳腺癌模型数据再次证实PIT 诱导的细胞毒性和结合物剂量与光剂量的乘积有关。因此,可以通过增加APC 的剂量(不超过饱和上限)或光剂量(不超过热上限)来提高PIT 的细胞毒作用。而对于某个恒定的细胞杀灭水平,可以通过调节APC 浓度和光剂量来实现。此外,与光剂量相比,光源的功率密度并非是决定PIT 效果的重要因素,而且当光剂量固定时,光的传递方式(连续波或脉冲波)对PIT 效果也没有影响。但是,以相同的光剂量照射,激光在体内外对肿瘤细胞的细胞毒作用均强于LED光[23]。
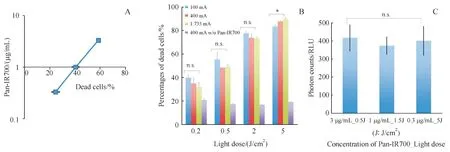
Figure 2 Phototoxicity of Pan-IR700 mediated PIT[22]A:At a constant light dose of 2 J/cm2,the correlation between the proportion of dead cells and the concentration of Pan-IR700;B:At a fixed concentration of Pan-IR700,the correlation between the proportion of dead cells and the light dose;C:The similar cell killing effect could be achieved by three different combinations:(1) 3 μg/mL and 0.5 J/cm2,(2) 1 μg/mL and 1.5 J/cm2,and (3) 0.3 μg/mL and 5 J/cm2 (P >0.05)
另外,Peng 等[24]发现cetuximab-IR700 的靶向PIT 效果还取决于细胞表面EGFR 的密度,EGFR密度最高的A431 细胞对PIT 最为敏感。不仅如此,肿瘤细胞的内在生物学特性也对PIT 的功效有重要影响。虽然scc-U2 细胞的EGFR 表达高于scc-U8 细胞,但由于scc-U2 细胞抗凋亡蛋白Bcl-2和Bcl-xL 的表达也明显高于scc-U8 细胞,故而PIT对scc-U8 细胞的杀灭效果更好。Nagaya 等[25]的研究也支持了PIT 的疗效与抗原表达水平有关,与EGFR 中度表达的MDAMB231 细胞相比,EGFR 高表达的MDAMB468 细胞对NIR-PIT 更敏感。虽然各NIR-PIT 组均能够抑制肿瘤生长、显著延长生存期,但是,在给予总浓度相等的APC 的情况下,少量多次给药并重复光照能够进一步改善抗肿瘤效果[25]。此外,肿瘤部位的氧也会影响PIT 的效果,体外单线态氧清除剂废除了PIT 的作用,而体内试验对短暂缺氧的肿瘤进行PIT 并没有任何治疗效果[26]。
3 NIR-PIT的抗肿瘤作用机制
3.1 APC的细胞定位
NIR-PIT 的抗肿瘤作用机制与APC 在靶细胞的分布密切相关,定位于线粒体或者细胞质的光吸收剂能够诱导细胞凋亡,而分布于细胞膜的光吸收剂会导致细胞坏死[27]。 用远红外染料CF640R(640R)替代IR700以避免对活细胞造成光毒性,结合物Pab-640R 主要分布于细胞膜上,但由于内吞作用,随着细胞与Pab-640R 共孵育时间的延长,结合物也会逐渐分布至细胞囊泡[28](图3-A)。 相似现象也发生在Tra-IR700 处理的3T3/HER2 细胞中,与LysoTracker-Green 共定位可见APC 内化后主要分布于溶酶体中[1](图3-B)。SAM等[27]比较了美洲驼单结构域抗体(VHH)光吸收剂结合物(VHH[PS])与细胞穿膜肽偶联的VHH[PS](VHH[PS]-CPP)的抗肿瘤效果,结果显示VHH[PS]的细胞杀灭效果显著优于内化的VHH[PS]-CPP,表明APC 分布于细胞膜能够获得更好的NIR-PIT效果。
3.2 NIR-PIT后细胞膜的形态与功能变化
丝状伪足是从细胞边缘伸出来的富含肌动蛋白的薄手指样突起,普遍存在于肿瘤细胞中,在肿瘤细胞转移及促进扩散癌细胞在次生器官的生存与增殖中发挥重要作用。以NIR 光照射Tra-IR700处理的3T3/HER2 细胞后15 min 可观察到丝状伪足的数量明显减少(图3-C)[29]。用显微镜还可观察到靶细胞溶胀、形成气泡,继而囊泡破裂(图3-D),且细胞膜破损的严重程度随光剂量的增强而加剧[30]。3D 动态低相干定量相显微镜(3D LCQPM)通过低相干光源以纳米分辨率连续获得细胞膜的形貌图像而无需任何标记。用3D LC-QPM观察PIT 后的细胞形态[31],3T3/HER 细胞经NIR 光照射48 s 后可观察到细胞溶胀、产生一些小气泡,这些小气泡变大并积聚成更大的气泡直至细胞膜破裂(图3-E)。在NIR 光照射64 s 的细胞中,在成像时即观察到1/3 的细胞膜已经破裂(图3-F),而在NIR 光照射76 s 的细胞中绝大多数细胞膜已经破裂了(图3-G),且细胞膜破裂发生在mAb-染料偶联物的外周结合位点附近,可能是因为细胞结合的偶联物聚集暴露在光线下会引起表面张力的变化,从而使细胞渗漏。
在细胞膜由完整、损伤到破裂的过程中,其通透性也发生了明显的变化。在NIR 光照射后立即就观察到高渗透压条件下Na+(直径0.5 nm)的迅速内流,但在质膜损伤初期葡聚糖分子(直径~3.7 nm)尚不能通过。在光照后钙黄绿素(直径1.4 nm)也不能立即从细胞内流出,但光照3 min后它逐渐从细胞中消失,直至在明场中观察到明显的质膜损伤。而荧光分子EthD-1(直径2.6 nm)是在明场中观察到许多气泡后才进入细胞。可见,当NIR 光照射使质膜大面积受损时,其渗透性随时间延长而增大[32]。虽然微小的质膜穿孔通常不会造成细胞死亡,但是NIR-PIT 引起的微损伤随着时间延长而不可逆地加重,故而,微小的质膜损伤触发了质膜渗透性的增强。因此,mAb 与肿瘤细胞表面抗原结合后,在NIR 光照射后的数分钟(最早1 min)内,即可观察到靶细胞的细胞膜破裂[33-34],从而引起细胞的快速不可逆的坏死。在NIR-PIT 后,使用超极化富马酸酯的代谢MRI 显示在表达EGFR 的A431 肿瘤异种移植物中产生了苹果酸,也为NIR-PIT 诱导的光敏性肿瘤坏死提供了直接证据[35]。
3.3 NIR-PIT的细胞毒作用机制
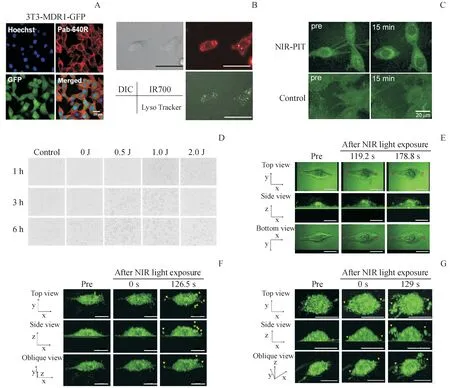
Figure 3 Cellular localization of APC and morphological changes of cell membrane after NIR-PITA:Confocal images of the distribution of Pab-640R in P-gp positive and GFP-expressing 3T3-MDR1 cells.Nucleus was stained by Hoechst 33342(blue)[28]; B:Lysosomal localization of Tra-IR700 6 h after coincubation with 3T3/HER2 cells [1];C:Change in amount of filopodia on 3T3/HER2 cells after NIR light irradiation [29];D:In vitro microscopic images of A431 cells after PIT [30];E-G:3D-LC QPM images of 3T3/HER cells after PIT.NIR light exposure time was 48 s (E),64 s (F) and 76 s (G),respectively.Red asterisk represents a bleb,while yellow arrowhead represents a flying fragment [31]
Sato 等[36]阐明了由NIR-PIT 引起的细胞死亡的分子机制。IR700-NHS 的结构如图1-B,该酯可用于偶联mAb 的赖氨酸残基。从化学结构看,基本扁平的芳香族酞菁环被保持在芳香族核心上方和下方的氧基硅丙基-氨基三丙基磺酸基团所抵消。该立体化学结构使得即使在抗体上多取代时也能防止多个芳香环的π 堆积,从而分别减轻了染料和mAb 的淬灭与聚集。6 个附加的磺酸基团和2 个四氨基基团使染料在生理pH 下为两性离子,故而所得的mAb-IR700 结合物具有高度水溶性。暴露于NIR 光后,IR700 分子与APC 均发生了光诱导的化学变化。在NIR-PIT 处理的肿瘤床中常为缺氧或富电子供体的环境,IR700 经历光化学配体反应,分解时以光剂量依赖的方式先失去一个继而失去第二个酞菁环核平面上方或下方的轴向磺酸臂,并使其余分子变得非常疏水和无荧光特性[17](图4-A)。这种化学变化导致形成硅酞菁IR700 环的Z-堆积多聚体或水不溶性的APC 或APC-抗原复合物的聚集体,从而引起IR700 荧光的淬灭。光化学配体释放反应导致APC-抗原复合物中的物理化学变化,这会损伤跨膜靶蛋白,从而降低细胞膜的完整性,导致水流入细胞随后引起起泡和细胞裂解(图4-B)。
利用三维动态活细胞显微镜、放射性和荧光探针以及生物标记物进一步研究了NIR-PIT 细胞毒作用的机制[5]。3D LC-QPM成像显示,在细胞膜受损后,水流入细胞,细胞体积一开始就膨胀了约3 倍。 用双侧倒置选择性平面照明显微镜(diSPIM)观察NIR-PIT 后细胞内容物的释放。细胞的快速溶胀导致膜更大程度地撕裂,使胞浆内的物质释放到细胞外空间。借助diSPIM 观察表达胞质绿色荧光蛋白(GFP)的细胞,结果显示GFP在细胞溶胀过程中被限制在细胞内,但是一旦细胞膜破裂,它便迅速分散。结合于细胞膜的APC 主要通过这一机制诱导靶细胞的快速坏死,这也是NIR-PIT抗肿瘤的主要作用机制(图5)。
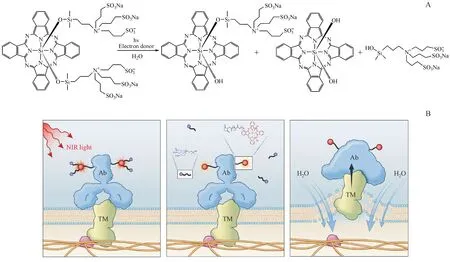
Figure 4 Mechanism of NIR-PIT mediated cytotoxicityA:Scheme of chemistry basis for NIR-PIT;B:Schematic diagram for physical changes of APC-antigen complex [5,17]
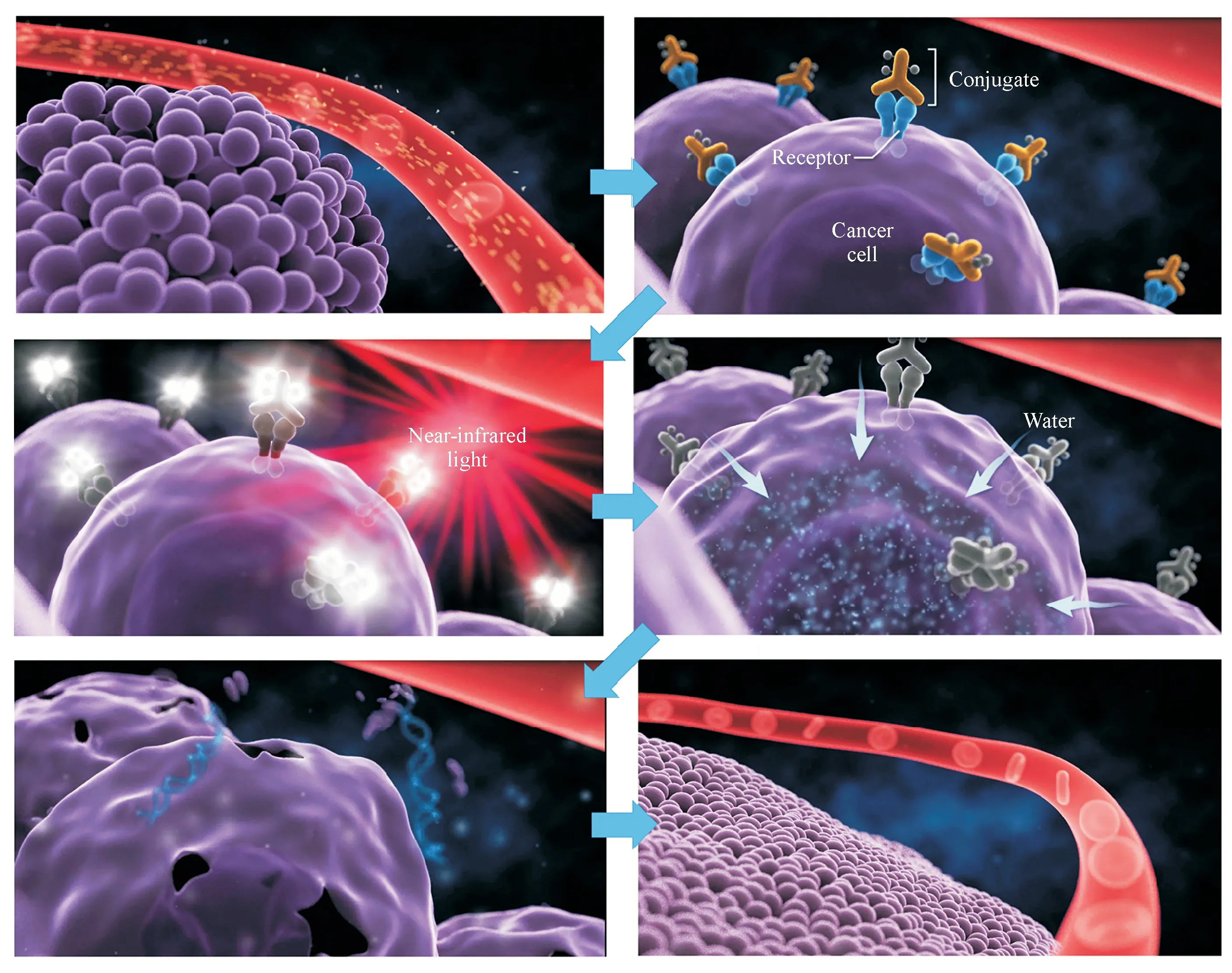
Figure 5 Schematic diagram of NIR-PIT induced cellular toxicity [17]
除此之外,Mitsunaga 等[1]观察到NIR 光照射后,活性氧自由基(ROS)的生成造成了靶受体表达肿瘤细胞的死亡。在另一项研究中,NIR-PIT 抑制肿瘤生长的机制包括ROS 生成、葡萄糖代谢降低以及受体表达的下降[12]。也有研究观察到,NIRPIT 过程中既有单线态氧的生成,也有ROS 生成[26],该机制类似于PDT,APC 在内质网或线粒体蓄积可诱导细胞凋亡,而其在溶酶体的蓄积可延缓细胞凋亡时间[37]。另外,NIR-PIT 还能够在体内引起非靶向的与血液中APC 浓度相关的血管阻塞,从而抑制肿瘤生长[38]。
4 NIR-PIT存在的问题及对策
4.1 组织穿透深度
NIR-PIT 使用LED 灯和激光光源进行表面光照在动物模型上取得了良好的疗效。被FDA 批准临床Ⅲ期试验的cetuximab-IR700 也是通过静脉给药,并于约24 h 后用激光光源以690 nm 波长NIR光对肿瘤进行照射治疗,许多患者的肿瘤明显缩小,且副作用很小。NIR-PIT 的疗效取决于APC 进入靶组织的能力以及将NIR 光传递到该组织的能力。NIR 光可通过外部光源轻松地传递到口腔和皮肤的病变处,但是,在更深处的肿瘤中,由于组织中天然吸收剂的存在,光会迅速衰减,且单个光源的照射可能会产生异质性NIR 光暴露,从而导致肿瘤的治疗不充分。
4.1.1 使用光纤扩散器[21]由于肿瘤的大小通常超过组织中光的穿透能力,因此,在临床治疗中,可通过放置在肿瘤组织间隙的光纤来传递光至更深的肿瘤。由于可以沿光纤的轴向均匀地传输光,所以,使用光纤扩散器的间隙光照对深度没有限制。在计算机断层扫描或超声引导下,通过针头或导管通常以10 ~15 mm 的间隔将扩散器插入肿瘤中。来自光纤扩散器的光可以使用前照明尖端或圆柱状光扩散器传递至目标肿瘤内,并散布到整个肿瘤床。Okuyama 等[21]研究发现,间隙光能量为100 J/cm 时,扩散器可以在光源周围大约1 cm 处向肿瘤传递足够的NIR 光,以实现有效的NIR-PIT;当光能量为50 J/cm 时,该有效距离降为距光源直径5 ~7 mm 的范围,且两种情况下在活体动物中均未产生热副作用。
4.1.2 内窥镜结合光纤扩散器 理论上,光可以传递到体腔(例如腹膜和胸腔)中并扩散,从而暴露出较大的表面积。但事实上,转化到人体时往往没有那么容易。将NIR 光传送到诸如腹膜之类的体腔的一种解决方案就是使用针头或内窥镜将光纤与远端光学扩散器一起引入[39]。预先注射APC 后,腹膜转移会结合药物,然后通过内窥镜光纤扩散器给予足够的NIR 光,以相对最小的侵入性方式进行治疗。尽管该技术尚未整合到内窥镜引导治疗中,但是光纤扩散器传输光的可行性已被证实[21]。在靶向EGFR 的复发性头颈癌患者的NIR-PIT Ⅰ期和Ⅱ期试验中,用间质光纤扩散器治疗较大的肿瘤取得了成功。Nagaya 等[39]以胃癌腹膜扩散小鼠为模型考察了基于内窥镜光纤扩散器(图6)的NIR-PIT 的疗效,结果显示治疗后肿瘤立即丧失了荧光素酶活性,腹膜植入物出现急性细胞坏死和微出血。由于人体比小鼠的腹膜空间更大,故而将内窥镜或腹腔镜用于人体的可操作性更强,因此,该技术有望扩展到使用腹腔镜、支气管镜、胸腔镜或膀胱镜等将光纤扩散器放置在肿瘤内或附近,并用于临床肿瘤的治疗。
4.1.3 外部光源与间质光源联用 Maruoka 等[40]比较了外部光源、组织间质光源与两者联合使用时NIR-PIT 的效果。与其他光照组相比,外部/间质光的组合显示出最明显的肿瘤体积减小和最慢的肿瘤再生长。因此,与两种单独递送方法相比,外部/间质NIR 光源的组合产生了优异的治疗效果。
4.1.4 可植入无线发光二极管(LED) 虽然光纤扩散器能够将光传递至体内几乎任何地方,但是,此过程具有侵入性,且不适合于NIR-PIT 的重复曝光治疗。为了限制深层组织中重复治疗的侵入性,同时保证疗效,Nakajima 等[41]开发了一种用于提供NIR 光的小型植入式无线LED。为了避免电池植入的潜在危害,通过从外部发射器线圈到与LED 耦合的植入接收线圈的电磁感应确保为植入的LED 供电。电磁场设置为符合人类使用的标准限制,即低于0.1 mT。该无线LED 系统能够通过使用低磁场来发射距发射器线圈20 cm 远的NIR光,且基于该LED系统的NIR-PIT能够在体外杀死肿瘤细胞并抑制荷瘤小鼠的肿瘤生长。因此,该可植入无线LED 系统有望为治疗人类深部区域的肿瘤提供新光源。
4.2 热效应
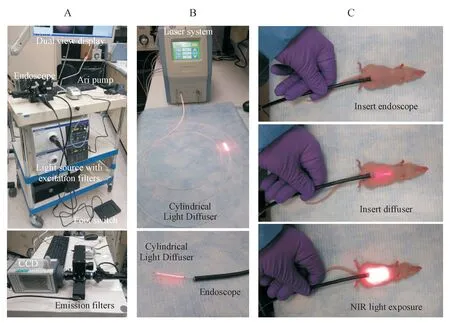
Figure 6 Multi-color fluorescence endoscopic system and NIR-PIT procedure[39]A:Multi-color fluorescence imaging system was composed of a clinically applicable fiber optic endoscope and light source; B:Cylindrical light diffuser with a NIR laser system; C:The endoscope was put into peritoneal cavity through a small incision,and the abdomen was inflated with air.Subsequently,abdominal cavity was exposed to NIR light by using the optical diffuser under endoscopic guidance
当NIR 光被结合APC 的组织吸收时,局部会产生一定的热量。在大多数情况下,这会导致亚临床皮肤温度升高。在暴露时间内若温度超过50 ℃,即可肉眼观察到皮肤的热损伤。在这种情况下,第2 天就会出现可见的红斑迹象。但是,当皮肤温度保持在50 ℃以下时则观察不到这种损害。适当的NIR 光剂量对实施NIR-PIT 很重要,尽管它因肿瘤细胞类型、大小和光源等的不同而变化,但研究表明光剂量在10 ~100 J/cm2之间时NIR-PIT 是有效的[23,42-43],而过度的曝光可能会导致与治疗无关的非特异性的热损伤。
Okuyama 等[44]研究发现,无论使用激光还是LED 光源,NIR 光都能迅速加热皮肤,而且皮肤温度的升高与所治疗肿瘤的体积或APC 浓度之间没有关联。但是,使用台式风扇进行空气冷却能够有效降低皮肤的温度,甚至可以降低约40% 的皮肤温度变化。
表面皮肤温度的升高在很大程度上取决于总的光剂量。当光剂量恒定,激光引起的皮肤温度升高大于LED 灯,这可能是激光的功率密度(600 mW/cm2)明显高于LED 灯(50 mW/cm2)所致。当NIR 光的功率密度高于600 mW/cm2时,在NIR-PIT后1 d 可观测到烧伤。因此,虽然激光缩短了照射时间,但也导致短时间内在暴露区域中光能沉积的增加,从而导致皮肤温度过高。有趣的是,无论光源的功率密度高低或曝光时间长短,肿瘤至少要获得一定的总光剂量是NIR-PIT 治疗成功的最重要决定因素。因此,可以通过使用较低的功率密度并延长曝光时间来获得肿瘤治疗效果,同时避免皮肤的热损伤[44]。
4.3 治疗效果的快速评价
肿瘤大小变化是目前评价NIR-PIT 体内抗肿瘤效果的常用指标,但是肿瘤的尺寸变化通常在治疗后3 ~4 d 才能够显现出来。为此,实时监控PIT 的治疗效果就显得非常重要,尤其是在内窥镜引导下手术和介入治疗过程中的即时反馈,因为只有如此才能确定一个PIT 疗程是否有效、是否需要重复治疗以及是否需要更强的光照、额外的光剂量和/或APC 的剂量等。虽然在体外观察到PIT可引起细胞形态的迅速变化,但遗憾的是目前临床上可用于实时评价PIT 效果的成像技术还很有限[45]。
4.3.1 葡萄糖摄取 根据Warburg 效应,肿瘤生长需要过量的葡萄糖,因此,用于提供局部葡萄糖代谢指标的18F-FDG PET 已被用于临床前或临床研究检测肿瘤或监测肿瘤治疗效果。Sano 等[30]用18F-FDG PET 在PIT 介入治疗小鼠前后监测了其在肿瘤萎缩前的急性细胞毒作用。体内18F-FDG PET 成像显示,PIT 治疗后75 min 时在治疗的肿瘤内放射性累积降低了76%,且维持24 h。而非治疗组的肿瘤无任何变化,且各组肿瘤的大小均无变化。因此,PIT 引起的即时细胞毒作用能够通过葡萄糖摄取的下降而被检测到,且该现象比肿瘤萎缩的发生早很多。
4.3.2 荧光寿命(fluorescence lifetime,FLT) 荧光蛋白(fluorescent protein,FP)是监测体内肿瘤生长的潜在替代方法。但是,不管细胞存活与否,FP都会保留其信号,甚至在坏死细胞中也可能被巨噬细胞吸收。因此,使用FP 的荧光成像更适合于纵向监测光疗的效果。尽管IR700 具有荧光且能反映肿瘤的负荷,但在溶酶体中分解代谢和光漂白后,荧光可能会减少,从而导致难以准确判断组织活力。所以,FP 与IR700 的荧光均不适合表征PIT 的疗效。而FLT 是一个可靠的评价指标,它不依赖于APC(如Pan-IR700)的浓度或溶液中的曝光量,似乎只有周围的化学微环境才会影响IR700的FLT。
IR700 的FLT 相对比较长,因此其FLT 的变化可以是靶细胞死亡的很好的预测因子。随着Pan-IR700 逐渐内化到溶酶体中,IR700 的FLT 逐渐变长且为孵育时间的函数(FLT 从孵育1 h 的2.98 ns延长至孵育24 h 的3.42 ns)。当暴露于阈值及以上的NIR 光时,Pan-IR700 引起的细胞膜和溶酶体膜的破坏导致IR700 在细胞质内聚集并进入细胞外空间,与此同时显著降低了IR700 的FLT。因此,FLT 的缩短可以作为PIT 引起的急性膜损伤的指标。体内亦是如此,在单次有效剂量的NIR 光照射后30 min 内,可观察到体内治疗肿瘤的FLT缩短,它在肿瘤大小和形状改变前几天即显示出生物学效应。FLT能够立即读出肿瘤的状态,在治疗后可以立即评估PIT 对肿瘤细胞的治疗效果,并帮助决定在治疗过程中是否需要额外的光剂量[45]。
4.3.3 生物发光信号 萤光素酶-萤光素光子计数技术是在报告基因技术的帮助下开发的,已广泛用于体内外分子和细胞生物学。萤光素酶-萤光素光子计数成像最常见的报告基因是编码萤火虫萤光素酶的基因,该酶通过消耗三磷酸腺苷(ATP)、Mg2+和氧气从而催化D-萤光素的氧化来发光。 该光子计数成像具有很高的肿瘤背景比(TBR),因此,灵敏度非常高。NIR-PIT 后荧光素酶 活 性 的 变 化 用% RLU (relative light units,RLU;%RLU=光照后RLU/光照前RLU×100)表示。与治疗前相比,在PIT 后立即就可观察到%RLU 下降了近一半,且随着时间的延长继续逐渐下降,说明细胞死亡仍在继续。PIT 后30 min 的%RLU 显著低于0 min,且PIT 后24 h 与48 h 的%RLU 又显著低于30 min。NIR-PIT 诱导已治疗肿瘤中ATP的快速释放导致荧光素酶-荧光素光子计数的快速减少。因此,荧光素酶活性能够反映NIR-PIT 早期与晚期肿瘤活力的降低,尤其适用于监测NIR-PIT后急性期的肿瘤活力。但是,该技术的分辨率不高,现有技术还无法让患者的肿瘤组织表达荧光素酶,故而尚不能转化到临床[46]。
5 总结与展望
NIR-PIT 在体内外对正常细胞无毒,具有肿瘤细胞高度选择性,能够特异性地结合到肿瘤细胞表面,经NIR 光照射引起细胞膜的破坏并诱导肿瘤细胞死亡。借助光纤扩散器、内窥镜、外部/间质光源联用等能将NIR 光传递至肿瘤深处,从而改善NIR 光的组织穿透性;借助风冷或降低功率密度延长照射时间可消除NIR-PIT 对照射部位的热损伤;借助葡萄糖摄取、荧光寿命、生物发光信号等的变化可快速评价NIR-PIT 的治疗效果。随着研究的逐渐深入,NIR-PIT 有巨大的潜力成为临床应用广泛的肿瘤治疗手段。

