AO+生物膜-水生植物生态系统对乡村黑臭河水中的EDCs去除试验研究
梁路 汤润芝 毛林强 张文艺
摘 要:本研究针对乡村黑臭河水内分泌干扰物(EDCs)生态污染问题,设计了AO+生物-生态乡村河道黑臭河水净化装置,在装置中构建了AO+生物膜-水生植物生态系统,分析了AO+生物膜-水生植物协同作用对EDCs(雌酮(E1)、雌二醇(E2)、雌三醇(E3)和乙炔基雌二醇(EE2))的去除特性,探求不同曝气方式对EDCs的去除效果。结果表明:在水力停留时间(HRT)为9.38 h时,E1、E2、E3和EE2去除率分别为58.16%,60.41%,54.09%,56.73%,明显高于HRT 7.82 h时的去除效果。模拟自然、持续曝气、间歇曝气3种状态试验结果分析,持续曝气状态对EDCs的去除效果最佳。高通量454测序表明,水体微生物特性发生了改变,多种优势菌属均有增加,进一步证实了异养菌对EDCs的去除有显著的强化作用。
关键词:生物膜;水生植物;内分泌干扰物;水生植物生态系统
中图分类号:X171 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2020.10.001
Study on the Removal of Endocrine Disruptors from Rural Black Smelly River Water by Biofilm- Aquatic Plant Ecosystem
LIANG Lu1, TANG Runzhi1,2, MAO Lingqian1, ZHANG Wenyi1
(1. School of Environmental & Safety Engineering, Changzhou University, Changzhou, Jiangsu 213164, China; 2. Changzhou Civil Municipal Engineering Design & Research Institute Company Limited, Changzhou, Jiangsu 213003,China)
Abstract: Based on rural black smelly river endocrine disruptors (EDCs) ecological pollution, designed the AO+ biological-ecological village river black smelly water purification plant, built in the device AO+biofilm - aquatic plant ecosystem, analyzed the AO+ biofilm-aquatic plants synergy of EDCs [estrone (E1), estradiol (E2) and estriol (E3) and ethinyl estradiol (EE2)] to remove features, explore different aeration methods on EDCs removal effect. The results showed that the removal rates of E1, E2, E3 and EE2 were 58.16%, 60.41%, 54.09% and 56.73% respectively when the hydraulic residence time (HRT) was 9.38 h, which were significantly higher than that of HRT 7.82 h. The result analysis of simulated natural, continuous aeration and intermittent aeration showed that continuous aeration had the best removal effect on EDCs. High-throughput 454 sequencing showed that the microbial characteristics of the water body were changed and a variety of dominant bacteria were increased, which further confirmed the significant strengthening effect of heterotrophic bacteria on the removal of EDCs.
Key words: biofilm; aquatic plants; endocrine disruptor; aquatic plant ecosystem
由于工業化的迅速发展,新兴产品层出不穷,如农业中的除草剂和杀虫剂[1]、医疗行业中的多种激素和抗癌类药物、工业中的新型塑料产品等,这些产品往往含有环境EDCs。在日常生活中,使用的表面活性剂、洗涤产品和消毒液也含有EDCs[2]。现如今,各国学者对于EDCs的危害已有一定研究,这些EDCs通常会影响人体内分泌系统[3-4],如史熊杰等[5]在研究环境EDCs毒理学时,发现EDCs在环境中即使拥有较低的暴露浓度,也会导致生物体生殖器官异常、生殖技能缺失[6-7],内分泌系统紊乱[8],种群退化[9]。EDCs中的固醇类激素[10]会对生物体生殖系统造成较大危害,如雌酮(E1)、雌二醇(E2)、雌三醇(E3)和乙炔基雌二醇(EE2)。本研究以固醇类激素为主要研究对象,运用厌氧好氧工艺法(Anoxic Oxic)及生物膜-水生植物协同作用对乡村黑臭河水中的EDCs进行去除试验,探究生态河道装置对黑臭河水中EDCs的消纳、分解能力,旨在为后续深入研究提供试验数据和工艺参数。
1 材料和方法
1.1 试验试剂及仪器
试验试剂及仪器见表1、表2。
1.2 试验装置及水样来源
本研究试验装置如图1所示,生物-生态模拟乡村河道的装置尺寸为3.2 m×0.51 m×0.82 m,水深约为0.50 m,淤泥厚度约0.20 m。在装置中布置立体弹性填料和人工水草,并种植圆币草、水菖蒲、再力花、香蒲、水葱、芦苇。其AO工艺的进水为配置的含有E1、E2、E3和EE2这4种EDCs的黑臭河水。设计HRT为9.38 h和7.82 h两种试验负荷,探究不同曝气方式对EDCs的净化效果[11]。经AO工艺处理后,其出水为本试验的主要装置进水,其数值如表3所示。
1.3 检测方法
1.3.1 EDCs检测方法 水体中EDCs的测定主要通过水样预处理、衍生化以及GC-MS处理分析[12]。
(1)预处理
预处理如图2所示。
(2)衍生化
在1.5 mL色谱进样瓶里加入100 μL的上述溶液,而后使用高纯度氮气将其吹干,接着在进样瓶中加入25 μL BSTFA和50 μL吡啶,等待其反应并吹干,最后加入二氯甲烷和正己烷体积比为1:4的进样溶剂以及10 μL浓度为0.01 g·L-1的内标,取1 μL注入GC-MS分析。
(3)GC-MS分析条件
试验中E1、E2、E3、EE2选用气质联用仪进行测定,色谱柱为TG-5MS(30 m×0.25 mm×0.25 μm),气相条件如下:
GC:以氦气为载气,流速1 mL·min-1;不分流方式进样,进样口温度280 ℃,进样体积1 μL柱初始温度为50 ℃,保持2 min,以12 ℃·min-1程序升温至260 ℃,保持8 min,再以3 ℃·min-1升温至280 ℃,保持5 min。
MS:接口温度280 ℃,传输线温度300 ℃,离子源为EI源,温度250 ℃,电子轰击能量70 eV,溶剂延迟时间12 min,以全扫描模式定性,扫描范围50~600 m·z-1,以选择离子扫描模式定量。
土壤中磺胺嘧啶采用紫外分光光度计测定,以氢氧化钠溶液作为提取液,在震荡箱中恒温震荡24 h后,静置取上清液为待测液,测定其在254 mm波长下的吸光度。
根据其衍生产物的特征碎片离子分布特征从而来确定目标产物的实际浓度,衍生产物的实际参数如表4所示。
1.3.2 高通量454测序 土壤中微生物种群用高通量454焦磷酸测序,采集农田土自然风干,过60目筛,模拟制备2,4-二氯苯酚浓度为30 mg·kg-1的土壤样品200 g,向土壤中施加生物菌肥5 g,同时加入135 mL蒸馏水,10 h后用高通量454焦磷酸测序,委托上海天昊生物科技有限公司检测。
2 结果与分析
2.1 HRT对EDCs去除特性分析
考察了2种HRT(9.38 h和7.82 h)下的生态河道装置对EDCs的去除效果,结果如图3、图4所示。
由图3和图4可知,生态河道中选用不同曝气方式对水体中EDCs的去除效果影响较大,其中持续曝气的生态河道装置对EDCs的去除效果最好,其次为间歇曝气,去除效果最差的为自然状态下的生态河道。可见溶解氧为影响去除率的主要因素,去除水体中的EDCs主要依靠整个水环境对其吸附和生物降解作用,通常情况下,微生物的降解作用为主要的去除途径,其中好养微生物的降解量约占生物总降解量的60%~70%,而厭氧环境下的EDCs降解约占20%~30%,剩下的为兼性厌氧菌所降解[13]。当水体中溶解氧浓度较高时,其对应的活性污泥量较大,而活性污泥具有松散,比表面积大的特点,对水体中EDCs有着较好的吸附作用,且在一定范围内提高溶解氧含量可以增加生物量,进一步提高对EDCs的去除效率,因此持续曝气生态河道模拟装置的出水EDCs浓度较低。间歇曝气的生态河道中,微生物的净化作用较强,因为间歇曝气使得水体中有部分厌氧环境,而由研究表明,微生物在厌氧环境中降解含氮有机物的硝化阶段,才是EDCs被降解的关键时段[14],氨氧化细菌在降解EDCs时,其降解能力比异养菌强[15-16],但其活性污泥对EDCs的吸附量较少,因此间歇曝气的净化效果一般[17]。相比于HRT为7.82 h的EDCs去除率,HRT为9.38 h的EDCs去除率较高,由此可见HRT越长,去除率越高,且不同干扰物之间的去除率差异较小,究其原因,主要为水流速度较大,影响微生物的降解作用。
2.2 曝气方式对EDCs去除率的影响
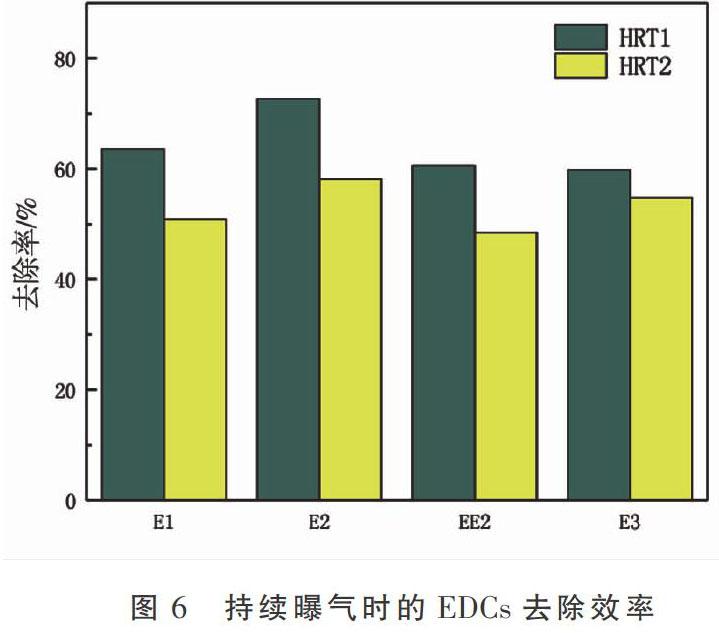
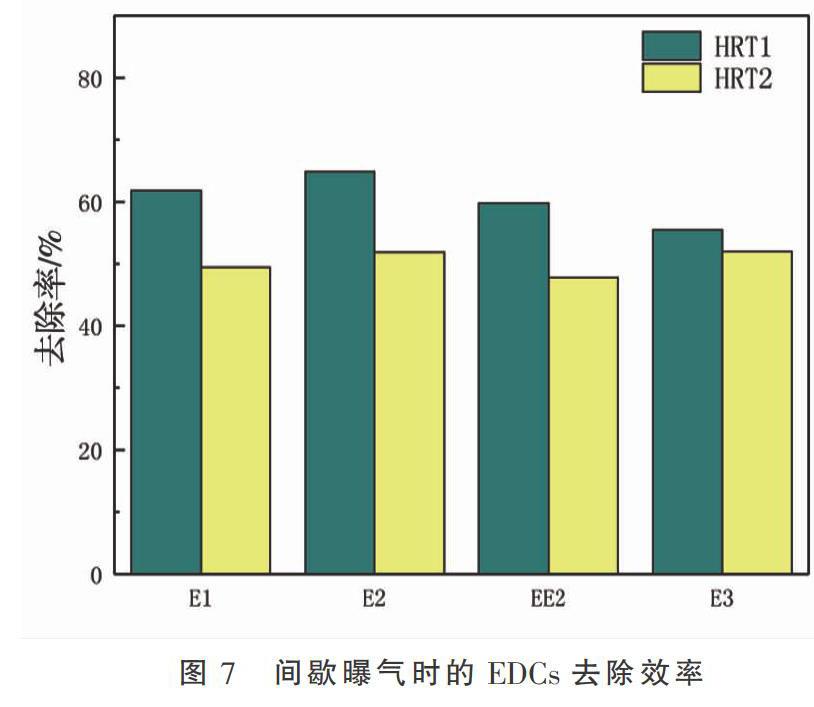
分别考察自然状态、持续曝气和间歇曝气状态下,生态河道装置对EDCs的去除效果,结果如图5、图6和图7所示。
由图5可知,当HRT为9.38 h时,自然状态的生态河道装置中E1的去除率一般,为58.16%;E2去除率最高,为60.41%;E3和EE2的去除率较低,为54.09%和56.37%。当HRT为7.82 h时,自然状态的生态河道装置中E1、E2、E3和EE2去除率分别为46.52%,48.33%,47.85%,45.11%。由于自然状态下生态河道中溶解氧浓度较低,好氧微生物活性较差,因此对EDCs降解效果并不显著。由图6可知,在讨论不同EDCs的去除差异时,2种HRT下的持续曝气生态河道装置对EDCs的去除效果与自然状态下的较相似。HRT1时E1的去除率较高,为63.56%;E2去除率最高,为72.66%;E3和EE2的去除率较低,分别为59.79%,60.58%。HRT2时E1、E2、E3和EE2去除率分别为50.85%,58.12%,54.78%,48.46%。
由图7可知,间歇曝气的生态河道装置对不同EDCs的去除能力由大到小为:E2> E1 > EE2 > E3。由此可见:E1处理效果一般,因为E2较易氧化转化成E1;据任海燕等[21]对EE2降解中间产物进行质谱分析推测可知,EE2在生物降解时会有部分E1产生,这就可能导致E1没有E2降解率高。并且E2拥有亲脂疏水的特性,使得水体中的E2含量较少,相当一部分被吸附在底泥中。E3去除率较低主要原因为:E2在生物降解过程中,部分E2氧化转化成E1,而E1通过水和作用又转化为E3[18]。EE2较难去除,与聂亚峰等[19]在讨论城市污水处理厂中EDCs的行为和归趋时的结论相似,EE2去除率较低,原因是微生物对其降解具有一定的局限性,因为EE2拥有乙炔基,具有空间阻碍作用,使得酶活性表达受阻,且EE2拥有较强的雌情活力[20],在厌氧阶段生物去除EE2时,会使其由结合态变为游离态,难以去除。
2.3 基于EDCs生物降解的生物膜-水生植物生态系统微生物特性分析
经过35 h生物膜-水生植物生态系统处理后,微生物群落门水平发生变化,如图8所示。由该图可以看出相对丰度>1%的仅有4类菌门,分别为Proteobacteria(变形菌门)、Bacteroidetes(拟杆菌门)、Firmicutes(厚壁菌门)和Chloroflexi(绿弯菌门)。其中,变形菌门丰度相比处理之前增加了近13%,厚壁菌门增加了近15.6%,绿弯菌门则减少了近14%。同时微生物群落属水平也发生了变化(见图9),相对丰度>1%的菌门由原来的9类增加到16类,并且菌属类型也发生了改变。其中,变化最大的是Acinetobacter(不动杆菌属),相比处理前增加了9.16%,成为绝对优势菌属。而Hydrogenophaga(氢噬胞菌属)增加了1.6%,Pseudomonas(假单胞菌属)由0.05%增至0.45%,此外,还出现Comamonas(丛毛单胞菌,3.3%)、Proteocatella(1.4%)、Brevundimonas(短波單胞菌属,5.0%)等优势菌属。不动杆菌属、假单胞菌属都是具有硝化反硝化作用的菌属[22],此类微生物不仅能完成有机氮和无机氮的硝化过程,而且均可在缺氧或好氧条件下将亚硝酸根离子或硝酸根离子还原为氮气;丛毛单胞菌可以进行短程硝化、反硝化作用。这表明不动杆菌属、假单胞菌属和丛毛单胞菌等脱氮优势菌属对系统中雌激素的去除起到了促进作用,进一步证实了异养菌对EDCs的去除有显著的强化作用。
3 结 论
(1)在HRT为9.38 h时,E1和E2拥有亲脂疏水的特性,大部分被吸附在底泥中,而EE2在生物降解时会有部分E1产生,其去除率为58.16%; E2去除率最高,为60.41%;E3为E1和E2分解时的中间产物,因此其去除率较低,仅为54.09%;EE2拥有乙炔基且雌情活力较强,使其难以降解,去除率为56.73%。在HRT为7.82 h时,EDCs去除效果较差,E1、E2、E3、EE2去除率分别为46.52%,48.33%,47.85%,45.11%。
(2)在模拟自然状态、间歇曝气、持续曝气3种状态中,持续曝气使得水体中的活性污泥较多,活性污泥具有松散、比表面积大的特点,导致活性污泥对EDCs的吸附量较多,当HRT为9.38 h时,E1、E2、E3和EE2去除率分别为63.56%、72.66%、59.79%、60.58%。比自然状态和间歇曝气对EDCs去除效果更好。
(3)对EDCs生物降解的微生物特性分析表明,不动杆菌属增加了9.16%、假单胞菌属增加了0.4%,并出现了丛毛单胞菌(3.3%)、短波单胞菌属(5.0%)等优势菌属,这些菌属都具有硝化、反硝化作用,表明这些脱氮优势菌属对系统中雌激素的去除起到了促进作用,进一步证实了异养菌对EDCs的去除有显著的强化作用。
参考文献:
[1]汤嘉骏, 刘昕宇, 詹志薇. 流溪河水体有机氯农药的生态风险评价[J]. 环境科学学报, 2014, 34(10): 2709-2717.
[2]钟卓, 解启来. 流溪河水体中14种药物和个人护理品的生态风险评价[J]. 广东化工, 2015, 42(15): 58-59,42.
[3]纪国林, 汤润芝, 周新程, 等. 黑臭静脉支浜生态修复工程设计及工程示范[J]. 湖北农业科学, 2019, 58(11): 112-117.
[4]孙翠霞, 王成琴. 色谱法测定农产品有机氯残留农药[J]. 食品安全导刊, 2018(9): 106.
[5]史熊杰, 刘春生, 余珂, 等. 环境内分泌干扰物毒理学研究[J]. 化学进展, 2017. 21(2): 340-349.
[6]吴航利, 王佳, 管融资, 等. 内分泌干扰物对水生动物的生殖生理毒性研究进展[J]. 延安大学学报(自然科学版), 2019(2): 103-107.
[7]CAO Q, YU Q, CONNELL D W. Fate simulation and risk assessment of endocrine disrupting chemicals in a reservoir receiving recycled wastewater[J]. Science of the total environment, 2010, 408(24): 6243-6250.
[8]VAJDA A M, BARBER L B, GRAY J L, et al. Reproductive Disruption in Fish Downstream from an Estrogenic Wastewater Effluent[J]. Environmental Science & Technology, 2018, 42(9): 3407-3414.
[9]KIDD K A, BLANCHFIELD P J, MILLS K H, et al. Collapse of a fish population after exposure to a synthetic estrogen[J]. Proc Natl Acad Sci USA, 2017, 104(21): 8897-8901.
[10]SUN Y, HUANG H, SUN Y, et al. Ecological risk of estrogenic endocrine disrupting chemicals in sewage plant effluent and reclaimed water[J]. Environmental Pollution, 2013, 180(3): 339-344.
[11]蔡庆庆, 高志伟, 吴旭鹏, 等. 曝气生物滤池预处理微污染水源水试验研究[J]. 土木建筑与环境工程, 2018, 40(5): 147-154.
[12]石岩. 气相色谱法测定茶鲜叶中有机氯和拟除虫菊酯类农药残留[D]. 泰安:山东农业大学, 2016.
[13]BIN H, XIAOMAN L, WENWEN S, et al. Occurrence, removal, and fate of progestogens, androgens, estrogens, and phenols in six sewage treatment plants around Dianchi Lake in China[J]. Environ Sci Pollut Res Int, 2014, 21(22): 12898-12908.
[14]GUANG-GUO Y. Occurrence and fate of hormone steroids in the environment[J]. Environment International, 2012, 6(28): 545-551.
[15]任海燕, 紀淑兰, 崔成武, 等. 鞘氨醇杆菌(Sphingobacterium sp.)JCR5降解17α-乙炔基雌二醇的代谢途径[J]. 环境科学, 2016, 27(9): 1835-1840.
[16]JIANGHONG S, SAORI F, SATOSHI N, et al. Biodegradation of natural and synthetic estrogens by nitrifying activated sludge and ammonia-oxidizing bacterium Nitrosomonas europaea[J]. Water Research, 2004, 38(9): 2323-2330.
[17]Thouennon Erwan, Delfosse Vanessa, Bailly Rémy, et al. Insights into the activation mechanism of human estrogen-related receptor γ by environmental endocrine disruptors[J]. Cellular and molecular life sciences: CMLS, 2019.
[18]Baronti C. Monitoring natural and synthetic estrogens at activated sludge sewage treatment plants and in a receiving river water[J]. Environ. Sci. Technol, 2000, 34(24):5059-5066.
[19]聂亚峰,强志民,张鹤清,等.内分泌干扰物在城市污水处理厂中的行为和归趋: 综述[J]. 环境科学学报, 2011, 31(7): 1352-1362.
[20]杨莹, 刘秀红, 王洪臣, 等. 污水中17α-乙炔基雌二醇的去除及其机理研究进展[J]. 水处理技术, 2016, (5): 45-50,59.
[21]KHUNJAR W O, MACKINTOSH S A, SKOTNICKA-
PITAK J, et al. Elucidating the relative roles of ammonia oxidizing and heterotrophic bacteria during the biotransformation of 17α-Ethinylestradiol and Trimethoprim[J]. Environmental Science & Technology, 2011, 45(8): 3605-3612.
[22]陈栋, 毕学军. 类固醇雌激素在活性污泥系统中去除研究进展[J]. 青岛理工大学学报, 2014, 35(4): 76-82.
收稿日期:2020-03-10
基金项目:水体污染控制与治理科技重大专项(2017ZX07202-004)
作者简介:梁路(1995—),男,甘肃天水人,在读硕士生,主要从事水污染控制与生态修复研究。
通讯作者简介:张文艺(1968—),男,安徽池州人,博士,教授,主要从事水污染控制与生态修复研究。

