二苯乙烯苷对AD模型小鼠Tau蛋白Thr205和Ser404位点磷酸化的影响
吴文雪 苏彦兆 刘超宇 蒙婉莹 李振中 黄健 朱晓莹 廖艳花 黄忠仕

摘 要 目的:研究二苯乙烯苷(TSG)對阿尔茨海默病(AD)模型小鼠Tau蛋白Thr205、Ser404位点磷酸化的影响,探索TSG抗AD的可能机制。方法:将APP/PS1/Tau三转基因痴呆(3×Tg-AD)小鼠随机分成模型组、阳性对照组(石杉碱甲,0.15 mg/kg)和TSG 低、中、高剂量组(0.033、0.1、0.3 g/kg),每组6只;另取6只C57BL/6J小鼠作为正常对照组。各给药组小鼠灌胃相应药物,模型组和正常对照组小鼠灌胃等体积生理盐水,每天给药1次,连续给药60 d。末次给药结束后,采用免疫荧光染色法检测各组小鼠脑组织中Tau蛋白和磷酸化Tau蛋白(Thr205、Ser404位点)的分布和表达;采用Western blotting法检测各组小鼠脑组织中磷酸化Tau蛋白(Thr205、Ser404位点)的表达水平。结果:与正常对照组比较,模型组小鼠脑组织中Tau蛋白和磷酸化Tau蛋白(Thr205、Ser404位点)表达增多、容易聚集成团、分布更为广泛,相对表达量均显著升高(P<0.01),且Western blotting结果显示磷酸化Tau蛋白(Thr205、Ser404位点)的表达水平显著升高(P<0.01);与模型组比较,阳性对照组和TSG各剂量给药组小鼠脑组织中Tau蛋白和磷酸化Tau蛋白(Thr205、Ser404位点)表达和聚集减少、分布范围变窄,相对表达量均显著降低(P<0.01),且Western blotting结果显示磷酸化Tau蛋白(Thr205、Ser404位点)的表达水平也显著降低(P<0.01);与阳性对照组比较,TSG各剂量给药组小鼠脑组织中Tau蛋白和磷酸化Tau蛋白(Thr205、Ser404位点)的分布情况差别不大,相对表达量差异均无统计学意义(P>0.05),但Western blotting结果显示TSG中、高剂量组小鼠脑组织中磷酸化Tau蛋白(Thr205位点)的表达水平和TSG各剂量组小鼠脑组织中磷酸化Tau蛋白(Ser404位点)的表达水平均显著降低(P<0.05或P<0.01)。结论:TSG可能通过下调脑组织中磷酸化Tau蛋白(Thr205、Ser404位点)的表达,从而发挥其对AD模型小鼠的抗痴呆作用。
关键词 阿尔茨海默病;二苯乙烯苷;3×Tg-AD小鼠;Tau蛋白;磷酸化;Thr205位点;Ser404位点
ABSTRACT OBJECTIVE: To study the effects of stilbene glycosidec (TSG) on phosphorylation of Thr205,Ser404 sites of Tau protein in Aizheimers disease (AD) model mice, and to investigate the potential anti-AD mechanism of TSG. METHODS: APP/PS1/Tau three transgenes (3×Tg-AD) mice were randomly divided into model group, positive control group(huperzine, 0.15 mg/kg), TSG low-dose, medium-dose and high-dose groups(0.033, 0.1, 0.3 g/kg), with 6 mice in each group. In addition, 6 C57BL/6J mice were chosen as normal control group. Administration groups were given relevant medicine intragastrically. Model group and normal control group were given equal volume of normal saline intragastrically, once a day, for consecutive 60 days. After last medication, immunofluorescence staining was used to detect Tau protein and phosphorylated Tau protein (Thr205, Ser404 sites) distribution and expression in brain tissue of mice in each group. Western blotting assay was used to detect phosphorylated Tau protein (Thr205, Ser404 sites) expression level in brain tissue of mice in each group. RESULTS: Compared with normal control group, the expression of Tau protein, phosphorylated Tau protein (Thr205, Ser404 sites) in the brain tissue of mice were increased in model group, which were easy to aggregate and distributed more widely; their relative expression were increased significantly (P<0.01). Results of Western blotting assay showed that the expression levels of phosphorylated Tau protein (Thr205, Ser404 sites) were increased significantly (P<0.01). Compared with model group, the expression of Tau protein, phosphorylated Tau protein (Thr205, Ser404 sites) in the brain tissue of mice were decreased in positive control group and TSG groups; aggregation decreased, distribution narrowed and their relative expression were decreased significantly (P<0.01). Results of Western blotting assay showed that the expression levels of phosphorylated Tau protein (Thr205, Ser404 sites) were decreased significantly (P<0.01). Compared with positive control group, There was no significant difference in the distribution of Tau protein, phosphorylated Tau protein (Thr205, Ser404 sites) in the brain tissue of mice in TSG groups; the relative expression were not statistically significant (P>0.05); but Western blotting assay showed the expression levels of phosphorylated Tau protein (Thr205 site) in TSG medium-dose and high-dose groups as well as the expression levels of phosphorylated Tau protein (Ser404 site) in TSG groups were decreased significantly (P<0.05 or P<0.01). CONCLUSIONS:TSG can play an anti-AD effect on AD model mice by down-regulating the expression of phosphorylated Tau protein (Thr205, Ser404 sites) in brain tissue.
KEYWORDS Alzheimers disease; Stilbene glycoside; 3×Tg-AD mice; Tau protein; Phosphorylation; Thr205 site; Ser404 site
阿尔茨海默病(Alzheimers disease,AD)也称老年痴呆,是一种常见的不可逆转的中枢神经退行性疾病[1]。《2018年世界阿尔茨海默病报告》指出:AD在全球的患病人数已达5 000万,而且还在全球以每3秒就产生1名患者的速度不断增加;预计到2030年,仅用于治疗AD的总花费就将高达2万亿美元。然而,AD作为全球卫生医疗亟待攻克的一个重大疾病,其发病机制仍未完全阐释清楚,目前暂无药物可以有效预防或根治该病[2-3]。Tau蛋白是一种重要的微管相关蛋白,其主要生理功能是促进微管的组装与结合,以及参与神经元极性的建立和维持[4]。越来越多的研究指出,Tau蛋白多个位点的异常磷酸化是介导AD患者认知障碍的关键原因,其中主要的位点包括Thr205、Ser404等[5-7]。
二苯乙烯苷(TSG)是从何首乌中提取的一种重要化合物,具有抗衰老、神经保护等药理功效[8]。多项研究指出,TSG能一定程度减少AD模型小鼠β-淀粉样蛋白产生和神经元凋亡,增加其突触可塑性,从而改善AD模型小鼠的认知与记忆能力,起到神经保护的作用[9-10]。本课题组前期研究发现,TSG能够通过抑制AD发病关键蛋白——Tau蛋白相关位点的磷酸化水平,从而达到保护AD模型细胞的作用[11]。本研究拟在前期研究的基础上,选择高表达Tau基因P301L位点突变的APP/PS1/Tau三转基因痴呆(3×Tg-AD)小鼠作为研究对象,开展TSG对3×Tg-AD小鼠脑组织中Tau蛋白磷酸化(Thr205、Ser404位点)影响的体内研究,进一步探索该药物抗AD的可能机制。
1 材料
1.1 仪器
CM1650型冷冻切片机(德国Leica公司);D1MI- 3000B型荧光倒置显微镜[徕卡显微系统(上海)贸易有限公司];Neofuge15R型高速冷冻离心机(上海力康生物医疗科技控股有限公司);ME204E型电子天平[梅特勒-托利多仪器(上海)有限公司];SpactraMax i3x型多功能酶标仪(美国Molecular Devices公司);Tanon-5200 multi型全自动化学发光图像分析仪(广州誉维生物科技仪器有限公司)。
1.2 药品与试剂
TSG(成都克洛玛生物科技有限公司,批号:CHB180810,含量:≥70%);石杉碱甲片(辰欣药业股份有限公司,批号:191211202,规格:50 μg/片);高效RIPA组织/细胞快速裂解液(美国MedChemExpress公司,批号:20190622);磷酸蛋白酶抑制剂(北京康为世纪生物科技有限公司,批号:01385/30429);苯甲基磺酰氟(PMSF,批号:20190926)、牛血清白蛋白(BSA,批号:20200605)均购自北京索莱宝科技有限公司;兔抗小鼠Tau蛋白多克隆抗体(批号:0083660)、辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗(批号:20000174)均购自美国Proteinech Group公司;兔抗小鼠磷酸化Tau蛋白(Thr205位点)多克隆抗体(批号:2001242)、兔抗小鼠磷酸化Tau蛋白(Ser404位点)多克隆抗体(批号:SG255476)均购自美国Invitrogen公司;10%PAGE凝胶快速制备试剂盒(批号:02431400)、Omini-ECLTM超灵敏感化学发光检测试剂盒(批号:02391063)、二喹啉甲酸(BCA)蛋白定量试剂盒(批号:013B1050)、5×蛋白快速封闭液(批号:0141189)均购自上海雅酶生物科技有限公司;Alexa Fluor 594标记的山羊抗小鼠IgG (H+L)高交叉吸附二抗(批号:S0006)、DAPI染料(批号:1387190)均购自美国Thermo Fisher Scientific公司;其余试剂均为分析纯或实验室常用规格,水为蒸馏水。
1.3 动物
本研究使用的动物包括高表达Tau基因P301L位点突变的APP/PS1/Tau三转基因痴呆(3×Tg-AD)小鼠和遗传背景相近的C57BL/6J小鼠两种品系,均为雄性、SPF级。3×Tg-AD小鼠购自美国杰克逊实验室(健康证书编号:1611A18008),6周龄,体质量为(25.02±0.20) g,共36只;C57BL/6J小鼠购自长沙市天勤生物技术有限公司[生产许可证编号:SCXK(湘)2016-0011],6周龄,体质量为(25.20±0.16) g,共6只。所有小鼠购回后均饲养于右江民族医学院SPF级动物实验中心(环境为相对湿度55%~75%,温度20~25 ℃),饲养至8月龄时开始用于实验。本研究已通过右江民族医学院伦理委员会的审批,实验过程中对动物的处置均满足科学技术部颁发的《关于善待实验动物的指导性意见》和《实验动物管理條例》要求。
2 方法
2.1 分组与给药
将36只3×Tg-AD小鼠采用随机数字生成法分为模型组、阳性对照组(石杉碱甲,0.15 mg/kg)和TSG低、中、高剂量组(0.033、0.1、0.3 g/kg),每组6只;再另取C57BL/6J小鼠6 只作为正常对照组。各给药组小鼠灌胃相应药物(以水为溶剂对TSG和石杉碱甲进行溶解),模型组、正常对照组小鼠灌胃等体积生理盐水,灌胃体积均为10 mL/kg,每天给药1次,连续给药60 d。TSG及石杉碱甲的给药剂量和给药方式均参考本课题组前期已发表文献[9]设置。
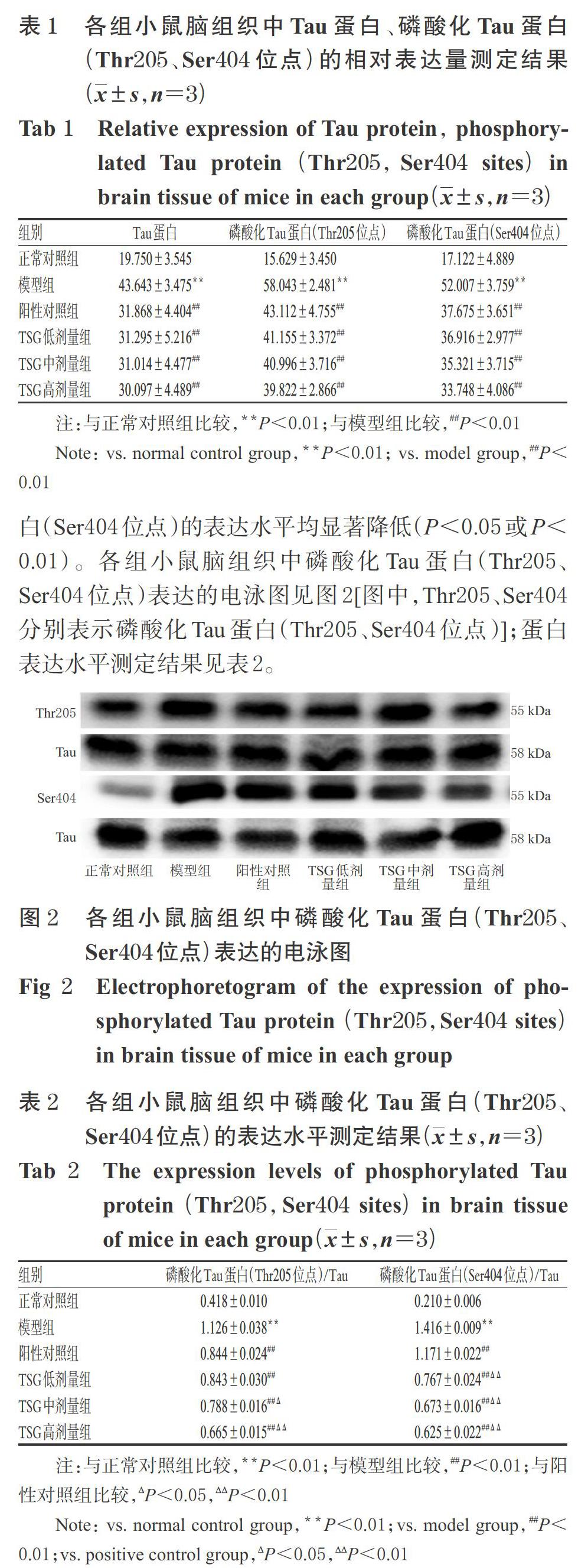
2.2 小鼠脑组织中Tau蛋白、磷酸化Tau蛋白(Thr205、Ser404位点)的分布与表达情况检测
Tau蛋白由位于人類17号染色体长臂2区1带3亚带1次亚带(17q21.31)上的微管相关Tau蛋白(Microtubule Associated Protein Tau,MAPT)基因编码,是一种重要的微管相关蛋白,主要表达于机体大脑组织[4]。Tau蛋白的主要生理功能是促进微管的组装与结合,以及参与神经元极性的建立和维持[4]。当机体出现病态,如MAPT基因水平发生突变,翻译得到功能异常的Tau蛋白可参与AD、额颞痴呆、质基底变性和进行性核上性麻痹等多种神经退行性疾病的发生、进展;如Tau蛋白的翻译后修饰出现磷酸化、糖基化和截断等异常水平问题,同样可参与到AD、额颞痴呆等多种神经退行性疾病的发生、进展中[17-18]。作为AD的一个主要病理特征变化,Tau蛋白过度磷酸化不仅影响轴突的运输功能,而且会破坏神经元骨架系统,引起神经元毒性及死亡,导致严重的认知功能障碍[19]。Tau蛋白包括N端区域、富含脯氨酸的结构区域、微管结合结构区域和C末端区域4个主体结构,每个结构都赋予了Tau蛋白不同的功能[20]。C末端结构域和富含脯氨酸结构域是Tau蛋白的两个离散结构域,其主要通过逐步调控结构域相关位点的磷酸化水平参与突触的认知障碍:首先,C末端结构域中Ser404位点的磷酸化介导Tau蛋白错误定位到树突棘,随后介导富含脯氨酸的区域中Thr205位点的磷酸化,共同导致AMPA(α-氨基-3-羟基-5-甲基-4-异恶唑丙酸)受体数量减少,引起突触后功能缺陷[5]。Chukwu JE等[7]的研究指出,与Tau蛋白其他位点磷酸化改变水平相比,磷酸化Tau蛋白(Ser404位点)在AD病变组织中的水平改变是非常明显的(即具有突出性),故该位点作为理想的治疗靶点而备受关注;而磷酸化Tau蛋白(Thr205位点)在指导AD的Braak分级系统中起着举足轻重的作用,研究表明磷酸化Tau蛋白(Thr205位点)在中晚期Braak分级系统显著升高与AD机体的颞叶、额叶、扣带和枕叶皮层等之间均具有很强的关联[21]。
Thr205、Ser404作为Tau蛋白过度磷酸化的两个关键位点,在动物水平上研究TSG对二者的影响具有重要意义。相关文献表明,植物来源的乙酰胆碱酯酶抑制剂石杉碱甲已成为我国当前临床治疗AD的主流药物之一[22],因此本研究选择同是提取于传统中药材的石杉碱甲作为本研究的阳性对照药物。结果发现,模型组小鼠脑组织中Tau蛋白、磷酸化Tau蛋白(Thr205、Ser404位点)容易聚集成团、分布较广泛,磷酸化Tau蛋白(Thr205、Ser404位点)的表达水平也显著升高;而给予不同剂量TSG处理后,小鼠脑组织中Tau蛋白、磷酸化Tau蛋白(Thr205、Ser404位点)的表达和聚集均减少、分布范围均变窄,磷酸化Tau蛋白(Thr205、Ser404位点)的表达水平也均显著降低。该结果与Yan D等[23]的研究结果一致,这也进一步提示降低小鼠脑组织中Tau蛋白(Thr205、Ser404位点)磷酸化水平可能是TSG发挥抗痴呆作用的机制之一。
综上所述,TSG可能通过下调脑组织中磷酸化Tau蛋白(Thr205、Ser404位点)的表达,进而发挥其对3×Tg-AD小鼠的抗痴呆作用。然而,本研究还有一定的不足之处,如未能将小鼠按性别、年龄等不同分层次给药等,在未来的研究中笔者将进一步考虑这些因素的影响。
参考文献
[ 1 ] VASIC V,BARTH K,SCHMIDT MHH. Neurodegeneration and neuro-regeneration-Alzheimers disease and stem cell therapy[J]. Int J Mol Sci,2019. DOI:10.3390/ijms20174272.
[ 2 ] JOE E,RINGMAN JM. Cognitive symptoms of Alzhei- mers disease clinical management and prevention[J]. BMJ,2019. DOI:10.1136 /bmj.l6217.
[ 3 ] LOERA-VALENCIA R,CEDAZO-MINGUEZ A,KENI- GSBERG PA,et al. Current and emerging avenues for Alzheimers disease drug targets[J]. J Intern Med,2019,286(4):398-437.
[ 4 ] GUO T,NOBLE W,HANGER DP. Roles of tau protein in health and disease[J]. Acta Neuropathol,2017,133(5):665-704.
[ 5 ] ERAVSKIS PJ,OXNARD BR,MILLER EC,et al. Phosphorylation in two discrete tau domains regulates a stepwise process leading to postsynaptic dysfunction[J]. J Physiol,2019. DOI:10.1113/JP277459.
[ 6 ] NEDDENS J,TEMMEL M,FLUNKERT S,et al. Phosphorylation of different tau sites during progression of Alzheimers disease[J]. Acta Neuropathol Commun,2018.DOI:10.1186/s40478-018-0557-6.
[ 7 ] CHUKWU JE,CONGDON EE,SIGURDSSON EM,et al. Structural characterization of monoclonal antibodies targeting C-terminal Ser404 region of phosphorylated tau protein[J]. MAbs,2019,11(3):477-488.
[ 8 ] 赵明宇.何首乌化学成分和药理作用[J].北方药学,2018,15(3):192-193.
[ 9 ] 刘宁,廖艳花,赖术,等.二苯乙烯苷对淀粉样前体蛋白/早老蛋白-1双转基因小鼠脑组织半胱氨酸天冬氨酸蛋白酶3和淀粉样前体蛋白表达的影响[J].中国全科医学,2017,20(15):1854-1859.
[10] 黄蕊,杨翠翠,张兰.二苯乙烯苷对APP/PS1双转基因小鼠学习记忆及突触可塑性的影响[J].神经药理学报,2018,8(2):30-31.
[11] 谭俊杰,吴文雪,廖艳花,等.二苯乙烯苷对冈田酸致NG108-15细胞Tau蛋白磷酸化的影响[J].中国药房,2019,30(18):2485-2490.
[12] HELVIK AS,SELB[?]K G,?ALTYT? BENTH J,et al. The course of neuropsychiatric symptoms in nursing home residents from admission to 30-month follow-up[J]. PLoS One,2018. DOI:10.1371/journal.pone.0206147.
[13] LANE CA,HARDY J,SCHOTT JM. Alzheimers disease[J]. Eur J Neurol,2018,25(1):59-70.
[14] CHANDRA A,VALKIMADI PE,PAGANO G,et al. Applications of amyloid,tau,and neuroinflammation PET imaging to Alzheimers disease and mild cognitive impairment[J]. Hum Brain Mapp,2019,40(18):5424-5442.
[15] MAMUN AA,UDDIN MS,MATHEW B,et al. Toxic tau:structural origins of tau aggregation in Alzheimers disease [J]. Neural Regen Res,2020,15(8):1417-1420.
[16] KAMETANI F,HASEGAWA M. Reconsideration of amyloid hypothesis and tau hypothesis in Alzheimers di- sease[J]. Front Neurosci,2018. DOI:10.3389/fnins.2018. 00025.
[17] STRANG KH,GOLDE TE,GIASSON BI. MAPT mutations,tauopathy,and mechanisms of neurodegeneration[J]. Lab Invest,2019,99(7):912-928.
[18] GUO T,NOBLE W,HANGER DP. Roles of tau protein in health and disease[J]. Acta Neuropathol,2017,133(5):665-704.
[19] COMBS B,MUELLER RL,MORFINI G,et al. Tau and axonal transport misregulation in tauopathies[J]. Adv Exp Med Biol,2019. DOI:10.1007/978-981-32-9358-7.
[20] LIPPENS G,GIGANT B. Elucidating Tau function and dysfunction in the era of cryo-EM [J]. J Biol Chem,2019,264(24):9316-9325.
[21] NEDDENS J,DAURER M,FLUNKERT S,et al. Correlation of pyroglutamate amyloid β and p-tau Ser202/ Thr205 levels in Alzheimers disease and related murine models[J]. PLoS One,2020. DOI:10.1371/journal.pone. 0235543.
[22] 謝峻,张静怡,汤宁,等.加兰他敏和石杉碱甲生物合成的研究进展[J].中草药,2020,51(3):812-820.
[23] YAN D,YAO J,LIU Y,ZHANG X,et al. Tau hyperphosphorylation and P-CREB reduction are involved in acry- lamide-induced spatial memory impairment:suppression by curcumin[J]. Brain Behav Immun,2018. DOI:10.1016/j.bbi.2018.04.014.
(收稿日期:2020-09-08 修回日期:2020-10-27)
(编辑:林 静)

