空气颗粒物和香烟烟雾提取物对人气道上皮及巨噬细胞的影响
于涛 崔晗 崔烨 刘杰 吕喆 孙英 王炜 杨汀
1中日友好医院呼吸与危重症医学科 国家呼吸疾病临床医学研究中心 中国医学科学院呼吸病学研究所,北京100029;2中国医学科学院北京协和医学院基础医学研究所生理学系100005;3首都医科大学基础医学院免疫学系,北京100069
通信作者:杨汀,Email:dryangting@qq.com
COPD 是一种常见的慢性疾病,其主要特征为持续的呼吸道症状和气流受限,进而引起气道和/或肺泡异常,其发病机制尚未明确,通常认为与暴露于毒性颗粒和气体有关。近年来,愈加严重的空气污染已成为COPD 发生发展的一个重要的因素。空气颗粒物 (particulate matter,PM),尤其是粒子直径≤2.5μm 的颗粒物 (PM2.5),是空气污染物中主要的致病成分。流行病学研究表明,吸烟人群较不吸烟人群更易受空气污染的影响[1]。PM2.5可沉积于肺泡,导致气道免疫应答紊乱,促进肺部炎症产生。由此可见,PM 和吸烟与COPD 的发生发展关系密切,但有关二者共同作用机制的研究较少。
气道上皮细胞和肺泡巨噬细胞是气道抵抗外来致病物质的主要屏障。研究表明,香烟烟雾刺激和PM 均可破坏气道上皮细胞的应答反应,增加感染的风险[2]。巨噬细胞在COPD 中同样具有重要作用。在COPD 患者的气道内,巨噬细胞的数量较正常人增加5~10倍,且其数量和肺气肿严重程度相关[3]。同时,PM 刺激可使巨噬细胞分泌大量促炎因子,诱导局部发生炎症反应[4-5]。尽管有研究表明香烟烟雾和PM 对气道上皮细胞和巨噬细胞的功能均有不同影响,但在相互作用方面尚需进一步探索。鉴于此,本研究通过体外实验探索PM 及香烟烟雾提取物(cigarette-smoke extract,CSE)对上皮细胞和巨噬细胞功能的影响。
1 材料与方法
1.1 细胞 人肺泡上皮细胞系A549细胞、人单核细胞系THP-1细胞购于美国菌种保藏中心。
1.2 主要试剂及仪器 DMEM 高糖培养基、RPMI 1640培养基、青-链霉素和磷酸盐缓冲液购于美国Hyclone公司;胎牛血清购于美国Gibco公司;佛波酯购于美国Sigma公司;PM 为标准参考材料1649b,购于美国国家标准与技术研究院;二甲基亚砜购于美国Sigma公司;CCK-8 试剂购于日本同仁化学研究所;Annexin Ⅴ/PI凋亡试剂购于北京四正柏生物科技有限公司;细胞因子酶联免疫吸附试验试剂盒购于美国Invitrogen 公司;Occludin抗体、ZO-1抗体购于美国Invitrogen公司;Claudin购于美国Abcam 公司;Trizol试剂购于美国Life Technologies公司;荧光二抗购于美国LI-COR 公司。NanoDrop 2000分光光度计、细胞培养箱和生物安全柜购于美国Thermo Fisher Scientific公司;ABI PRISM 7500 PCR 仪器购于美国Applied Biosystems 公司;流式细胞仪BD LSRFortessaTM购于美国BD Biosciences公司;全波长光吸收酶标仪购自Perkin Elmer 公司;Odyssey红外成像系统购自美国LI-COR 公司。
1.3 方法
1.3.1 PM 混悬液制备 在生物安全柜无菌环境下称取PM 标准品200 mg,溶解于1 ml无菌二甲基亚砜中 (作用终浓度为0.1%,一般认为二甲基亚砜≤0.1% 时,不引起细胞生物学性状的改变[6]),持续超声粉碎3 min,分装后4 ℃保存,每次使用前超声3 min。标准参考材料1649b由城市尘埃组成,包括多环芳香烃、硝基多环芳香烃、多氯联苯同源物、农药和二恶英等[7]。
1.3.2 细胞培养 A549细胞用含10%胎牛血清和1%青-链霉素的DMEM 培养基,置于37℃、5%CO2孵箱中常规培养。THP-1细胞用含10%胎牛血清和1%青-链霉素的RPMI 1640 培养基,置于37 ℃、5%CO2孵箱中常规培养。
1.3.3 CSE制备 按之前研究描述的方法[8]制备CSE。使用吸烟机将1根香烟(所用香烟为 “万宝路”,含焦油量10 mg,烟气烟碱量0.8 mg,烟气一氧化碳量11 mg)的烟气吸入10 ml无菌培养基。用0.22μm 滤器过滤制备成100%CSE,于制备后30 min内立即使用。
1.3.4 CCK-8法检测细胞增殖 将A549细胞按5×104/ml的浓度接种至96孔板。将THP-1细胞按5×105/ml的浓度接种至96孔板,加入100μg/L佛波酯诱导分化为THP-1 源性巨噬细胞样细胞。24 h后,弃掉培养基,更换为无血清培养基饥饿12 h,加入不同浓度的PM (25、50、100、200 mg/L )、 CSE (0.2%、 0.5%、 1.0%、2.0%、5.0%)、PM (50 mg/L)+CSE (0.5%)刺激24 h后,向各孔加入10μl CCK-8试剂,在37 ℃、5%CO2孵箱中孵育4 h。用自动酶标仪在450 nm 波长处测定吸光度,细胞增殖活力=吸光度处理组/吸光度空白对照组。
1.3.5 Annexin Ⅴ/PI双标记检测细胞凋亡 将A549细胞按5×104/ml的浓度接种至24孔板。将THP-1细胞按2×105/ml的浓度接种至24孔板,加入佛波酯诱导分化为THP-1 源性巨噬细胞样细胞。24 h后,弃掉培养基,更换为无血清培养基饥饿12 h,加入上述同样刺激物刺激24 h后,收集细胞于1.5 ml离心管内,离心后弃上清加入1×Annexin ⅤBinging Buffer重悬细胞。取100μl于新管内,加入5μl Annexin Ⅴ/Alexa Flour 488室温避光孵育5 min后,加入10μl PI和400μl磷酸盐缓冲液,进行流式检测。
1.3.6 酶联免疫吸附试验检测细胞因子浓度 将A549细胞和THP-1细胞接种至24孔板,按1.3.4方法,加入上述刺激物刺激24 h后,收集细胞上清,按照试剂盒说明检测上清中IL-6、IL-8、IL-1β的浓度。
1.3.7 实时聚合酶链式反应检测巨噬细胞极化标志物 将THP-1细胞按2×106/ml接种至6孔板,加入PM (50 mg/L)、CSE (0.5%)或PM(50 mg/L)+CSE (0.5%)24 h后,弃上清,用Trizol提取细胞总RNA,分光光度计测定其浓度和纯度后,将总RNA 逆转录为cDNA,于ABI PRISM 7500仪器上实施实时聚合酶链式反应检测CD163 mRNA 和CD80 m RNA 的表达水平。引物设计及购买由美国Invitrogen公司提供。以β-actin为内参,采用2-ΔΔCT法分析基因转录水平。引物序列见表1。
1.3.8 免疫印迹法检测紧密连接蛋白表达 将A549细胞以105/ml接种至6 cm 培养皿,加入上述刺激物24 h 后,弃上清,提取细胞总蛋白,用BCA 法测定蛋白浓度。行10%SDS-PAGE凝胶电泳,湿法转膜。5%脱脂奶粉室温封闭1 h,ZO-1一抗(1∶500)、occludin一抗 (1∶100)、claudin一抗(1∶200)、β-actin一抗 (1∶1 000)4 ℃孵育过夜。TBST (0.1% Tween20-TBS)洗3 次,每次10 min。孵育二抗 (1∶10 000)1 h,TBST洗3次后于LI-COR Odyssey红外荧光扫描成像。以ImageJ软件作灰度分析。
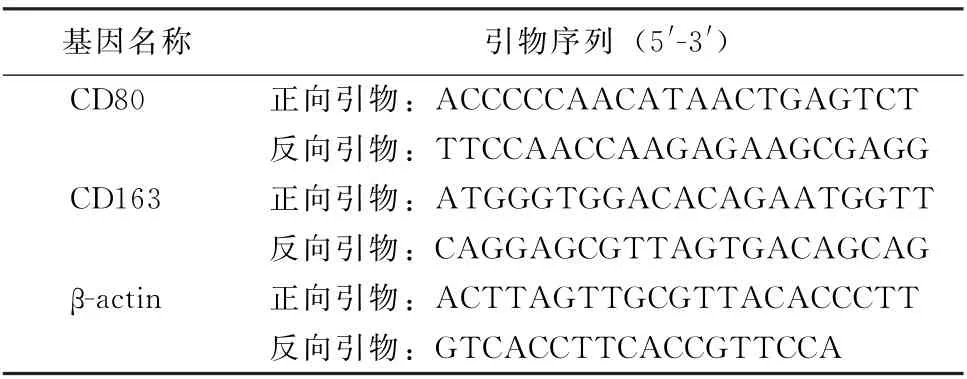
表1 实验所用引物列表
1.4 统计学分析 实验重复3次,使用GraphPad Prism 7.0软件进行分析。所有数据均以x-±s 表示,2组之间采用t 检验进行比较分析,3个或多组间比较行单因素方差分析 (one-way ANOVA)。P <0.05为差异有统计学意义。
2 结果
2.1 PM 与CSE 对A549细胞活性的影响 A549细胞暴露于不同刺激物后,细胞活性如图1、2所示,PM 和CSE 刺激对细胞增殖均呈现出明显的抑制趋势,且呈浓度依赖关系。因PM 浓度在50 mg/L、CSE浓度在0.5%时出现显著差异,故确定该浓度为后续实验刺激浓度。同时,对刺激后的A549细胞进行凋亡检测,结果如图3、4所示,PM 和CSE均可诱导A549细胞发生早期凋亡,且呈现浓度依赖关系。将两者叠加刺激后,如图5、6所示,可见PM 和CSE 单独刺激对细胞活性有明显的影响,PM 与CSE 叠加较单独刺激组能够进一步加重对细胞活性的影响,促进细胞凋亡。
2.2 PM 与CSE 对A549细胞炎症因子分泌的影响 如图7~10所示,暴露于不同浓度的CSE 均可刺激A549细胞产生IL-6 和IL-8;该细胞暴露于PM 24 h后上清中IL-6浓度明显升高,且呈浓度依赖关系,但随着PM 浓度的升高,A549细胞产生IL-8降低。两者叠加刺激后,如图11、12所示,PM 能够加重CSE 诱导的IL-6产生,且与单独暴露于PM 或CSE 组相比差异有统计学意义(P 值均<0.01)。但是对于IL-8的产生,PM 与CSE叠加并无明显作用。
2.3 PM 与CSE 对A549细胞紧密连接蛋白的影响 A549细胞暴露于上述刺激24 h后,检测细胞中ZO-1、occludin、claudin 蛋白的表达。结果如图13所示,PM 主要影响occludin的表达,单独刺激与和CSE 叠加刺激均降低occludin表达,但对ZO-1和claudin未有显著影响。
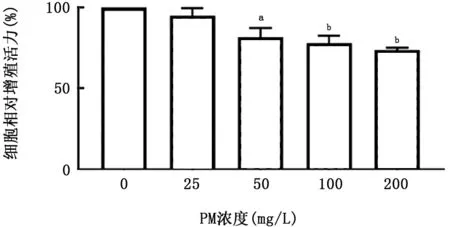
图1 PM 对A549细胞增殖的影响
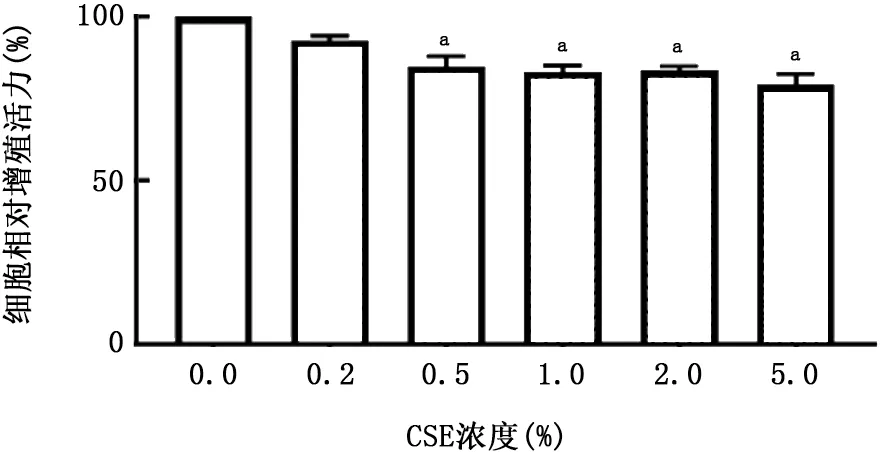
图2 CSE对A549细胞增殖的影响
2.4 PM 与CSE 对THP-1 细胞活性及炎症因子产生的影响 THP-1细胞暴露于上述刺激24 h后可见(图14、15),PM 对降低THP-1衍生的巨噬细胞活性及促进其凋亡的作用强于CSE 的作用,在此方面二者无明显叠加作用。PM 与CSE 单独或叠加均可刺激该细胞产生IL-1β,且PM 的作用亦强于CSE 的作用 (图16);但对于IL-8 而言,二者无明显叠加作用(图17)。
2.5 PM 与CSE 对THP-1 细胞极化的影响 THP-1细胞暴露于上述刺激8 h后发现,PM、CSE以及二者叠加对CD163 m RNA的表达差异无统计学意义 (图18),但PM 可以明显促进CD80 m RNA 的表达,且二者叠加可进一步促进其表达(图19)。
3 讨论
近年来,空气污染已成为导致COPD 发生发展的重要因素之一。流行病学研究表明,空气污染物水平增加会引起COPD 患者肺功能恶化以及发生COPD 急性加重[9]。同时有研究发现,小鼠暴露于PM 出现明显的巨噬细胞和中性粒细胞浸润,且肺功能有显著的下降[10]。但目前大部分研究集中在单独PM对机体的影响,关于PM与吸烟的叠加作用机制研究所知甚少。因此,本研究从PM 与CSE叠加对细胞增殖、凋亡、炎症因子产生以及细胞功能层面进行了探讨。
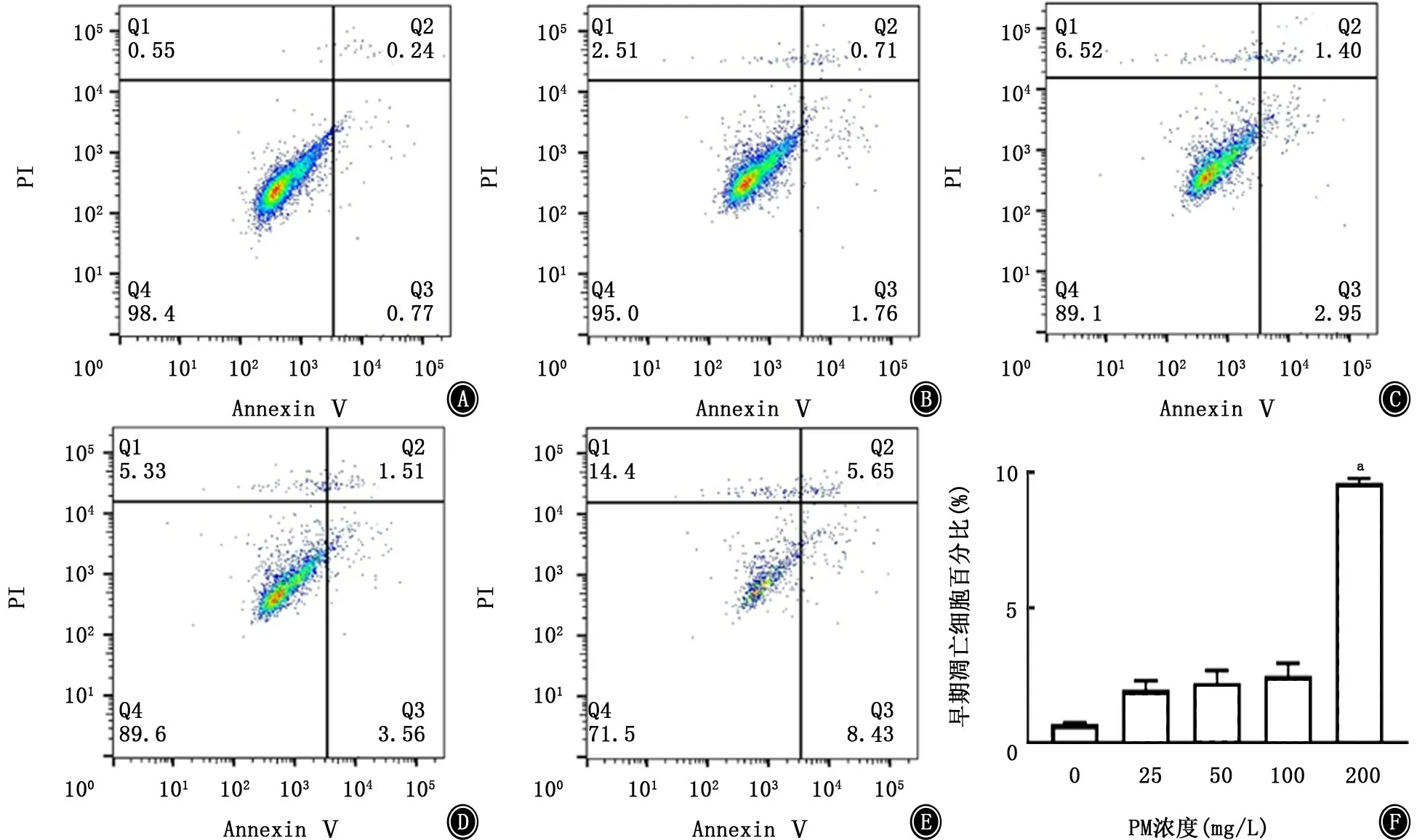
图3 PM 对A549细胞早期凋亡的影响 A:0 mg/L PM;B:25 mg/L PM;C:50 mg/L PM;D:100 mg/L PM;E:200 mg/L PM;F:柱状图
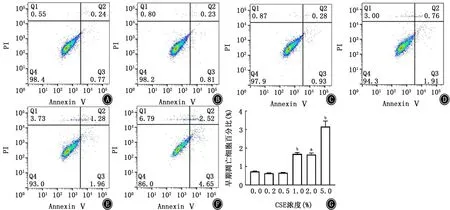
图4 CSE对A549细胞早期凋亡的影响 A:0.0%CSE;B:0.2% CSE;C:0.5% CSE;D:1.0% CSE;E:2.0% CSE;F:5.0%CSE;G:柱状图
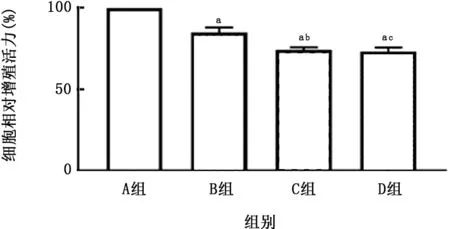
图5 各组A549细胞相对增殖活力的比较
慢性气道及肺泡炎症反应是COPD 的主要病理特征[11],而促炎细胞因子IL-6是判断COPD 预后的生物标志物[12]。有研究表明,PM 能够结合细胞Toll样受体,进而激活核转录因子κB信号通路,导致下游细胞因子IL-6的产生[13]。此外,含有IL-1β的炎性小体是一种多蛋白信号复合物,受外界信号刺激后可导致中性粒细胞炎症,且在COPD 患者中表达增加[14]。本研究发现PM 与CSE叠加可进一步增加A549细胞及THP-1细胞产生IL-6和IL-1β,且二者协同刺激较单独刺激有明显的差异。由此可以推断,这2种刺激可能通过不同的信号通路发挥作用,进而导致促炎细胞因子IL-6、IL-1β产生增加,并促进中性粒细胞等炎症细胞的聚集,促进了COPD 的发生发展。
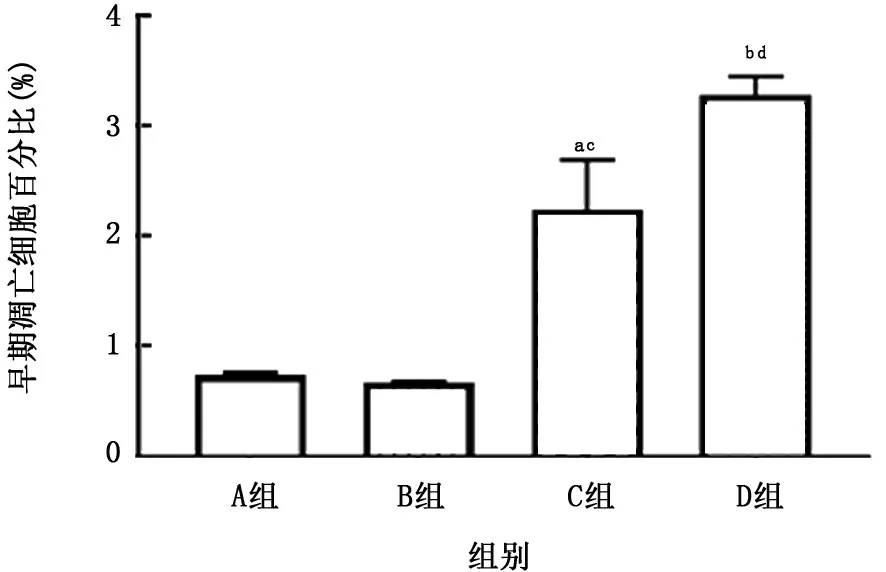
图6 各组A549细胞早期凋亡细胞百分比的比较
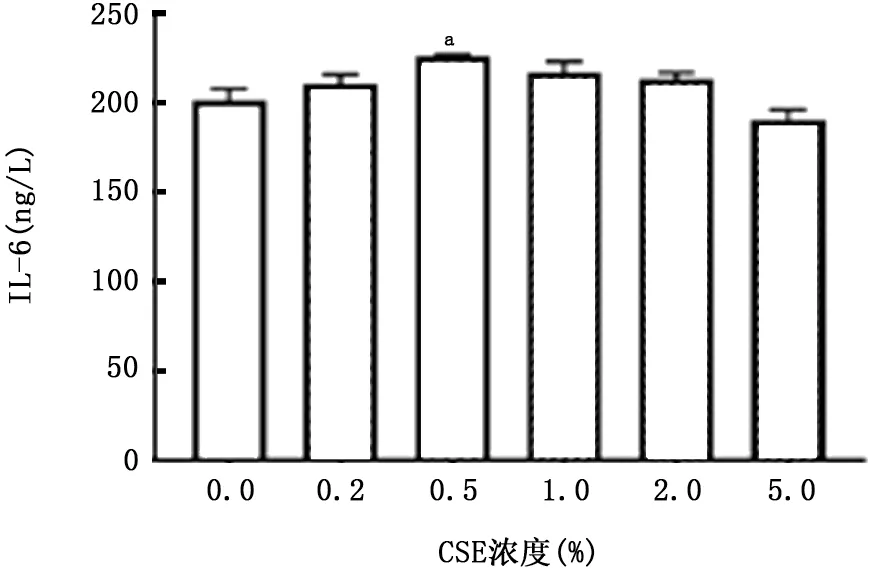
图7 CSE对A549细胞产生IL-6的影响
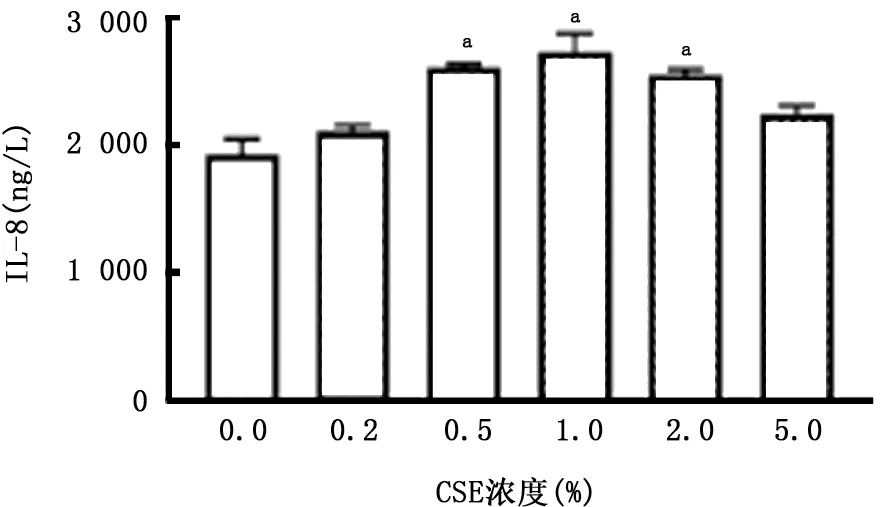
图8 CSE对A549细胞产生IL-8的影响
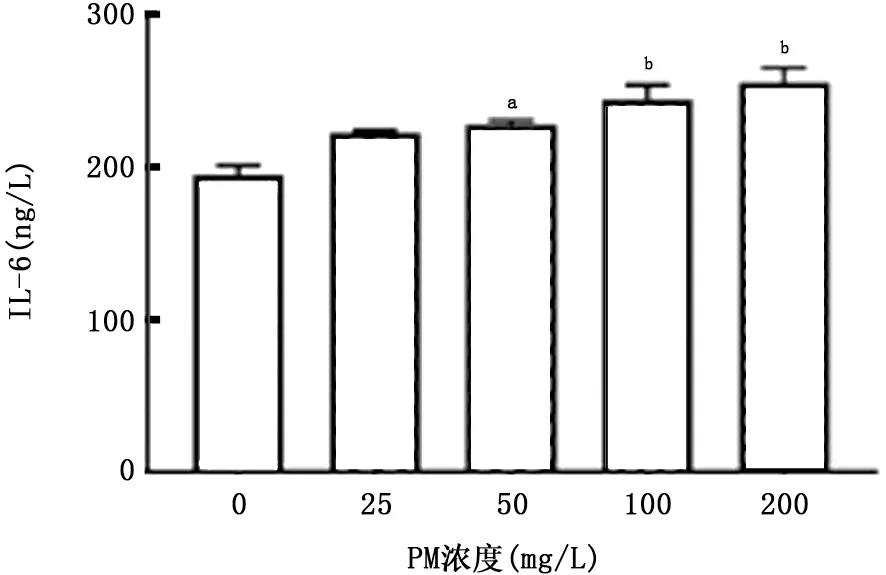
图9 PM 对A549细胞产生IL-6的影响
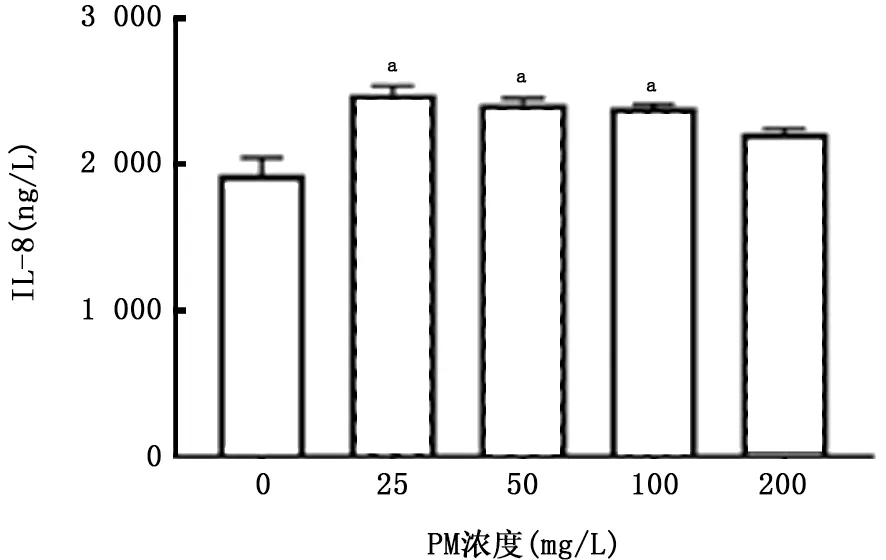
图10 PM 对A549细胞产生IL-8的影响
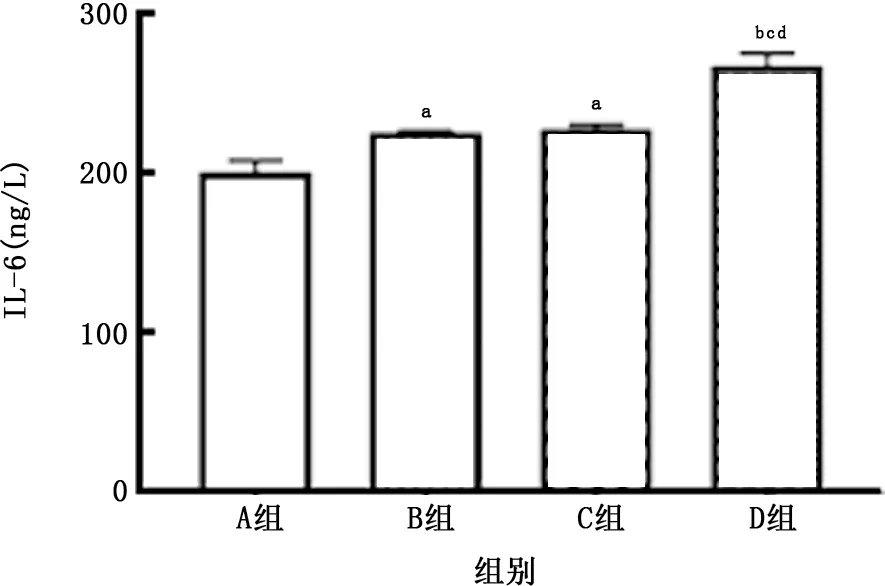
图11 各组A549细胞IL-6水平的比较
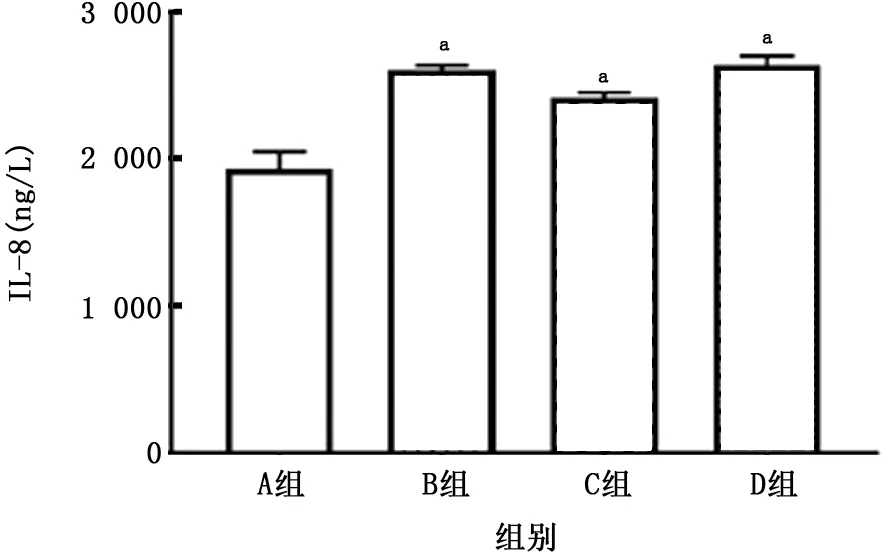
图12 各组A549细胞IL-8水平的比较
紧密连接和ZO 家族可将相邻的肺泡上皮细胞连接在一起,形成一种保护上皮下组织的屏障。有研究表明,PM10能够使occludin 表达降低,进而破坏气道完整性[2]。与该报道一致,本研究发现PM 和CSE 单独暴露均可降低occludin 表达,但二者叠加对该蛋白表达并未产生明显差异。因此二者协同对上皮连接的影响有待于进一步的研究。

图13 各组A549细胞紧密连接蛋白ZO-1、occludin、claudin表达的比较 A:电泳图;B:ZO-1的相对表达;C:occludin的相对表达;D:claudin的相对表达
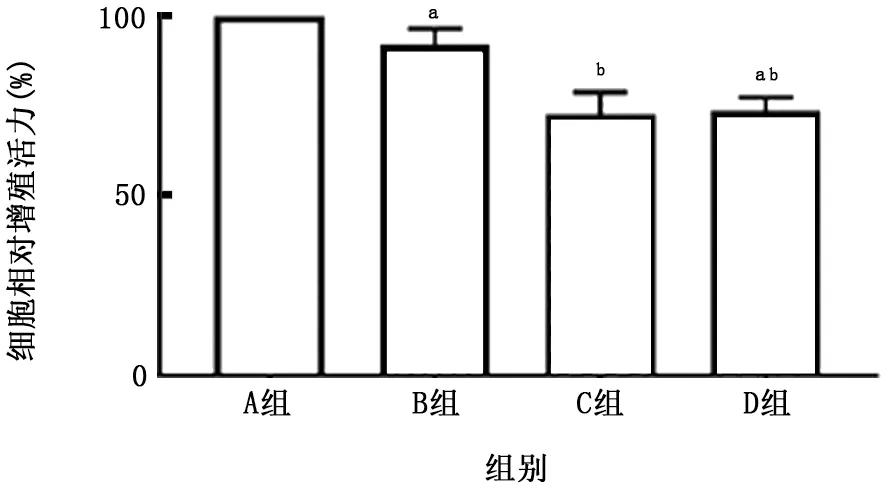
图14 各组THP-1细胞相对增殖活力的比较
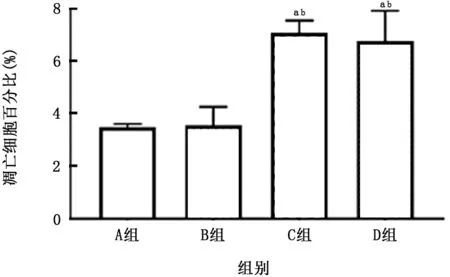
图15 各组THP-1细胞中凋亡细胞百分比的比较
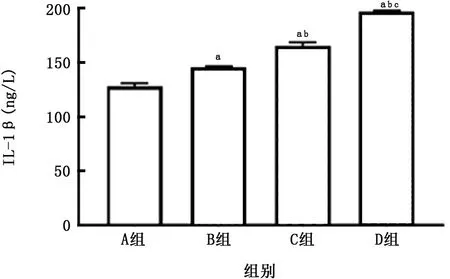
图16 各组THP-1细胞中IL-1β的比较
已知巨噬细胞存在不同的表型,在不同的条件下向不同方向分化且具有不同的生物学功能。Byrne等[15]研究表明,暴露于空气污染物后M1型巨噬细胞分泌的细胞因子IL-12和干扰素γ增多。而Bauer等[16]发现将肺泡巨噬细胞与气道上皮细胞共培养,在臭氧刺激下,巨噬细胞可向M2型分化。本研究发现,PM 与CSE 叠加可以导致巨噬细胞CD80 m RNA 表达增多,且与CSE 单独刺激有明显差异,提示PM 在CSE 基础上,可能进一步刺激巨噬细胞向M1型分化,加重机体炎症反应的产生和肺部损伤。
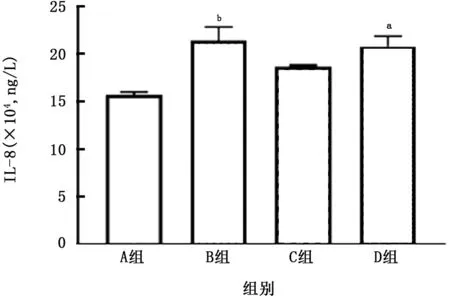
图17 各组THP-1细胞中IL-8的比较
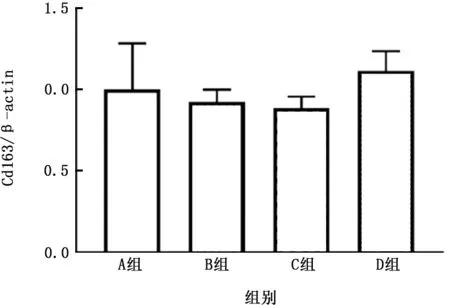
图18 各组THP-1细胞CD163 m RNA 表达的比较
综上所述,通过探索PM 和CSE 叠加对上皮细胞和巨噬细胞的影响,本研究结果提示PM 暴露可增加IL-6和IL-1β产生,并促进巨噬细胞向M1型发生极化,进而加重烟雾暴露导致的炎症反应。本研究为探索空气污染加重COPD 发生发展及制定相应预防措施提供了一定实验依据。
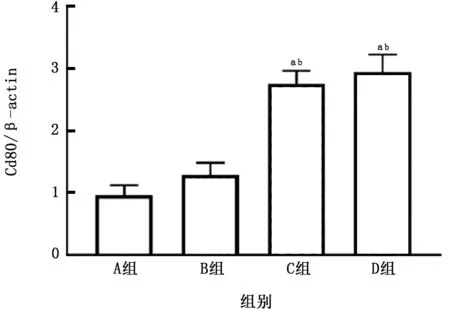
图19 各组THP-1细胞CD80 m RNA 表达的比较
利益冲突所有作者均声明不存在利益冲突

