两种血袋白膜法制备浓缩血小板质量研究
余凤秀, 周载鑫, 沈 秋, 朱燕霞, 钱宝华
(上海长海医院 输血科, 上海, 200433)
血小板是血液的重要成分之一。单采血小板具有耗时长、成本昂贵、创伤较大等缺点,限制了临床血小板的应用[1]。从抗凝全血中制备浓缩血小板可高效利用血液资源,缓解临床血小板紧张状况[2]。传统四联袋分离过程中血浆、白膜层均通过同一管道被挤出血袋,但白膜层在分离过程中易吸附于血袋壁,且分离过程中血小板层与红细胞层易混合,影响回收率与血小板质量。顶底袋在分离过程中首先分出上层血浆,再向下分离出浓缩红细胞,将白膜层完全保留在血袋中,有效保留了血小板层[3]。本研究探讨顶底袋与四联袋对白膜法制备浓缩血小板质量的影响,现报告如下。
1 材料与方法
1.1 一般材料
实验组多联袋为一次性使用塑料血袋(顶底袋型,规格Q200-T, 批号171116 11A, 上海输血技术有限公司); 对照组多联袋为一次性使用塑料血袋(传统型,规格Q200, 批号170828 22A, 上海输血技术有限公司)。一次性使用塑料血袋(四联袋,规格Q400, 批号171226 21A, 上海输血技术有限公司)。
相关设备包括无菌接管机(Terumo 日本)、离心机(Cryofuge6000i 贺利氏,德国)、CompoMatG5全自动血细胞分离机(费森尤斯卡比,德国)、血细胞分析仪(Sysmex XS-500i, 日本)、电子天平(精度0.1 g, 普瑞逊PRIS HF-1500S)、分浆夹(苏州医用仪器厂)。
1.2 方法
① 选择符合健康体检规范、献血前各项检验合格、年龄20~30岁的献血者; ② 采血过程顺畅,采血时间≤7 min,采集全血400 mL; ③采集全血室温静置1 h, 充分混合均匀,使用无菌接管机均分至顶底袋和四联袋(传统型)中,每袋含200 mL全血; ④ 采用CompoMatG5全自动血细胞分离机进行第1次离心(离心力2 096×g, 2 500转/min, 14 min, 22 ℃), 离心后血液分为3层,上层为血浆,中间层为白膜层,下层为浓缩红细胞; ⑤ 采用CompoMatG5全自动血细胞分离机进行第2次离心(离心力 299×g, 900转/min, 10 min, 22 ℃)。
顶底袋制备浓缩血小板: 采集全血400 mL, 应用无菌接管机均分200 mL全血至顶底袋中,进行第1次离心(离心力 2 096×g, 2 500转/min, 14 min, 22 ℃), 制备白膜层。实验组将顶底袋中200 mL全血置于G5全自动血液成分分离机相应位置,采用电动挤压方式,利用精密探头、热合探测阀门、白膜层制备浓缩血小板程序(全程操作均为电脑设置程序,按照制备要求控制时间和量以及开关止流夹等)。折断联袋连接各管道折芯,挤压板分别向上挤压出上层血浆,在距离白膜层1.5 cm处停止挤压,再向下挤压出浓缩红细胞,距离白膜层1.0 cm处停止挤压,关闭红细胞悬液袋上端,挤出约120 mL浓缩红细胞并与红细胞保存袋中保存液混合制备成红细胞悬液。中间富含血小板的白膜层完全留在顶底袋中,室温下静置2 h, 使血小板与白细胞自然解聚。再经过第2次离心(离心力299×g, 900转/min, 10 min, 22 ℃), 采用手工挤压板分离上层富含血小板血浆约30 mL, 去除残留红细胞、白细胞。
四联袋制备浓缩血小板: 采集全血400 mL, 应用无菌接管机均分200 mL全血至四联袋(传统型)进行第1次离心(离心力 2 096×g, 2 500转/min, 时间14分钟, 22 ℃), 制备白膜层。对照组: 四联袋中200 mL全血置于G5全自动血液成分分离机相应位置,采用电动挤压方式,利用精密探头、热合探测阀门、白膜法制备浓缩血小板程序(全程操作均为电脑设置程序按照制备要求控制时间和量以及开关止流夹等)。折断联袋连接各管道折芯,挤压板向上挤压出上层血浆,在距离白膜层1.5 cm处停止挤压,关闭血浆袋上端,将距离白膜1.5 cm处血浆连同白膜层一起挤压到白膜层袋中。将红细胞保存袋中添加剂挤压到主袋(红细胞悬液中)。热合并取下白膜层袋,室温下静置2 h, 使血小板与白细胞自然解聚。经过第2次轻离心(离心力299×g, 900转/min, 10 min, 温度22 ℃), 采用手工挤压板分离上层富含血小板血浆约30 mL, 去除残留红细胞、白细胞等。
1.3 统计学分析
血液中各成分含量采用血细胞计数仪(Sysmex XS-500i)分析; 数据统计分析采用SPSS 19.0软件进行分析,计量资料采用方差分析,计量资料采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 血小板总量及回收率
顶底袋实验组血小板计数为(986.0±277.0)×109/L, 浓缩血小板体积为(46.5±11.5)mL, 血小板回收率为91.0%; 四联袋对照组血小板计数为(705.0±322.0)×109/L, 浓缩血小板体积为(49.8±8.4)mL, 血小板回收率为69.0%, 差异有统计学意义(P<0.01)。见表1。
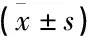
表1 顶底袋与四联袋血小板质量比较
2.2 悬浮红细胞质量分析
顶底袋实验组红细胞体积为(163.0±12.0)mL, 红细胞回收率为81.0%; 四联袋对照组红细胞体积为(179.0±10.0)mL, 红细胞回收率为90.0%, 差异有统计学意义(P<0.01)。顶底袋实验组与四联袋对照组红细胞计数分别为(5.2±0.5)×109/L与(5.4±0.5)×109/L, 血红蛋白含量分别为(154.0±15.0)×109g/L与(159.0±13.0)×109g/L, 差异均无统计学意义(P>0.05)。顶底袋实验组与四联袋对照组红细胞悬液中白细胞残留分别为(2.8±1.5)×106/L与(4.4±1.9)×106/L, 差异有统计学意义(P<0.01)。顶底袋因保留中间白膜层,有少许红细胞残留,导致最终红细胞悬液体积略有差异,顶底袋红细胞回收率略低于传统四联袋。见表2。
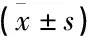
表2 红细胞悬液质量比较
2.3 血浆质量分析
顶底袋实验组血浆含量为(108.7±14.4)mL, 四联袋对照组血浆含量为(109.2±16.5)mL, 差异无统计学意义(P=0.899)。2组血浆中残留红细胞、血小板、白细胞及血红蛋白含量比较,差异均无统计学意义(P>0.05)。顶底袋与四联袋在制备血浆的工艺上并无差别,质量也较为稳定。见表3。
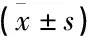
表3 2组血浆质量分析
3 讨 论
抗凝全血中含有大量的血小板,在未进行手工制备浓缩血小板的情况下,这些血小板在红细胞悬液保存的过程中快速失效,并未能发挥作用,造成极大浪费; 失效后的血小板亦作为某种多余的组分存在于红细胞悬液中,存在引发输血不良反应的风险[4-5]。虽然机采血小板因其采集制备自动化标准化而在中国、美国等国家得到广泛的应用[6],但欧洲各国手工血小板制备方式灵活多样、血液来源丰富、成本低廉,仍然占据主流地位。
目前临床机采血小板主要应用于治疗体内血小板减少。手工法制备血小板由于滤白技术的发展,减少了汇集浓缩血小板输注的不良反应,在治疗血小板减少应用方面得到了提升。此外,浓缩血小板在体外的应用也是近年研究的热点之一[3]。KAZAKOS K[7]将PRP应用于创面修复取得了良好的效果,相较于未使用组,患者创面愈合和预后明显改善。浓缩血小板应用软组织及骨组织的修复则更为多见,一项国外大型研究[8]表明,浓缩血小板可以有效促进损伤的修复,而浓缩血小板的体外应用在国内的研究还较为少见。
限制浓缩血小板应用的一个关键问题是目前国际、国内缺乏统一的浓缩血小板的制备标准及严格的质量标准,现有的血小板质量评价标准主要以CCI等来确定血小板输注的疗效。然而,这些指标对于在血小板制备过程中的指导作用不强,无法合理迅速地制备后输注前的质量标准。国内这方面体现的研究正在进行[9]。本研究发现,一方面血小板在静置时会出现一定的物理性可逆的聚集和黏附现象,在静置、离心以及转移的过程中,会有一定量的血小板因为聚集和黏附的作用,成团聚集吸附在血袋壁及导管等处,应用顶底袋分离血小板时,由于白膜层被保留在原始袋中,待血小板与白细胞自然解聚后再行分离富含血小板血浆,制备浓缩血小板,可以有效减少血小板因聚集吸附特性导致的损失,提高血小板制备的质量; 另一方面,顶底袋分离时,因为从上联导管分离血浆,从下联导管分离红细胞,分离过程中白膜层黏附于血袋壁并不会减少白膜层的回收率,因此可以不考虑白膜层的回收率而充分分离红细胞,减少红细胞过分损失,因而悬浮红细胞的质量有了明显的提升。而在手工分离时,为了充分分离白膜层,会有部分红细胞分离进入白膜层,从而造成红细胞损失较大。
综上所述,顶底袋在分离浓缩血小板方面相较于传统四联袋有一定的优势,在一些手工浓缩血小板应用较多的欧洲国家也得到广泛的应用。在中国,单采血小板应用较多,传统手工浓缩血小板也不能忽视,顶底袋可以在富血小板血浆的研究和应用中发挥更多的作用。

