生长抑素联合硫酸镁治疗重症急性胰腺炎效果观察
吕 歆, 张香军
(河南省黄河三门峡医院, 1.消化内科, 2.重症医学科, 河南 三门峡, 472000)
重症急性胰腺炎(SAP)是临床常见急腹征,具有发病急、病情进展快的特点,常并发多器官功能不全甚至衰竭,病死率高达30%[1]。大量炎性因子释放和肠道功能受损,导致治疗难度增加。因此在充分液体复苏的基础上清除炎症因子,保护肠黏膜屏障,能够维持重要脏器功能稳定。临床常规采用生长抑素治疗SAP, 对改善微循环和减轻胰腺水肿具有一定作用,但单独使用时对肠黏膜保护效果并不理想,可使大量炎性介质释放,进而降低了治疗效果。本研究观察了生长抑素联合硫酸镁治疗SAP患者的疗效及其对血清淀粉酶(AMS)、脂肪酶(LPS)和炎症因子水平的影响,现将结果报告如下。
1 资料与方法
1.1 一般资料
患者知情同意且经医院伦理委员会审核批准后,将本院2019年3—12月收治的76例SAP患者作为研究对象。纳入标准: ① 符合SAP诊断标准[2]者; ② 血、尿AMS水平明显升高者; ③ 超声检查示胰腺增大者; ④发病时间在48 h以内者; ⑤意识清晰,认知功能正常者。排除标准: ① 合并心、肺功能严重障碍者; ② 对本研究所用药物过敏者; ③ 合并肝硬化者; ④ 肠道出血者; ⑤ 沟通、交流能力异常者。按照简单随机化方法将纳入患者分为对照组和观察组,每组38例。对照组男22例,女16例; 年龄38~60岁,平均(49.36±2.09)岁; 发病至入院时间为(30.65±4.35)h; 急性生理学和慢性健康状况评分系统Ⅱ(APACHEⅡ)评分为(9.32±0.96)分; 发病原因为暴饮暴食10例,酒精性12例,胆源性16例。观察组男20例,女18例; 年龄40~60岁,平均(49.45±2.13)岁; 发病至入院时间为(30.77±4.40)h; APACHEⅡ评分为(9.36±0.93)分; 发病原因为暴饮暴食9例,酒精性12例,胆源性17例。2组患者一般资料比较,差异无统计学意义(P>0.05), 具有可比性。
1.2 治疗方法
2组患者入院后均接受禁食、胃肠减压、密切监测生命体征、抗感染、纠正电解质紊乱等对症治疗。对照组采用生长抑素治疗,即6 mg生长抑素(深圳翰宇药业股份,国药准字H20064372)加入1 000 mL 0.9%氯化钠溶液中静脉滴注, 1次/d, 连续治疗2周。观察组在对照组治疗基础上应用硫酸镁(自贡鸿鹤制药,国药准字H51021263)100 mL口服治疗, 1次/d, 连续治疗2周。
1.3 观察指标
① 治疗效果: 治疗2周后,血清白细胞(WBC)、AMS水平恢复正常,为显效; 临床症状缓解且血清WBC、AMS水平改善50%以上,为有效; 临床症状和血清WBC、AMS水平无明显改善,为无效。总有效率=(显效+有效)/总例数×100%。② 血清AMS、LPS水平: 采用碘-淀粉比色法检测患者治疗前后的血清AMS、LPS水平。③ 炎性因子水平: 采用酶联免疫吸附测定(ELISA)法检测患者治疗前后的C反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)水平。④ 并发症发生情况: 并发症包括胰腺脓肿、急性呼吸窘迫综合征和急性肾衰竭。
1.4 统计学分析
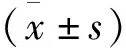
2 结 果
2.1 治疗效果比较
观察组治疗总有效率94.74%, 高于对照组的78.95%, 差异有统计学意义(P<0.05), 见表1。

表1 2组治疗效果比较[n(%)]
2.2 血清LPS、AMS水平比较
治疗前, 2组LPS、AMS水平比较,差异无统计学意义(P>0.05); 治疗后, 2组血清LPS、AMS水平均低于治疗前,且观察组血清LPS、AMS水平低于对照组,差异有统计学意义(P<0.05)。见表2。
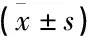
表2 2组血清LPS、AMS水平比较 U/L
2.3 炎性因子水平比较
治疗前, 2组CRP、TNF-α、IL-6水平比较,差异无统计学意义(P>0.05); 治疗后, 2组CRP、TNF-α、IL-6水平均低于治疗前,且观察组CRP、TNF-α、IL-6水平低于对照组,差异有统计学意义(P<0.05)。见表3。
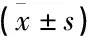
表3 2组炎性因子水平比较
2.4 并发症比较
观察组出现急性呼吸窘迫综合征1例、急性肾衰竭1例,并发症发生率为5.26%(2/38); 对照组出现急性呼吸窘迫综合征4例、急性肾衰竭2例、胰腺脓肿2例,并发症发生率为21.05%(8/38)。观察组并发症发生率低于对照组,差异有统计学意义(P<0.05)。
3 讨 论
目前, SAP的发病机制尚未完全明确,研究[3-5]表明SAP发病初期的启动因子是胰腺自身消化,而胰腺损伤、肠道细菌移位及自由基损伤等是急性胰腺炎重症化的重要因素。临床常采用生长抑素治疗SAP患者,但单独使用生长抑素对肠黏膜屏障的保护作用较弱,导致机体炎症反应改善效果不佳,损伤胰腺,形成恶性循环。随着临床对SAP发病机制的认识不断加深,目前SAP的治疗方案已不再局限于胰酶抑制剂和生长抑制剂,而是在积极消除炎性症状的基础上,阻断内毒素产生,保护肠黏膜屏障。
硫酸镁可提高机体免疫功能,抑制细菌繁殖,其作用机制包括: ① 阻碍细菌、内毒素移位,降低血液中TNF-α含量,阻碍TNF-α诱导的细胞因子链锁反应,从而使血液中内毒素水平降低; ② 增强胃肠道平滑肌张力,松弛胆管括约肌,降低胆管内压力,促进胃肠蠕动; ③ 阻碍胰酶从肠道至腹腔的吸收作用,减少内毒素被吸收入血,对抗内毒素对肠黏膜的损害,从而修复肠黏膜免疫屏障; ④ 减少自由基生成,抑制相关炎性因子释放[6]。
SAP是多种致病因素导致胰腺内胰酶被异常激活,引起胰腺组织自身消化、水肿、出血、坏死,甚至出现全身炎症反应综合征的临床常见急腹症。器官衰竭、呼吸窘迫综合征是SAP的严重并发症,重视并发症的防治是提高SAP治疗效果的关键[7]。本研究中,观察组治疗总有效率(94.74%)高于对照组(78.95%), 并发症发生率(5.26%)低于对照组(21.05%), 差异有统计学意义(P<0.05), 与伍小鱼等[8]研究结论相符,说明生长抑素联合硫酸镁治疗SAP患者可提高治疗效果,降低并发症发生率。分析原因, 33%硫酸镁可刺激十二指肠黏膜,反射性地引起胆总管括约肌松弛,不仅能缓解腹胀、腹痛等症状,还能促进胃肠道内炎性介质排出,阻断机体损伤的恶性循环,从而提高了治疗效果,降低了并发症发生率。
LPS是由胰腺分泌的消化酶,具有较高的特异性。研究[8]证实, SAP发生后,血清LPS水平将升高并持续7~10 d, 故LPS是SAP早期诊断和预后评价的重要指标。当胰腺细胞受到损伤时,胰腺细胞内的AMS释放入血,血清AMS水平随之升高,可在一定程度上反映胰腺组织损伤程度,但单独诊断灵敏性不高,与LPS联合检测对SAP的诊断特异度和灵敏度高达90%[9]。本研究中,观察组治疗后的血清LPS、AMS水平低于对照组,差异有统计学意义(P<0.05), 说明生长抑素联合硫酸镁治疗SAP患者可降低胰腺损伤程度。分析原因,硫酸镁可扩张Oddi括约肌,使胆管和胰管扩张,在降低胰管压力的同时可增强胃肠动力,促进细菌内毒素排出,降低腹腔压力,减少肠道细菌移位,消除肠道水肿,减轻胰腺损伤。
SAP发生时,机体将过度释放多种细胞因子及炎症介质,形成“瀑布”效应,作用于全身各组织器官,进而引发多器官功能不全或衰竭。另外, SAP早期即存在细菌、内毒素移位, SAP发生时,肠道缺血缺氧,导致肠黏膜屏障被破坏,细菌和内毒素随之移位到肠外,引起胰腺及胰周继发感染,甚至全身性的内毒素血症[10]。在体内毒素攻击下,单核巨噬细胞被激活, TNF-α、IL-6等大量炎性细胞因子释放,进而促使中性粒细胞被激活,更多的细胞因子和炎性介质产生,加重了炎性反应,其中CPR水平升高最为显著。本研究中,观察组治疗后CRP、TNF-α和IL-6水平低于对照组,差异有统计学意义(P<0.05), 说明生长抑素联合硫酸镁治疗SAP患者可改善机体炎性反应。分析原因,生长抑素能抑制胰腺分泌,使胰酶分泌量减少,并降低相关酶的活性;硫酸镁可阻碍细菌、内毒素移位,降低血液中TNF-α含量,阻碍TNF-α诱导的细胞因子链锁反应,从而使血液中内毒素水平降低,改善炎性反应。
综上所述,生长抑素联合硫酸镁治疗SAP患者疗效确切,能够改善血清AMS、LPS水平,降低炎症因子水平,缓解胰腺损伤,且并发症少,安全可靠。

