学龄期注意缺陷多动障碍儿童的健康状况
王俊丽,盛晓阳,薛敏波,李 斐,江 帆,沈理笑*
1.上海交通大学医学院附属新华医院发育行为儿童保健科(中国上海 200092);2.教育部与上海市环境与儿童健康重点实验室(中国上海 200092)
注意缺陷多动障碍(attention-deficit/hyperactivity disorder, ADHD)是最常见的影响儿童和青少年的一种神经发育障碍,我国学龄儿童的ADHD发病率为5.7%[1]。ADHD呈慢性过程,60%~80%可持续到青少年期,50%影响成年期;其中71.9%的患儿同时有其他疾病[2]。因ADHD疾病本身、共病和药物治疗的单个或协同作用,ADHD儿童容易出现健康问题,如饮食失调[3]、睡眠障碍所致的肥胖问题[4]、营养不良[5]、过敏性疾病[6]等。另有报告,ADHD儿童长期应用兴奋剂[7]可能出现身高增长速度减缓等。为了解学龄期ADHD儿童的健康状况,本研究拟利用2005年11—12月全国学龄儿童睡眠状况调查项目中的ADHD数据,分析学龄期ADHD儿童的体格生长与疾病状况。
1 对象与方法
1.1 对象及抽样方案
研究对象为1~6年级在校学龄儿童,采用分级整群抽样方法。采样时间是2005年11—12月。随机抽取全国31个省(自治区、直辖市)和新疆生产建设兵团中9个城市进行问卷调查,分别为上海、广州、西安、武汉、成都、哈尔滨、呼和浩特、乌鲁木齐及石河子。而后分级抽样,根据各抽样城市人口分布及行政区划分情况,每个城市随机抽取3~10个区,每个区随机抽取1~2所小学,每所学校每个年级随机抽取1~2个班,即抽样技术路线为市→区→学校→年级→班。最终抽取了39个区、55所小学,其中9个区、13所小学位于城郊接合部,30个区、42所小学位于城区。该研究项目获得每个调查点当地机构审查委员会的伦理批准。
1.2 研究方法
1.2.1 问卷调查 包括3个部分,用于了解儿童的基本健康状况。第1部分是自制的学龄儿童个人及家庭社会环境问卷,包括个体因素(性别、年龄)、围产期因素(分娩方式、孕周情况、喂养方式)、家庭环境因素(照养人受教育水平、家庭人均收入、父母婚姻状况及地域分布)以及既往疾病诊断史(ADHD、反复感冒、鼻塞、哮喘、中耳炎、扁桃体或腺样体肥大、胃食管反流、食物过敏、过敏性鼻炎和肥胖症)。第2部分是儿童睡眠习惯问卷(children’s sleep habits questionnaire, CSHQ),CSHQ总评分>41分为睡眠质量不良,得分越高,表示睡眠质量越差。第3部分是儿童一般生活质量评估调查问卷,用于记录孩子的主观感受。问卷由学生带回交给家长填写,并附有问卷填写说明及知情同意书。
1.2.2 ADHD诊断和分组 依据父母在问卷中 “孩子是否曾被专科医师(发育行为儿科或精神科)明确诊断过ADHD”的回答(是或否)[《精神疾病诊断与统计手册(第4版)》(DiagnosticandStatisticalManualofMentalDisorders(FourthEdition), DSM-Ⅳ)],将学龄儿童分为ADHD组和非ADHD组。
1.2.3 营养状况评价 由经过统一培训并有体格测量经验的校医进行体格测量。以2005年中国2~18岁儿童青少年体格评价标准进行儿童营养状况判定。根据标准,体质量低于同年龄同性别第3百分位数值定义为低体质量;身高低于同年龄同性别第3百分位数值定义为生长迟缓;体质指数(body mass index, BMI)低于同年龄同性别的第3百分位数值定义位消瘦;BMI高于同年龄同性别的第85百分位数值定义为超重,高于同年龄同性别的第97百分位数值定义为肥胖[8]。低体质量、生长迟缓、消瘦和超重、肥胖统称为营养不良。
1.2.4 数据处理 为排除6岁以下及13岁以上儿童对结果的干扰(因涉及早入学及跟班就读儿童的特殊现象),年龄取值范围为6岁0天~12岁11个月30天。对各年龄段进行分组,6岁0天~6岁11个月30天为6岁组,以此类推包括6、7、8、9、10、11和12岁共6组。
1.3 统计学分析
使用SPSS 21.0软件进行统计分析。定性资料以率描述,对学龄期儿童的生长迟缓检出率、低体质量检出率、消瘦检出率和超重、肥胖检出率,采用双侧χ2检验。对ADHD与非ADHD儿童的个体因素(性别、年龄)、围产期因素(分娩方式、孕周情况、喂养方式)、家庭环境因素(地域因素、照养人受教育水平、家庭人均收入及父母婚姻状况)、既往疾病和睡眠因素等进行单因素方差分析;将单因素方差分析中有统计学意义的变量作为控制因素,以早产儿及既往疾病作为自变量,以有无专科医师诊断ADHD作为因变量,建立二分类Logistic回归模型。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
调查中9个城市的合格问卷有21 890份,男童10 869名(49.7%),女童11 021名(50.3%),平均年龄为(8.81±1.79)岁;其中ADHD儿童970名(4.4%),平均年龄为(8.82±1.69)岁,男童650名(6.6%),女童320名(3.2%)。6~12岁儿童21 667名(99.0%),其中ADHD儿童962名(99.1%)。
2.2 营养不良情况
2.2.1 总体情况 有效体格测量6~12岁儿童人数为18 731名(87.1%),男童9 252名(49.4%),女童9 479名(50.6%);其中ADHD儿童808名(83.3%),男童532名(5.7%),女童276名(2.9%)。超重检出率为15.9%,肥胖检出率为11.9%,消瘦检出率、低体质量检出率和生长迟缓检出率分别为4.8%、2.5%和5.2%。统计学分析结果显示:ADHD组与非ADHD相比,超重肥胖检出率的差异有统计学意义(P=0.002),消瘦检出率的差异无统计学意义(P=0.063),生长迟缓检出率的差异有统计学意义(P<0.001),低体质量检出率的差异无统计学意义(P=0.924)。详见表1。
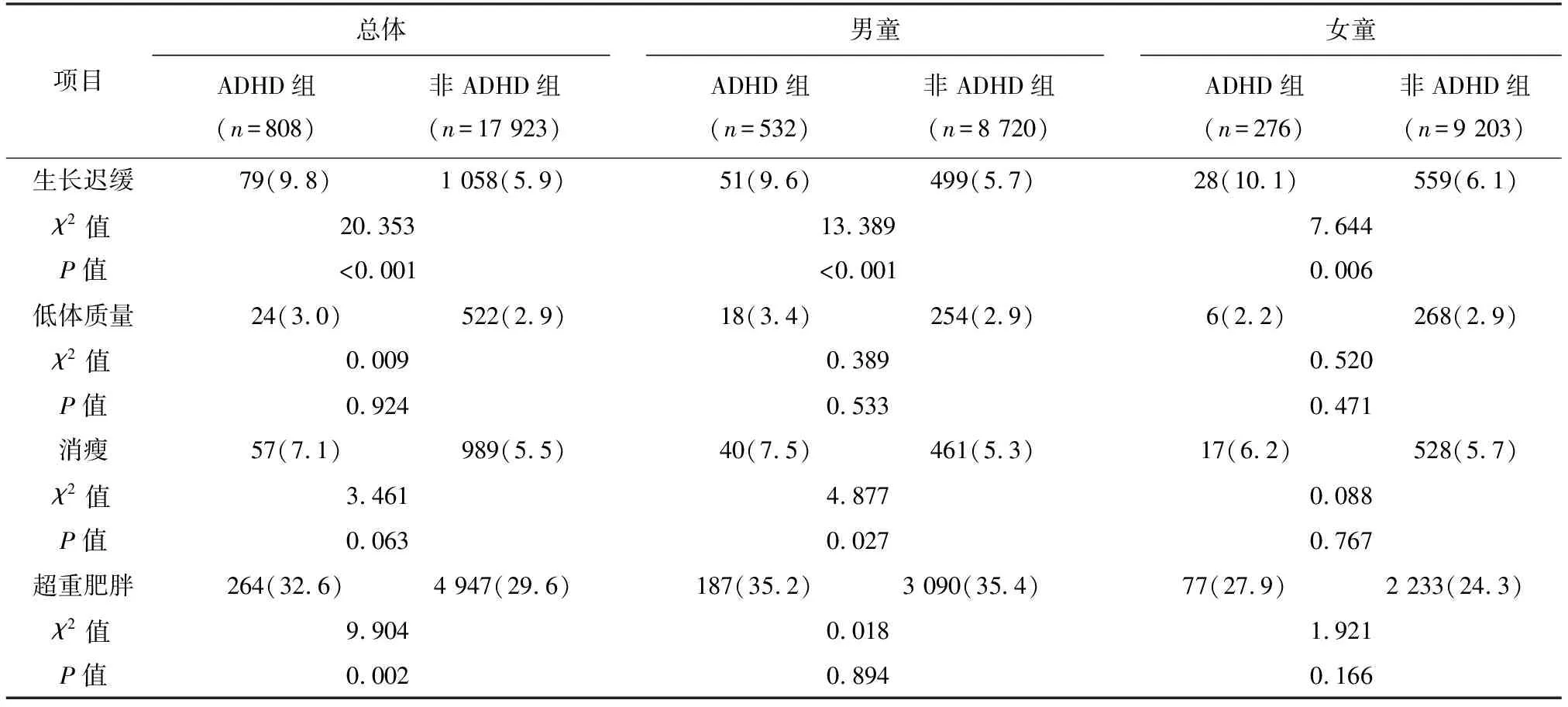
表1 总体及不同性别ADHD和非ADHD儿童的营养不良检出情况 n(%)
2.2.2 不同性别ADHD与非ADHD儿童比较
与非ADHD组男童相比,ADHD组男童的生长迟缓和消瘦检出率较高,差异均有统计学意义(P<0.001,P=0.027);2组男童低体质量和超重肥胖检出率的差异无统计学意义(P>0.05)。ADHD组女童的生长迟缓检出率高于非ADHD组女童,差异有统计学意义(P=0.006);2组女童低体质量、消瘦和超重肥胖检出率的差异均无统计学意义(P>0.05)。详见表1。
2.2.3 各年龄段ADHD与非ADHD儿童比较 各年龄段ADHD儿童和非ADHD儿童的营养不良检出情况如表2所示。统计学分析结果显示:7岁组ADHD儿童的消瘦检出率显著高于非ADHD儿童(P=0.006);其他年龄组中低体质量、消瘦和超重肥胖检出率,在ADHD儿童和非ADHD儿童间的差异均无统计学意义(P>0.05)。这提示ADHD儿童的超重肥胖问题,在总人群中差异有统计学意义;但在各年龄段虽比率较高,但差异无统计学意义。但ADHD儿童和非ADHD儿童的生长迟缓检出率,在6~9岁年龄段内的差异均有统计学意义,均表现为ADHD儿童高于非ADHD儿童(6岁组:P=0.028;7岁组:P=0.013;8岁组:P=0.027;9岁组:P=0.007);ADHD儿童和非ADHD儿童生长迟缓检出率在10~12岁年龄段的差异无统计学意义(P>0.05)。

表2 各年龄段ADHD和非ADHD儿童的营养不良检出情况
2.3 多因素Logistic回归分析
以问卷调查内容中影响儿童营养情况的因素作为自变量,包括早产儿、过敏性疾病(过敏性鼻炎、食物过敏、哮喘和反复鼻塞)、中耳炎、扁桃体或腺样体肥大、胃食管反流和睡眠质量不良,以有无专科医师确诊ADHD作为因变量,建立2分类 Logistic 回归模型。对儿童个体因素(性别、年龄)、围产期因素(分娩方式、喂养方式)、家庭环境因素(照养人受教育水平、家庭人均收入、父母婚姻状况及地域分布)进行校正。分析结果显示:早产儿ADHD的患病风险为1.838(95%CI:1.393~2.423),过敏性疾病患儿ADHD的患病风险为1.915(95%CI:1.526~2.399),中耳炎患儿ADHD的患病风险为1.549(95%CI:1.118~2.416),扁桃体或腺样体肥大患儿ADHD的患病风险为1.662(95%CI:1.348~2.050),胃食管反流患儿ADHD的患病风险为3.008(95%CI:1.792~5.049),睡眠质量不良患儿ADHD的患病风险为2.201(95%CI:1.847~2.623)。详见表3。

表3 多因素Logistic回归分析
3 讨论
ADHD在国内外普遍被关注,已被公认为是儿童和青少年的主要心理障碍之一,其对儿童生长的影响还处于研究阶段。关于ADHD对儿童营养状况的影响,多数研究集中在药物应用对生长的影响[9-10],部分研究关注ADHD儿童与超重肥胖的共病[11],有关体格发育方面的研究报道较少。
本研究利用全国学龄儿童睡眠状况调查项目中的ADHD数据,对ADHD儿童和非ADHD儿童的营养状况进行分析。结果显示,ADHD儿童超重肥胖趋势更明显;消瘦检出率也偏高,统计值接近0.05;生长迟缓检出率更高,尤其是6~9岁年龄段,而该年龄段是ADHD儿童进行诊断和用药的主要年龄段。早产儿、过敏性疾病、中耳炎、扁桃体或腺样体肥大、胃食管反流和睡眠质量不良都是ADHD危险因素,这些疾病会通过影响机体内分泌环境及营养素水平等,影响ADHD儿童的健康。可见,我国学龄期ADHD儿童营养状况处于两极化状态,提示在制定ADHD诊疗指南时,不仅要关注药物和行为治疗,也应该加入营养管理。ADHD儿童的长期临床营养管理,其必要性主要体现在:① ADHD儿童容易出现异常饮食行为及营养问题;② 营养问题影响用药依从性;③ 营养问题和ADHD具有协同性。
ADHD与异常饮食行为存在较强相关性,致使ADHD儿童超重肥胖、生长迟缓和其他营养问题并存。ADHD儿童超重肥胖问题,Lam等[12]2007年关于广西地区报道结果与本次研究报道一致。2010年浙江省的一项研究[13]发现158名ADHD患儿中超重肥胖检出率为29.1%,远高于当年主管部门关于学生的体质与健康调研结果(14.57%)。多数研究[14]认为,共病机制是异常饮食行为模式,ADHD患者存在警觉性降低和睡眠障碍,易选择高热量食物(如快餐)而放弃家里制作的健康食物。同时,警觉性降低造成饮食满足延迟,容易出现饮食失调,包括不吃早饭[15]、暴饮暴食、吃零食、久坐在电视机前[16-17]等,即ADHD-不良事件-压力-暴饮暴食模式[18],导致ADHD儿童超重肥胖发生。ADHD儿童饮食模式也与遗传因素相关,2017年Chen等[19]对瑞典服役男性及其后代子女ADHD患病情况、教育情况、共患病(包括药物滥用、焦虑、抑郁)、超重肥胖等进行了家族共聚集研究,发现超重肥胖和ADHD有共同家族危险因素。也有研究结果显示,FTO(fat mass and obesity associated)(肥胖基因)中rs805013片段介导ADHD发病[20],参与ADHD发病的DRD4基因也增加肥胖风险[21];低出生体质量不仅是ADHD的危险因素,也是肥胖的危险因素[22],推测ADHD和肥胖在胎儿期编程可能含有共有基因表型[23],需进一步研究。有学者[9]认为,无论是否使用药物,ADHD儿童的身高缺陷会在青春期后期恢复正常。主要原因可能是疾病本身或药物应用仅“暂时性”影响生长激素的效果,但不会降低机体生长激素水平[10]。本研究中结果亦显示一致,在青春期前(6~9岁)ADHD儿童身高低于非ADHD儿童。此外,ADHD患儿还易于存在其他营养问题,本研究中ADHD儿童的消瘦检出率偏低,与非ADHD儿童相比差异无统计学意义;ADHD儿童中过敏性疾病、中耳炎、扁桃体及腺样体肥大、胃食管反流等慢性炎性疾病发病率较高,易于出现饮食行为障碍,造成铁、锌、镁、维生素D等营养素缺乏[24],影响ADHD儿童营养状况出现消瘦和生长迟缓。综上所述,ADHD儿童营养状况存在两级化现象。
药物治疗是6岁以上ADHD儿童的首选治疗方案。中枢兴奋剂是ADHD儿童一线用药,其不良反应主要表现在用药初期,包括食欲下降、体质量减轻、影响生长速度和睡眠障碍等,这些不良反应大多轻微、暂时,可临床管理并逐渐耐受[25]。但负面媒体报道和围绕使用这些药物的污蔑性社会态度使得患儿父母很难接受兴奋剂治疗[26],对于生长迟缓和消瘦的ADHD儿童尤甚,最主要原因是家长不能接受药物的不良反应[27],一般会拒绝用药或者在用药初期就中断用药[28-29]。一项澳大利亚社区的纵向研究[30]对179名ADHD儿童的用药情况进行随访分析,发现10岁之前兴奋剂应用率仅为13.6%,10岁后上升到25.6%;而10岁之前是ADHD儿童出现消瘦和生长迟缓的主要时期。ADHD儿童药物应用大多是一个长期的过程,在这个过程中ADHD儿童的营养问题需要临床医师的关注,其中体质量不增和身高增长缓慢是影响家长态度的主要原因[31]。欧洲ADHD药物不良反应管理指南建议药物治疗期间,每半年使用生长曲线监测1次体质量和身高生长速度,若发现增长不足,应首先改善营养情况(如增加高能量零食、加餐)而非随意停药。可见对ADHD儿童营养管理,国外已有相关规定。本研究结果显示,当儿童存在早产儿、过敏性疾病、中耳炎、扁桃体或腺样体肥大、胃食管反流、睡眠质量不良时,ADHD患病风险均增加,且都有统计学意义,这与许多研究结果一致[23,32]。这些疾病发病基础与个别营养素或者食物显著相关[33],可通过饮食管理包括饮食结构调整及补充制剂应用[34],如多不饱和脂肪酸和维生素D制剂补充、富含锌铁镁食谱建立等,都有利于改善ADHD儿童的临床症状[35]。由此可见,对ADHD儿童进行营养管理,不仅可减少家长的恐慌,而且可以指导临床医师用药规范性。
本研究中的分析数据源自2005年11—12月全国学龄儿童睡眠状况调查项目。该项目采用分级整群抽样方法,样本来自全国9个城市不同学校的2万多学龄期儿童,具有较大的样本量和较好的整体代表性,能够反映我国学龄期ADHD儿童的整体分布及营养问题。但该研究是一项全国性多中心横断面问卷调查,其中ADHD确诊依据是既往疾病诊断,可能存在家长回忆和诊断标准的偏倚问题,且其中用药情况并未报道;其次,本研究为横断面研究,学龄期ADHD儿童营养问题仍需进一步的队列研究来加以证实。
本研究结果提示,学龄期ADHD儿童营养状况处于两极化,包括消瘦、生长迟缓和超重肥胖等营养问题。早产、过敏性疾病、中耳炎、扁桃体或腺样体肥大、胃食管反流和睡眠质量不良,这些影响儿童营养状况的疾病均是ADHD的危险因素。上述健康问题可能影响家庭对药物治疗决策,在临床管理中进行协同治疗,互有裨益,建议在给予ADHD儿童行为和药物治疗过程中,进行长期临床营养监测及管理。

