细胞因子配体3和绝经后骨质疏松症严重程度相关性研究
赵东波 王昊 马育林 何扬
1.珠海市人民医院/暨南大学附属珠海医院内分泌科,广东 珠海 519000 2.暨南大学第一临床医学院重症医学科,广东 广州 510630
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是绝经后女性需要面临的一种重要的代谢性骨病。虽然PMOP的病因尚不完全清楚,雌激素缺乏在PMOP的发生发展中起重要作用[1]。到目前为止,OP主要是根据股骨近端和腰椎骨密度(bone mineral density, BMD)来确诊[2]。最近,已提出涉及骨转换增加的生化标志物作为骨吸收严重程度的潜在指标[3]。趋化因子是参与调节细胞募集的小的可溶性化学吸引细胞因子,与细胞分化、细胞凋亡和增殖以及其他生理活动有关[4]。趋化因子细胞因子配体3(CCL3)也称为巨噬细胞炎性蛋白-1α,是最广泛研究的趋化因子之一。CCL3是一种具有化学吸引力的细胞因子趋化因子,对树突细胞、单核细胞、嗜碱性粒细胞和嗜酸性粒细胞具有趋化活性。近年来,已经部分研究了CCL3在骨代谢中的作用。CCL3与其受体趋化因子细胞因子受体1结合,通过下调骨钙素(OCN),与runt相关的转录因子2(Runx2)和osterix(Osx表达)的表达来抑制矿化激活,从而抑制成骨细胞的分化、增殖和成骨潜能[5]。此外,施用抗CCL3抗体可以增加OCN、Runx2和Osx的水平,部分恢复成骨细胞的活性[5]。因此,CCL3可能在OP进展中发挥关键作用。然而,目前血清CCL3水平与OP疾病严重程度之间研究有限。因此,本研究观察血清CCL3水平和PMOP疾病严重程度的相关性。
1 材料和方法
1.1 一般临床方案
2017年9月至2019年6月,82例PMOP患者纳入本研究。所有诊断均基于世界卫生组织的OP诊断标准。排除标准:存在可能导致低BMD的其他代谢性骨病,如骨软化、甲状旁腺功能亢进和维生素D缺乏;存在明显的肾、肝或心血管疾病;使用降钙素、选择性雌激素受体调节剂或过去3个月内使用雌激素或过去6个月内双膦酸盐(BP)或糖皮质激素。将76名骨量正常的绝经后妇女[绝经后非骨质疏松症(PMNOP)]和80名育龄妇女(20~49岁)作为对照组。所有参与者均签署知情同意书。
1.2 指标检测
在禁食过夜后的上午8:00,抽取静脉血并快速离心,将样品保持在-80 ℃条件下直至检测完毕。使用定量夹心酶联免疫吸附法通过试剂盒(Quantikine;R&;D Systems,Minneapolis,MN)检测血清CCL3的水平。根据制造商的说明设置空白对照、标准品和样品孔。通过标准曲线计算CCL3的样品水平。血清白细胞介素(IL)-6(1∶1 000,Santa Cruz,USA)、肿瘤坏死因子-α(TNF-α) (1∶1 000,Santa Cruz,USA)、抗酒石酸酸性磷酸酶5b(TRACP-5b) (1∶1 000,Abcam,Cambridge,UK)和1型交联的羧基末端端肽(CTX-1) (1∶1 000,Abcam,Cambridge,UK)的水平也使用相同的检测方案进行测试。CCL3、IL-6、TNF-α、CTX-1和TRACP-5b测定间变异系数分别为3.3%、5.2%、4.0%、3.1%和3.9%;CCL3、IL-6、TNF-α、CTX-1和TRACP-5b测定内变异系数分别为4.6%、6.6%、6.3%、7.5%和5.3%。所有样品测试重复至少3次。
使用Oswestry残疾指数(ODI)和视觉模拟评分(VAS)评估临床症状严重程度。使用范围从0(无疼痛)到100 mm(最严重的疼痛)的范围评估VAS上的评分。ODI通过评估10个项目的自我管理问卷评估背部特异性功能,每个项目的点数范围为0~5,最终得分总计在0~100个点之间。这10个项目包括疼痛强度、睡眠、站立、坐、走、举、个人护理、旅行、工作和社交生活;分数较高的患者的疾病更严重。
所有受试者的BMD使用双能量X射线吸收测定法(Prodigy Advance,General Electric Company,Fairfield,CT,USA)检测,检测的部位包括股骨颈、全髋和腰椎(L1-L4),检测结果使用g/cm2表示。
1.3 统计学分析
数据使用均数±准偏差、中位数或频率。用Kolmogorov-Smirnov检验评估数据的正态性。根据数据分布,通过单向ANOVA或Kruskal-Wallis检验进行PMOP女性,PMNOP女性和健康对照之间的特征比较。应用Bartlett试验检验组间方差同质性,用Tukey或Tamhane检验进行事后分析。通过Spearman相关和多元线性回归分析调整体重指数(BMI)和年龄前后血清中CCL3浓度与BMD,临床严重程度和生化指标的相关性。所有分析均使用SPSS 19.0进行,P<0.05表示差异有统计学意义。
2 结果
表1描述了所有受试者的人口统计学和临床特征。PMOP组的平均年龄为(65.8±5.1)岁,PMNOP组为(64.9±5.7)岁,对照组为(44.9±5.0)岁。与PMNOP[(23.9±3.3)kg/m2]和对照组[(23.6±3.4)kg/m2]相比,PMOP[(24.0±3.0)kg/m2)的BMI没有显著差异。PMOP组血清CCL3水平显著高于PMNOP组[(40.9±15.1)pg/mL vs (24.2±8.7) pg/mL vs (23.9±9.1) pg/mL;P<0.001]。
与PMNOP和对照组相比,PMOP组股骨颈、腰椎L1~4和全髋的骨密度显著降低(表2)。进一步分析血清CCL3水平以确定它们与PMOP中的BMD的相关性。发现较高的CCL3水平与较低的股骨颈BMD(r=-0.329,P=0.003),较低的总髋BMD(r=-0.345,P=0.002)和较低的腰椎L1-L4的BMD(r=-0.354,P=0.001)相关。
本研究进一步探讨了血清CCL3浓度与VAS和ODI临床严重程度评分的相关性,以说明CCL3是否与临床表现有关。结果显示血清中的CCL3水平与VAS(r=0.413,P<0.001)和ODI(r=0.360,P<0.001)显著相关。同时发现CCL3与骨吸收标志物TRACP-5b(r=0.371,P<0.001)、CTX-1(r=0.317,P=0.004)、TNF-α(r=0.305,P=0.005)以及IL-6(r=0.288,P=0.008)呈正相关。调整年龄和BMI后,所有这些相关性仍然显著(表3)。多元线性回归分析表明,CCL3可作为评估BMD和临床严重程度的独立候选标志物(表4)。
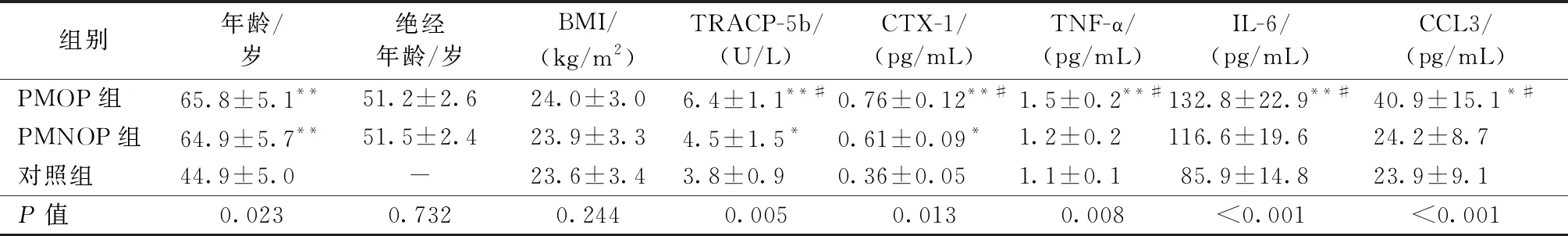
表1 绝经后非骨质疏松症、绝经后骨质疏松症和健康对照组的人口学数据、生化指标和CCL3水平比较

表2 绝经后非骨质疏松症、绝经后骨质疏松症和健康对照组中股骨颈、全髋和腰椎的骨密度比较(g/cm2)
3 讨论
本研究证实PMOP的女性骨密度降低的同时血清CCL3水平则升高,表明这种趋化因子与OP之间存在相关性;此外,还发现CCL3水平和VAS和ODI密切相关;CCL3水平也与IL-6、TNF-α、CTX-1和TRACP-5b密切相关。这一结果表明CCL3是PMOP妇女OP进展的重要中介因子。

表3 通过调整年龄和体重指数的绝经后骨质疏松症女性血清趋化因子细胞因子配体3浓度与其他指数的相关性

表4 多元线性回归分析年龄、BMI和血清CCL3与BMD、VAS和ODI的相关性Table 4 Multivariate linear regression for age, BMI, and serum CCL3 with BMD,VAS, and ODI
趋化因子是介导白细胞和其他表达G蛋白偶联受体的细胞的激活和迁移的细胞因子[6]。基于其氨基末端保守的半胱氨酸残基序列,有4个主要的趋化因子亚群,即CXC、CC、C和CX3C[6]。趋化因子在启动破骨细胞激活和破骨细胞发生中是至关重要的[7]。尤其是CCL3,在破骨细胞分化过程中由RANKL诱导[8],是诱导多发性骨髓瘤中破骨细胞形成的公认因子[5]。CCL3是巨噬细胞的趋化细胞因子,诱导破骨细胞聚集和活动[8]。本研究证明血清CCL3水平与股骨颈、全髋和腰椎L1-L4的BMD降低有关,表明CCL3可能既诱导破骨细胞活动,又导致骨量减少。
慢性背痛是PMOP最重要的并发症之一。腰背部疼痛在骨质疏松症患者中很常见,高达10.4%的腰背部疼痛的PMOP患者并未发现骨折[9]。此外,骨密度降低与椎骨骨折的风险增加有关,这反过来也可能导致慢性疼痛和限制背部运动[10-11]。用于治疗OP(包括BP)的药物可以通过作用于破骨细胞活性来减轻疼痛。这些发现表明OP与骨吸收和疼痛密切相关,骨吸收可能导致骨质疏松骨疼痛。CCL3证明可以调节疼痛,炎症组织中CCL3表达的升高与急性和慢性炎性痛觉过敏和慢性机械性过敏症密切相关[12]。此外,在慢性和复发性颈痛患者中,随着炎性细胞因子的增加,CCL3水平显著增加[13]。本研究发现血清中CCL3浓度的增加与VAS和ODI都呈正相关,这意味着CCL3可能参与了与破骨细胞活动相关的疼痛。
TRACP-5b作为破骨细胞活性、破骨细胞数量和骨吸收的标志物[14]。CTX-1是OP进展、骨折风险和预后的参考标志物[15]。CTX-1似乎是一种敏感、特异和快速可用的骨吸收生物标志物,可以预测PMOP患者对BP治疗的反应。先前的研究发现,与健康对照组相比,PMOP患者的CTX-1和TRACP-5b明显升高,并与BMD呈负相关[16]。同时,雌激素水平下降,炎症标志物如IL-6和TNF-α水平增加,所有这些都加速了骨重塑周期,伴随着破骨细胞的强烈激活和更大的骨吸收。本研究发现血清CCL3水平与升高的CTX-1和TRACP-5b水平呈正相关;CCL3与IL-6以及TNF-α水平呈正相关,进一步支持CCL3在破骨细胞活动中所起的作用以及骨转换标志物。
本研究有一些局限性。首先,本研究设计为横断面研究,涉及相对较小的样本量。第二,未评估可能参与OP进展的其他趋化因子的浓度。总之,本研究发现在PMOP中CCL3水平比健康女性更高。在PMOP中,CCL3水平与疾病严重程度呈正相关。

