Wnt/β-catenin通路在FSHβ增强BMP9诱导间充质干细胞成骨分化的作用研究
成亚琳 赵怡心 张任飞 刘宏*
1. 绵阳市第三人民医院/四川省精神卫生中心,四川 绵阳 621000 2. 重庆医科大学附属第一医院生殖健康与不孕症中心,重庆 400016
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)的高发生率、严重并发症成为困扰人们的公共卫生难题,其骨吸收超过骨形成,骨密度降低,骨组织结构完整性被破坏,骨骼变得脆弱,易于发生骨折[1]。长期以来,人们认为PMOP的发生与绝经后雌激素水平降低有关[2],但随着研究[3]进展,也有人认为围绝经期显著升高的促卵泡激素(follicle-stimulating hormone,FSH)是引起PMOP的重要原因之一。
FSH是来源于腺垂体的促性腺激素[4],由特异性的β亚基通过非共价键连接非特异性的α亚基[5-7]组成二聚体,与卵巢或睾丸中的FSH受体(follicle-stimulating hormone receptor, FSHR)结合[8]调节性腺发育[4],其分泌受下丘脑、卵巢或睾丸等的调节。长久以来,人们对FSH生理作用的认识局限于生殖系统,但随着研究方法的多样化,人们也开始关注其对生殖系统以外的影响[9]。
研究表明,FSHR广泛分布于多种组织。胰腺[10]、前列腺[11]、胎盘[12]等均有FSH和FSHR存在,血糖[10]、血脂[13]调节、肿瘤转移[14]、血管形成[12]等也有其参与。骨骼系统中,破骨细胞及其前体、成骨细胞前体[15]以及软骨细胞[16]上均检测到FSHR表达。在破骨细胞及其前体上,FSH与Giα偶联的FSHR结合,促进破骨细胞形成,使骨吸收增加,因而认为绝经期升高的FSH是引起PMOP的原因之一[15]。Tourkova等[17]通过研究FSH对间充质干细胞的影响,发现FSH可以增加MSCs的增值,但对成骨分化并无显著影响,甚至随着时间延长会减少骨形成。此外,也有研究表明,FSHβ能增强BMP/Smad通路[18]和Notch通路[19]协同BMP9诱导MSCs成骨分化。那么,作为五大发育信号之一的Wnt通路是否也参与了FSH增强BMP9诱导的成骨分化呢?
Wnt信号庞大而复杂,最经典的是Wnt/β-catenin信号[20]。Wnt配体与受体结合后,抑制APC-Axin-GSK3β复合物的功能,胞质内β-catenin磷酸化水平降低,非磷酸化水平显著升高,转移至核内与TCF/LEF形成复合物,激活下游靶基因:cyclin D1、c-Myc、c-Jun、DPAGT1等的转录[21],调节细胞增殖和存活[22]。Wnt通路与多种信号网络存在联系,可通过β-catenin与Runx2相互作用,参与BMP9对MSCs的成骨调节[23]。因此,本课题在前期研究[18, 19]的基础上探讨了Wnt/β-catenin信号对FSHβ协同BMP9诱导MSCs成骨分化的影响。
PMOP引起的健康问题受到广泛关注,有人期待以绝经期显著升高的FSH为契机,寻找防治新方向。本课题使用从C3H小鼠胚胎中分离建立的具有多向分化潜能的间充质干细胞株C3H10T1/2为研究对象,以重组腺病毒为GFP、FSHβ和BMP9载体,将FSHβ与有较强成骨作用的BMP9相结合,探讨FSHβ对BMP9诱导MSCs成骨的影响,为绝经后骨松的防治提供新思路。
1 材料与方法
1.1 研究材料
本研究中使用的293T人胚肾细胞和C3H10T1/2细胞均从ATCC(American type culture collection)公司采购[19]。ALP显色试剂盒从Beyotime Biotechnology公司采购。ARS染料从重庆赛米克生物科技有限公司采购。细胞总RNA快速抽提试剂盒(Trizol)为美国英杰(Invitrogen)公司生产。反转录试剂盒和qPCR检测试剂盒从宝生物工程(大连)有限公司采购。XAV-939购买于MedChemExpress公司。
1.2 方法
1.2.1细胞培养:本研究中所有细胞均在含90 %高糖、10 %热灭活胎牛血清(fetal calf serum, FCS)和1 %链霉(100 μg/mL)-青霉素(100 U/mL)的DMEM培养基中培养,置5 % CO2、37 ℃细胞培养箱。
1.2.2重组腺病毒GFP、BMP9和FSHβ的构建与扩增:本研究使用的目标重组腺病毒GFP、BMP9和FSHβ(Ad-GFP、Ad-BMP9和Ad-FSHβ)均使用AdEasy系统[24]构建,表达绿色荧光,293T细胞扩增后冻存于-80 ℃。
1.2.3目标腺病毒滴度测定及药物浓度测定:本研究设计为四组:Ad-GFP组(对照组)、Ad-BMP9组、Ad-FSHβ组和Ad-BMP9+Ad-FSHβ组(后三组为实验组)。将C3H10T1/2细胞消化、离心、重悬后以适当密度接种于24孔板[19],待细胞贴壁后,取适量重组腺病毒原液按倍比稀释法感染细胞,24 h后荧光显微镜下观察细胞内各种腺病毒绿色荧光表达量,结合ALP显色结果选择重组腺病毒感染浓度进行研究。此外,将不同浓度的XAV-939加入Ad-BMP9+Ad-FSHβ实验组,根据ALP染色结果选择药物浓度。每组实验重复次数:n=3。
1.2.4ALP染色:将细胞接种于24孔板,根据测定的腺病毒或药物浓度处理细胞,7 d后按ALP显色试剂盒操作说明对细胞进行固定、清洗、染色、照相并记录。每组实验重复次数:n=3。
1.2.5目的基因检测:将细胞接种于24孔板,重组腺病毒或药物处理细胞,5 d后根据TRIzol、反转录试剂盒和qPCR检测试剂盒使用说明提取细胞总RNA、合成cDNA并检测目的基因表达。每组实验重复次数:n=3。目的基因前、后引物序见表1。

表1 目的基因引物序列Table 1 Gene primers sequences
1.2.6ARS染色:将细胞接种到24孔板,重组腺病毒感染细胞后第3天用含10 mmol/L β-磷酸甘油和50 ng/mL维生素C的钙盐诱导培养基替代DMEM培养基,第28天移弃培养基后经多聚甲醛(4 %)固定、茜素红S染色后显微镜下采集图像信息。每组实验重复次数:n=3。
1.3 统计分析
2 结果
2.1 FSHβ对BMP9诱导的MSCs成骨分化中碱性磷酸酶和钙盐小结的影响
ALP是一种糖蛋白,在骨组织中被认为是骨形成的早期生物学标志物[25]。另外,在MSCs向骨细胞分化的进程中,成骨细胞是一个重要的中间分化形态,其重要的生物学特征是分泌细胞外基质(类骨质),导致磷酸钙沉积,即矿化,茜素红S染色后呈橘红色。因此,钙盐小结被认为是其重要的晚期标志物之一。将测定滴度的目标腺病毒按实验设计感染C3H10T1/2细胞,分别于7 d和28 d后检测ALP和钙盐小结的表达。研究结果如图1 A所示,较Ad-GFP对照组,Ad-FSHβ实验组ALP的显色无明显差异,Ad-BMP9实验组明显加深,提示FSHβ对MSCs向成骨细胞的分化无显著影响,BMP9则有较强的成骨诱导功能;而Ad-BMP9与Ad-FSHβ联合实验组ALP显色较Ad-BMP9实验组进一步加深,钙盐小结染色结果也呈现相似的显色趋势(图1B),提示 FSHβ表达增强了BMP9诱导下MSCs成骨方向分化的能力。
2.2 FSHβ对BMP9诱导的MSCs中cyclin D1 mRNA表达的影响
本课题前期研究发现经典的BMP/Smad信号[18]和Notch信号[19]可能参与了FSHβ协同BMP9诱导MSCs成骨,因而,本研究探讨了经典的Wnt/β-catenin信号是否也在其中发挥作用。检测Wnt/β-catenin通路下游基因转录,在Ad-FSHβ实验组,cyclin D1 mRNA的表达量与Ad-GFP对照组相比无显著性差异, Ad-BMP9实验组的表达量明显升高(P<0.01),提示单独用FSH处理MSCs不会引起Wnt/β-catenin信号的增强,而BMP9则可诱导经典的Wnt信号传递;此外,联合使用Ad-BMP9和Ad-FSHβ处理MSCs,cyclin D1的转录较Ad-BMP9实验组显著增加(P<0.01),提示FSHβ增强了BMP9诱导的cyclin D1的转录(图2),亦即FSHβ增强了BMP9诱导的Wnt/β-catenin信号传递。
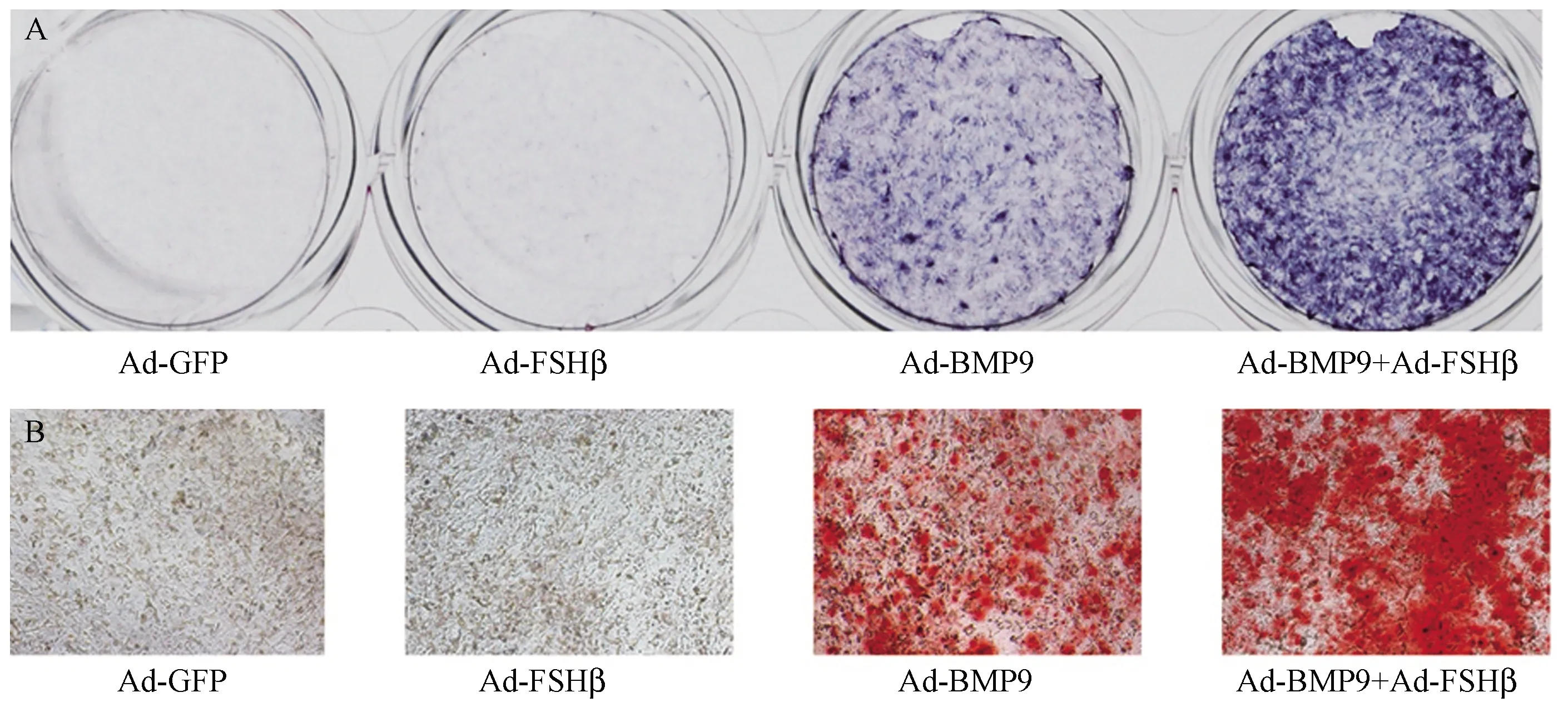
图1 FSHβ对BMP9诱导的MSCs成骨分化中ALP和钙盐小结的影响 A:ALP显色结果显示各组ALP表达情况(7 d);B:ARS染色后光学显微镜下各组钙盐小结沉积情况(28 d,100×)。Fig.1 The influences of FSH on ALP and calcium salt nodules of MSCs osteogenesis differentiation induced by BMP9 A:ALP chromogenic reaction showed the ALP expression in all groups (7 days); B:ARS staining results showed the calcium salt nodules deposition in each group with optical microscope dectection (28 days, 100×).

图2 qPCR技术检测各组cyclin D1的转录水平(5 d,n=3,Student’s t-test)注:与Ad-GFP组比较,**P<0.01;与 Ad-BMP9组比较,&&P<0.01。Fig.2 qPCR technology assayed the transcription levels of cyclin D1 in each group(5 days, n=3, Student’s t-test)
2.3 XAV-939降低了FSHβ增强BMP9诱导的MSCs中cyclin D1转录和ALP表达
本研究使用Wnt信号抑制剂XAV-939进一步验证笔者的猜想。XAV-939可结合ADP-核糖基化酶催化域稳定Axin,降低β-catenin稳定性,因此在该通路中起阻滞剂功能。首先,本研究检测了XAV-939处理后各研究组中Wnt/β-catenin下游基因的转录。和预期一样(图3),XAV-939处理后,降低了细胞中BMP9诱导的cyclin D1的转录水平(P<0.01),也降低了Ad-BMP9与XAV-939联合实验组中cyclin D1的转录水平(P<0.05),提示XAV-939降低了FSHβ增强BMP9诱导的Wnt/β-catenin信号转导。另外,显色实验显示各研究组中ALP的表达和cyclin D1转录有相似的变化,提示XAV-939抑制了FSHβ协同BMP9诱导成骨的作用。
3 讨论
PMOP的高发生率已引起各国的重视,其病因、发病机制、诊治方法、预防策略等都是广泛关注的问题。随着组织工程学的发展,具有成骨分化潜能的MSCs有望在PMOP的防治中发挥作用,但由于其多向分化特性,其在成骨中的实际应用受到限制。
研究发现,FSH除调节生殖系统外,对骨骼系统也存在影响。FSH对骨形成负调控,FSHβ亚基的多克隆抗体不仅阻断FSH对破骨细胞的作用,还能刺激骨形成,增加成骨细胞数量[26]。但利用转基因技术在雌鼠高表达FSH[27]却能增加胫骨和椎体小梁骨体积;另外,不同的FSHR基因型(AA rs 6166和GG rs 6166)对骨代谢也可产生不同影响[28]。由此,FSH对骨骼系统影响复杂。PMOP表现为骨丢失超过骨形成,而破骨细胞前体和成骨细胞前体上均有FSHR存在,那么是否有因子能与之协作后逆转FSH的破骨能力,向成骨方向发展,成为笔者的研究目标。
很多因子都与FSH存在联系,BMPs家族即是其中之一。BMP7能增加人卵巢颗粒细胞FSHR表达,调节卵泡成熟[29];在未分化的颗粒细胞里,BMP2却能诱导Smad1/5/8磷酸化阻断FSH诱导的FSHR表达,从而抑制FSH应答[30]。BMP9被证实有较强诱导成骨分化的作用[31],本课题推测FSH也能调节BMP9诱导MSCs向成骨细胞分化。

图3 XAV-939(1 μmol/L)处理后各组中cyclin D1 mRNA和ALP的表达检测 A:qPCR检测各组中cyclin D1 的转录(5 d,n=3,Student’s t-test。与Ad-GFP组相比,**P<0.01;与Ad-BMP9组相比, ##P<0.01;与Ad-BMP9组相比,&&P<0.01;与AdBMP9+Ad-FSHβ组相比,@P<0.05);B:ALP显色实验检测各组ALP的表达(7 d)。Fig.3 The expressions detection of cyclin D1 mRNA and ALP in all groups with XAV-939 (1 μmol/L) treatment
研究以C3H10T1/2为间充质干细胞代表,用重组腺病毒携带BMP9和FSHβ基因体外表达验证笔者的猜想。研究结果显示,FSH能增强BMP9成骨诱导效应,表现为BMP9与FSHβ共同实验组ALP、钙盐小结表达比BMP9实验组更高,这与本课题前期研究相符[18-19]。另外,前期研究也证实BMP/Smad信号[18]和Notch信号[19]参与了此过程。因此,本研究接下来检测了Wnt/β-catenin通路的变化。利用qPCR技术检测到FSHβ增加了BMP9诱导的cyclin D1的转录水平,而单独的FSH作用对其并无影响,在使用通路抑制剂XAV-939的情况下该作用受到部分抑制,表现为BMP9、FSHβ与XAV-939共同实验组cyclin D1的转录表达水平降低,这种改变在ALP检测中也得到相似的变化趋势,因此反向验证当两种因子共同作用也增加了Wnt/β-catenin的传递。
因此,本研究结果提示BMP9诱导的MSCs成骨分化可受到FSHβ亚基的增强,Wnt/β-catenin通路可能参与其中。然而,其中涉及的具体作用机制仍需进一步深入研究。另外,结合本课题的早期研究,三种信号通路以外是否还有其他的信号参与,以及三者之间是否有相互联系都是本课题接下来的研究内容,以期为绝经后骨病的防治提供合理的依据。
致谢:感谢重庆医科大学生命科学院骨发育与再生平台为本研究提供的技术支持与帮助。

