阴道镜下宫颈量化指标在宫颈高级别鳞状上皮内病变宫颈萎缩患者术式选择中的价值
徐海洋 王 爽 梁华茂 游 珂 张春妤 张 坤 耿 力
(北京大学第三医院妇产科,北京 100191)
随着社会经济水平的提高和宫颈病变筛查的普及,越来越多的围绝经期女性进行宫颈癌筛查。对于三阶梯检查诊断宫颈高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)的患者,按诊疗原则首选宫颈锥切术[1]。但由于该人群患者绝经后宫颈及阴道萎缩明显,部分患者无进行宫颈锥切手术的可能,只能采取筋膜外全子宫切除术。筋膜外全子宫切除术除手术范围大,并发症发生率较宫颈锥切更高外,尚存在术后病理结果超出宫颈癌ⅠA2范围,需要补充放疗等特殊情况。目前,对于绝经期宫颈严重萎缩的HSIL患者的治疗,国内外均为仅凭术者肉眼检查及临床经验选择术式,缺乏有效的量化指标和依据以指导术式选择。本研究对我院2012年1月~2019年4月诊断HSIL的绝经后患者术前阴道镜下宫颈径线进行研究,旨在探讨此类患者术式选择的定量评估方法。
1 临床资料与方法
1.1 一般资料
我院2012年1月~2019年4月经阴道镜宫颈活检或会诊外院病理后,病理结果为HSIL、年龄≥50岁的绝经后患者共572例,其中因宫颈严重萎缩,由副主任医师及以上医师判定无法行宫颈锥切术,直接行筋膜外全子宫切除术59例,占10.3%(59/572)。59例中,在我院行阴道镜检查有阴道镜测量数据42例。42例妇科检查记录均为宫颈萎缩、展平,阴道穹隆部展平或消失,无具体数据描述宫颈萎缩程度。选择我院同期绝经后因HSIL行宫颈锥切后再行筋膜外全子宫切除术的患者,按年龄、绝经年限进行1∶1配对,如无配对样本再按年龄±2岁内进行配对,共匹配成功41对,即配对成功后全切组、锥切组各41例。2组患者一般资料比较差异无统计学意义(P>0.05),见表1。另外选择因HSIL行宫颈锥切的老年患者35例(验证组),年龄(57.2±3.8)岁,绝经时间(7.1±4.1)年,以验证分类判别函数的符合率。

表1 2组一般资料比较
1.2 方法
术前常规行阴道镜(北京四维赛洋阴道显微镜,型号:3ML LED)检查及活检,留取阴道镜下宫颈图像。采用阴道镜成像测量软件,所选宫颈图像均为7.5倍放大图片,固定一人进行图像测量。首先,识别图像中宫颈边缘3、6、9、12点位置,以宫颈口为原点,宫颈12点边缘过原点到6点边缘的直线距离为前后径(D1),宫颈9点边缘过原点到3点边缘的直线距离为横径(D2)。每个径线分别测量3次,取平均值,精确到0.1 mm。宫颈测量模式图见图1。

图1 阴道镜下宫颈测量模式图
1.3 病理诊断标准
根据2012年美国病理学会(College of American Pathologists,CAP)和美国阴道镜及宫颈病理学会(American Society for Colposcopy and Cervical Pathology,ASCCP)联合发表的下生殖道HPV相关的鳞状病变的标准化诊断系统,鳞状上皮内病变(squamous intraepithelial lesion,SIL)分为2级:宫颈低级别鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)和HSIL[2]。
1.4 统计学处理
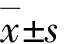
2 结果
阴道镜下宫颈径线测量结果显示,2组间宫颈前后径和横径差异有统计学意义(P<0.05),见表2。
以Fisher判别分析法建立萎缩宫颈术式选择分类判别函数[2],Y全切=7.27×D1+6.803×D2-12.191,Y锥切=12.103×D1+5.401×D2-18.568。

表2 2组阴道镜下测量宫颈径线的比较cm
计算Y值,分别代入2个分类函数,同一数据Y值较大者分类到相应的组别。分类函数判别后全切组34例仍在全切组,锥切组31例仍在锥切组,分类成功65例,分类正确79.27%(65/82),即以宫颈径线为基础的分类判别函数判别的手术分组与临床决策分组的符合率为79.27%。分类判别函数分组的灵敏度为82.93%(95%CI:70.90%~94.95%),特异度为75.61%(95%CI:61.89%~89.33%),见表3。
35例验证组前后径(2.18±0.30)cm,横径(2.07±0.31)cm,将宫颈径线测量数据代入分类判别函数进行验证,与临床判别符合率为82.86%(29/35)。

表3 2组分类判别结果(n=41)
3 讨论
绝经后宫颈、阴道萎缩是临床处理老年女性HSIL患者较为棘手的问题。当宫颈萎缩甚至宫颈阴道部全部消失,经临床评估无法行宫颈锥切手术时,如何选择手术方式仍是争议的焦点。迄今为止,国际指南对于老年女性群体HSIL的诊断和治疗与育龄女性并无区别[3]。尽管宫颈锥切是HSIL患者的首选治疗,但对于绝经后子宫萎缩行宫颈锥切困难者,采取子宫切除术可能亦是比较恰当的选择[1]。但宫颈萎缩到何种状态下无法进行锥切而需选择全子宫切除目前尚无指南、共识或标准以指导临床[4]。因此,有必要对这一患者群体的宫颈情况进行研究,寻找宫颈萎缩的量化指标,探讨其与主观判断手术方式的相关性,以期更加客观地指导临床进行HSIL术式的选择。
本研究期间我院绝经后HSIL患者因宫颈萎缩严重,经高年资医师认定无法行宫颈锥切者占同期同年龄段患者总数的10.3%(59/572)。因此,这一群体在临床上并不少见。全切组患者阴道镜下宫颈前后径和横径比锥切组显著减小,差异有统计学意义(P=0.000,P=0.015),说明“临床认定宫颈过小而无法锥切”与“宫颈径线显著缩小”是有一定联系的。本研究利用统计学软件进行一般判别分析,建立判别函数,通过1∶1配对,避免个体差异的影响,结果显示以术者临床经验进行患者分组为基础,依据阴道镜测量宫颈径线做出的判别模型分组与临床经验分组的符合率为79.27%,灵敏度和特异度分别为82.93%(95%CI:70.90%~94.95%)和75.61%(95%CI:61.89%~89.33%),说明阴道镜下测量宫颈径线与临床经验选择HSIL手术方式具有一定的重合性,验证组符合率82.86%(29/35),尽管符合率有待提高,但宫颈径线作为一项简单有效的量化指标,在作为依据决定此类患者手术方式选择时具有一定的价值。
老年女性宫颈萎缩的同时,常伴有宫颈展平和阴道穹隆消失,导致宫颈阴道部严重缩短或消失,这亦是影响医生治疗决策的重要原因。目前,阴道镜下尚无法对上述情况做量化,这是阴道镜下测量的不足之处,亦可能是临床经验选择与宫颈径线间不能完全一致的原因之一。锥切组10例宫颈径线符合全切组的径线范围,临床亦成功进行了宫颈锥切,说明有部分宫颈萎缩明显的患者,只要宫颈尚有一定宽度,如果宫颈阴道部和穹隆萎缩不甚明显,在麻醉松弛后宫颈能够下拉,宫颈阴道部可以充分暴露,是有可能完成宫颈锥切手术的。因此,应用阴道镜下测量的2个径线做治疗选择依据的同时,亦应结合患者同时存在的生殖道萎缩的情况,决定是否可行宫颈锥切亦或是行筋膜外全子宫切除术。另外,此类患者还有另一种选择,即子宫颈切除术。该术式相对全子宫切除手术范围小,术中大量出血、副损伤等并发症发生率低,相对较为安全[5]。但如果阴道萎缩严重,无法暴露术野、无法行阴式手术时,或患者存在子宫及附件病变,在充分评估患者状况及宫颈癌风险后,筋膜外全子宫切除术亦有一定价值。
关于阴道镜下测量宫颈径线鲜有报道。李虎等[6]通过二维超声测量43例全子宫切除术前的宫颈形态,术前超声测量宫颈横径(29.36±5.48)mm,前后径(24.96±4.16)mm,但未对患者年龄进行分层。刘欣燕等[7]通过经阴道超声测量130例绝经女性宫颈宽度为(1.69±0.45)cm,与本组结果相似,但未能评价宫颈宽度与手术选择的关系。因此,是否可将超声测量宫颈径线指标用于指导HSIL患者术式选择尚有待进一步研究。采用核磁等影像学检查由于费用高等问题较少开展。
虽然对于绝经后宫颈萎缩,细胞学阳性而锥切困难的患者可采取全子宫切除术,但是不加选择地对所有宫颈萎缩的HSIL患者直接进行全子宫切除是有风险的。本研究中直接行筋膜外全子宫切除术后病理升级率5.1%(3/59),均为宫颈鳞癌ⅠA1期。因此,如果阴道镜评估出现病灶和移行带不可见、宫颈管HSIL、阴道镜怀疑浸润癌、有腺癌证据等情况必须先做宫颈锥切以除外浸润癌[1]。如无法行宫颈锥切,建议结合MRI等影像学检查指导临床决策以除外浸润癌[8~10]。除高年资医生的临床经验评估外,如果有可靠的术前定量评估方法指导手术方案的制定,并据此做好相关的术前准备,将会使此类手术患者获益。
本研究有一定局限性。首先,这是一项单中心回顾性研究,病例数相对较少。其次,本研究的前提是绝经后HSIL患者,经我院高年资妇科医生检查考虑无法行宫颈锥切术,直接行全子宫切除,因此,病例的选择具有主观性。第三,本研究对于阴道镜下宫颈径线的测量指标尚在探索中,缺乏对宫颈展平和阴道穹隆消失情况的量化,因此,有待于未来扩大样本和探索新的指标进一步研究。阴道镜下诊断的同时实施宫颈径线测量,具有无创、简便、准确、依从性好的特点,尽管样本量少且存在阴道镜测量软件在测图过程中的误差,至少是一种可供临床使用的术前联合评估方法。
综上,对于绝经后宫颈萎缩明显的HSIL患者,阴道镜下宫颈径线测量可以更客观地反映患者宫颈情况,与主观判断选择手术方式具有一定的一致性,可作为术式选择的临床量化指标,使术前评估更为简便且有依据,对此类患者的临床术式选择具有一定的指导意义和应用价值。

