地黄梓醇对木瓜蛋白酶诱导的大鼠膝骨关节炎模型滑膜组织中S100A12、IL-1β、Galectin-3表达的影响①
何 强 尹 宏 代凤雷 张 斌 徐 磊
(南京中医药大学,南京 210022)
膝骨关节炎是由多种原因导致关节软骨及软骨下骨进行性退化,导致生活质量下降及巨大的人力和经济损失[1,2]。关节软骨由广泛的细胞外基质组成,在膝骨关节炎的病变过程中,滑膜组织释放的促炎因子分解、代谢、活化,导致软骨细胞外基质净降解,加速膝骨关节炎进展[3]。膝骨关节炎的症状主要表现为疼痛。目前的临床治疗策略效果有限,肌肉的强健和运动没有得到充分重视,且现有用药策略副作用较大,尤其是对于老年人群,如乙酰氨基酚的肝毒性、非甾体抗炎药的胃肠道毒性以及阿片类药物引起的跌倒、骨折和神经错乱等[4]。膝骨关节炎的MRI研究已经报道了滑膜炎和疼痛的关系,表明膝骨关节炎疼痛是由炎症触发的,意味着抗炎治疗策略可能减轻患者疼痛并改善关节功能[5,6]。基于目前用药策略的毒副作用风险,本研究试图探讨不同浓度的地黄梓醇在膝骨关节炎治疗早期能否通过影响滑膜组织中S100A12、IL-1β、Galectin-3表达而发挥作用,探究地黄梓醇治疗早期膝骨关节炎的作用机制,为其临床应用奠定理论基础。
1 材料与方法
1.1材料
1.1.1实验动物 3~8周龄成年雄性Wistar大鼠40只,由南京市江宁区青龙山动物繁殖场提供,许可证号:SCXK(苏)2017-0001,体质量(0.29±0.1)kg。实验人员均获得江苏省动物实验资格证。实验方案经南京市六合区人民医院医学伦理委员会批准。
1.1.2试剂 Galectin抗体(Proteintech,货号:14979-I-AP,批号:10006432);IL-1β抗体(Proteintech,货号:66737-I-Ig,批号:10006432);S100A12抗体(Bioworld,货号:BS7539,批号:XS20181105000);地黄梓醇(西安明朗科技生物有限公司);4%木瓜蛋白酶 (上海恒远生物科技有限公司);辣根过氧化物酶(Bioworld,货号:BS10950,批号:CI33171);辣根过氧化物酶显色试剂盒(碧云天生物技术有限公司南通分公司,批号:033016160503);乙醇(成都市科龙化工试剂厂,批号:2015082701);盐酸(成都市科龙化工试剂厂,批号:20140706512);苏木素(无锡市江源实业技贸总公司,批号:160401100);中性树脂(康复器材有限公司,批号:20150710);石蜡(国药集团化学试剂有限公司,批号:20140626);二甲苯(成都市科龙化工试剂厂,批号:2015072801)。
1.1.3仪器 分析天平(北京塞多利斯科仪器有限公司,型号:BSA124S);烘箱(上海巴姆测控技术有限公司,型号:101-2AS);蒸馏水制水器(上海亚荣生化仪器厂,型号:SZ-97A);超纯水机(上海和泰仪器有限公司,型号:Master-D UVF);石蜡切片机(金华市益迪医疗设备厂,型号:YD-1508A);光学显微镜(蔡司公司,型号:Axioplan 2 imaging);水浴锅(郑州博科仪器设备有限公司,型号:HW-5L);三维CT(南京中医药大学附属南京中医院影像学科提供,型号:Siemens Ddfintion AS)。
1.2方法
1.2.1动物分组及造模 大鼠适应性喂养1周,精准称重,按体质量由小到大顺序进行编号,随机分成4组:正常对照组、模型对照组、地黄梓醇低、高剂量组。除正常对照组外,其他3组造模期间统称造模组。造模方法参照文献[7-10],木瓜蛋白酶法诱导膝骨关节炎,于实验开始后第1、4、7天分别向大鼠左膝关节腔内注射4%木瓜蛋白酶。注射方法:麻醉前禁食12 h,按大鼠体质量(5 ml/kg)采用体积分数7%的水合氯醛注射于腹腔进行麻醉,大鼠反抗能力减弱即为麻醉显效。大鼠进入浅麻醉期后,将其身体侧卧并伸展左后肢,常规备皮、乙醇消毒,左膝关节屈曲45°,于髌骨下极髌腱外缘处,将4%木瓜蛋白酶100 μl注入大鼠左膝关节腔,诱导大鼠早期膝骨关节炎。见图1。正常对照组处理方法及注射部位与造模组大鼠相同,左膝关节腔注射等体积生理盐水。造模第10天,随机选取造模组和正常对照组大鼠各4只,采用三维CT进行模型鉴定,鉴定过程参考文献[11]。
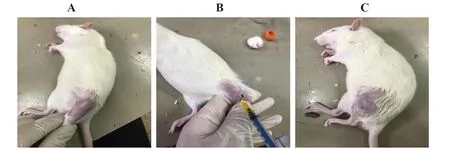
图1 大鼠左膝关节腔注射相应药物过程Fig.1 Process of injecting corresponding drugs into left knee joint cavityNote:A.Shaving disinfection before injection;B.Injection of medicine into left knee joint;C.After injection.
1.2.2给药方式 依据《中药药理研究方法学》剂量估换计算公式:dB=dA×KB/KA,将推荐成人每天服药量折算为实验大鼠每天服药量[12]。同时结合刘志强等[13]报道的梓醇不同给药方式药动学研究制定实验大鼠每天服药量及服药方式。地黄梓醇高剂量组采用100 mg/kg,地黄梓醇低剂量组10 mg/kg,每只大鼠灌胃给予0.2 ml/kg药物。正常对照组和实验对照组给予等量生理盐水。1次/d(早8:00),连续28 d。
1.2.3标本采集 滑膜组织采集参考文献[14]。药物干预完成后,过量麻醉处死大鼠(心脏注射过量7%水合氯醛),10%强力消毒冷溶液完全浸泡10 min,置于超净工作台,仰位并固定,常规消毒。左后肢内侧打开左膝关节腔,由髌骨下缘向上延至可见一层平滑光亮呈淡黄色的滑膜组织,完全剥离滑膜组织后完整切下。PBS冲洗干净后放入一次性塑料包埋框中标记,依顺序放入不同浓度梯度的乙醇中脱水2 h;50%乙醇、二甲苯各透明2 h,浸蜡与包埋后切6 μm片,制成玻片后于60℃恒温烘箱中烘烤约5 h,4℃保存待用。见图2。

图2 大鼠膝关节滑膜提取及部分玻片、蜡块Fig.2 Extraction of synovium of rat knee joint and some slides and wax blocksNote:A.Synovium extracted from knee joint of rats;B.Prepared part;C.Wax block after being made.
1.2.4三维CT观察 随机抽取正常对照组和造模组各4只大鼠左膝关节的三维CT影像,以确定造模成功。
1.2.5S100A12、IL-1β、Galectin-3水平检测 将切片常规二甲苯脱蜡、梯度乙醇水化,3%H2O2灭活切片中的内源性过氧化物酶,放入95℃ 0.01 mol/L柠檬酸盐缓冲液(pH6.0)中,孵育20 min以上,室温放置至少20 min;PBS配制5%的正常山羊血清,37℃孵育10 min,甩去多余液体;按说明书采用5%BSA稀释一抗和二抗,滴加一抗150 μl,室温静置1 h,4℃过夜后37℃复温45 min;PBS洗3次,5 min/次,滴加二抗150 μl,室温静置1 h;PBS洗3次,5 min/次,滴加DAB显色液150 μl,在显微镜下掌握染色程度,肉眼可见样本变成棕黄色;染色程度合适时,立刻用PBS冲洗10 min。常规苏木素复染,梯度酒精脱水、二甲苯透明,中性树胶封片,光镜下观察。采用Image J软件统计染色情况,染色阳性采用光密度平均值评价。

2 结果
2.1各组大鼠左膝关节三维CT情况 正常对照组大鼠左膝间隙清晰正常,未见狭窄,关节骨质边缘光滑平整,造模组大鼠左膝关节间隙明显变窄,有清晰骨赘生成,骨质边缘和关节软骨表面粗糙,见图3。

图3 大鼠左膝关节三维CTFig.3 Three dimensional CT of left knee joint of rats
2.2各组大鼠滑膜组织细胞中S100A12、IL-1β、Galectin-3表达情况 正常大鼠滑膜组织细胞质或细胞核中棕褐色颗粒较少,S100A12、IL-1β、Galectin-3无表达。模型对照组大鼠滑膜组织细胞质或细胞核中棕褐色颗粒较对照组明显增多。地黄梓醇各剂量组大鼠滑膜组织细胞质或细胞核中棕褐色颗粒表达均较模型对照组减少,但地黄梓醇高剂量组较低剂量组减少更为明显,见图4。
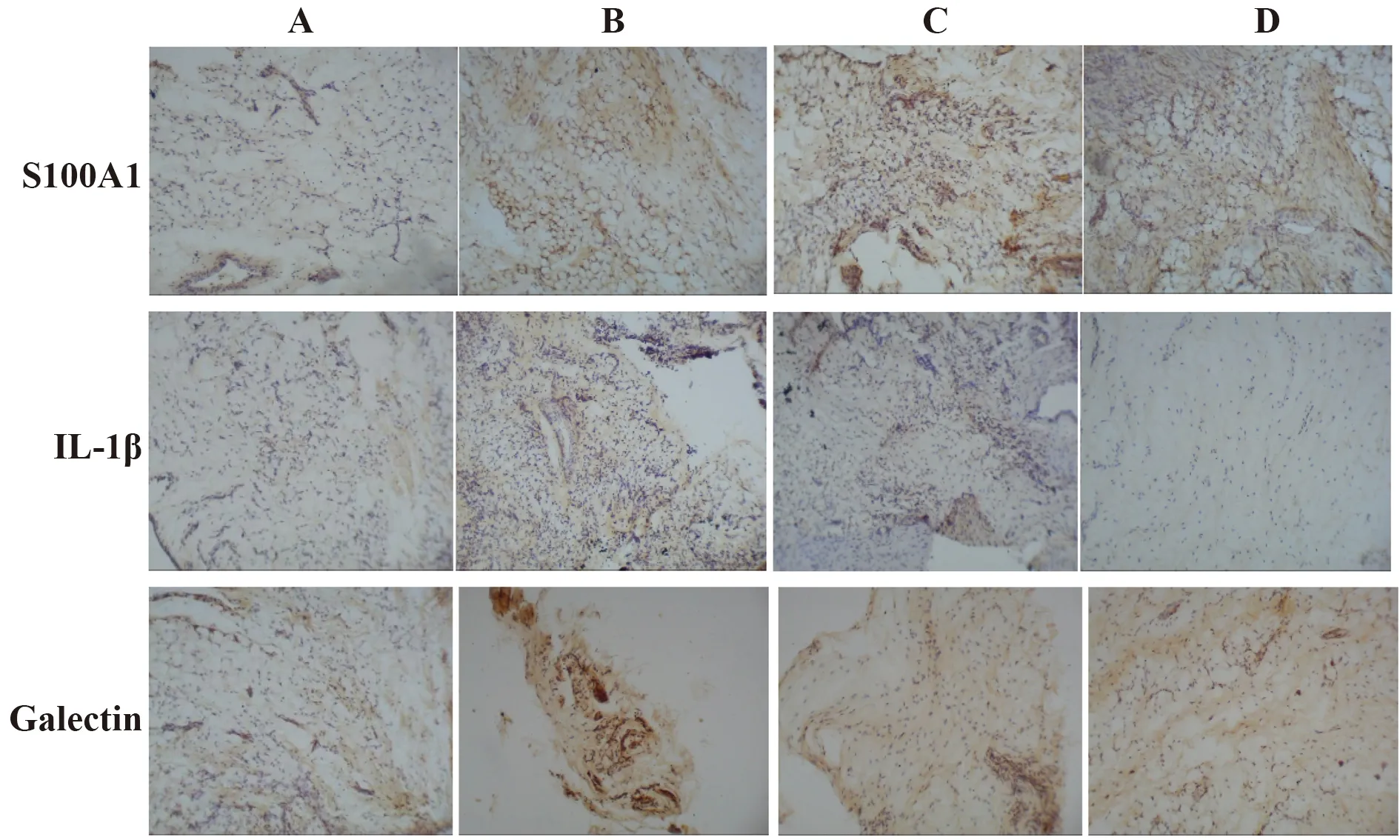
图4 各组大鼠滑膜组织细胞中S100A12、IL-1β、Galectin-3显微镜下观察(×200)Fig.4 Observation of S100A12,IL-1β,Galectin-3 in synovial cells of rats in each group under microscope(×200)Note:A.Normal control group;B.Model control group;C.Catalpol low dose group;D.Catalpol high dose group.
2.3免疫组化法检测各组大鼠滑膜组织中S100A12、IL-1β、Galectin-3表达 正常对照组大鼠滑膜组织中S100A12、IL-1β、Galectin-3水平较低,模型对照组大鼠滑膜组织中S100A12、IL-1β、Galectin-3水平较正常对照组明显升高(P<0.01);地黄梓醇低剂量组大鼠滑膜组织中S100A12、IL-1β、Galectin-3水平较模型对照组有所降低(P<0.05);地黄梓醇高剂量组大鼠滑膜组织中S100A12、IL-1β、Galectin-3水平较模型对照组明显降低(P<0.01),见表1。
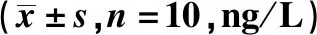
表1 免疫组化法检测各组大鼠滑膜组织中IL-1β、Galectin-3、S100A12水平表达Tab.1 Expressions of IL-1β,Galectin-3 and S100A12 in synovium of rats in each group was detected by
3 讨论
膝骨关节炎是中老年的常见病和多发病,病理学特征为进行性加重的关节软骨退化、骨赘形成、软骨下骨囊肿、关节间隙变窄和关节组织间歇性炎症反应等[15,16]。膝骨关节炎患者的主诉是反复加重性关节疼痛,严重降低患者的日常生活活动能力和生活质量[17]。目前膝骨关节炎的保守治疗策略都是基于消炎镇痛药的症状管理,尚无药物可影响疾病进展的研究[18]。在膝骨关节炎发病的各种原因中,炎症是软骨代谢途径失衡的最重要因素,导致机体失衡和细胞外基质的降解[19]。此前本课题组围绕致炎因子与膝骨关节炎、髋骨关节炎的病情进展进行了大量临床研究[20-22]。
有研究表明炎症反应可能在膝骨关节炎患者的疼痛发展中起重要作用,局部非甾体类抗炎药被国际骨关节炎研究协会(OARSI)指南推荐用于所有膝骨关节炎患者[17]。据报道,在安大略省西部和麦克马斯特大学骨关节炎指数中,滑膜炎与膝关节疼痛严重程度密切相关[23,24]。同时,在纵向研究中,Zhang等[25]发现骨髓病变和滑膜炎的变化与膝关节疼痛的波动有关,当骨髓病变较小时疼痛缓解的频率更高。数据表明,滑膜组织和软骨下骨受损时可能在确定膝关节疼痛的波动中起关键作用。有研究表明滑膜组织中S100A12、IL-1β、Galectin-3 3种致炎因子在早期膝骨关节炎疾病进展过程中起重要作用[26-28]。
本课题组曾研究过膝骨关节炎患者血液及关节外组织中分泌的S100A12进入血液循环后,可到达患者的关节周围组织,如滑膜,促发滑膜炎;与既往研究类似,S100A12具有炎症趋化作用,参与滑膜炎症损伤,进而导致软骨及关节骨破坏和骨增生;且患者骨关节炎严重程度与S100A12的表达呈正相关[21]。本课题组之前研究显示髋骨关节炎患者具有相同的临床实验结果[22]。临床研究发现IL-1β在膝骨关节炎患者关节软骨中大量表达[29]。实验研究发现IL-1β水平越高其骨关节炎严重程度越高[30]。有研究表明Galectin-3是关节内炎症调节剂,可通过促炎作用加速骨关节炎进展[31,32]。同时实验研究表明Galectin-3水平越高,骨关节炎越严重[33]。S100A12在炎症环境下可驱动膝骨关节炎中IL-1β水平升高[34]。有研究表明Galectin-3是细胞中IL-1β介导的炎症反应放大器[35]。促炎细胞因子IL-1β表达可影响Galectin-3水平而加速依赖性小梁骨丢失和骨强度降低,加速膝骨关节炎进展[36]。
地黄是传统四大怀药之一,熟地黄主归肝、肾两经,具有补阴血、益肾精的功效。《本草纲目》中“填骨髓、长肌肉、生精血”的描述肯定了熟地黄对筋骨肌肉虚劳诸证的补益作用。目前熟地黄在临床上已被广泛用于炎症治疗[37]。地黄梓醇是从地黄中提取的一种环烯醚萜苷化合物,2015 版《中国药典》明确规定地黄梓醇作为地黄质量控制的指标[38]。地黄梓醇的药理作用包括抗细胞凋亡、抗炎等,但缺少相应的基础研究支持[39]。本实验通过研究不同浓度地黄梓醇对木瓜蛋白酶诱导的大鼠膝骨关节炎模型滑膜中S100A12、IL-1β、Galectin-3的表达水平,结果表明不同浓度地黄梓醇均能降低膝骨关节炎大鼠滑膜组织中IL-1β、Galectin-3、S100A12表达,且地黄梓醇高剂量组较低剂量组效果更为明显,地黄梓醇通过抑制早期膝骨关节炎大鼠炎症因子的释放阻止软骨基质降解,延缓膝骨关节炎的进展。
基于本课题组既往临床试验研究结果,本次实验取得了以下新进展:①本次动物实验结果再次证实炎症细胞因子S100A12表达与早期膝骨关节炎具有相关性;②实现了从单个炎症细胞因子S100A12水平的研究到多个炎症细胞因子S100A12、IL-1β、Galectin-3水平研究;③将传统中药地黄应用于实验研究,并探讨地黄梓醇对于早期膝骨关节炎治疗的可行性。完善了临床研究的不足,同时完善了目前地黄临床应用缺乏相应基础研究支持的不足。基于以上研究及目前膝骨关节炎治疗现状,课题组将进一步研究以中医理论“肾主骨”和“治肾亦治骨”为指导,参照《中药新药临床研究指导原则》将膝骨关节炎进行分型,不同证型采用不同中医经典方剂的临床研究。本实验不足之处在于未阐明地黄梓醇膝骨性关节炎治疗的最佳浓度及地黄梓醇是否可促进软骨修复及改善关节生理功能。因此将进一步探究地黄梓醇对早期膝骨关节炎信号通路的影响及以地黄为君药的方剂临床研究。