24-表油菜素内酯对高山离子芥悬浮细胞抗寒性的影响
刘亚洁, 安黎哲
(1. 兰州大学草地农业生态系统国家重点实验室 兰州大学农业农村部草牧业创新重点实验室兰州大学草地农业教育部工程研究中心 兰州大学草地农业科技学院, 兰州 730020; 2. 兰州大学 生命科学学院, 兰州730000)
低温是影响和限制植物生长最重要的环境因子之一,植物对低温的响应涉及不同水平上结构和功能的变化。在低温胁迫下,植物细胞会通过积累渗透调节物质、调节细胞渗透平衡以缓解低温对植物体造成的损伤,提高植物的抗寒性[1-2]。脯氨酸、可溶性蛋白和可溶性糖是植物细胞内重要的渗透调节物质,这些物质的含量与植物的抗寒性密切相关。苯丙氨酸解氨酶(Phenylalanine ammonia-lyase, PAL)广泛存在于各种植物和少数微生物中,是苯丙烷类代谢的关键酶和限速酶,研究发现低温可以诱导PAL活性升高[3]。此外, 低温胁迫诱导了一些基因的启动和大量表达,这些基因称为冷诱导基因(Cold-induced genes)或冷调节基因(Cold-regulated genes or cold-responsive genes,COR),它们在提高植物耐低温能力方面发挥重要作用。
油菜素内酯(Brassinosteroids, BRs)是一类甾醇类植物激素,在植物界中普遍存在,其中24-表油菜素内酯(24-epibrassinolide, EBR)是使用最多、用途最广泛的一种[4]。BRs对植物许多生理反应起重要作用,如根的延长、花粉管生长、叶的卷曲和偏上性生长、根部生长抑制、诱导乙烯生物合成、激活质子泵、木质部分化以及核酸和蛋白质的合成[5-6]。BRs还可以缓解逆境胁迫对植物造成的伤害,提高植物对逆境胁迫的抗性,特别是在提高植物耐冷性方面表现出了良好的效果[7-8]。然而,关于极端低温胁迫(0 ℃)下BRs对植物细胞的影响少有研究。本试验以高山离子芥(Chorisporabungeana)悬浮细胞作为一个未分化的、均一的、相对脆弱的植物细胞模型来研究低温胁迫下BRs对悬浮细胞的渗透调节物质、PAL活性以及冷调节基因CbCOR15表达水平的影响,从而在细胞水平上阐明BRs影响植物响应低温胁迫的部分生理及分子机制。
1 材料与方法
1.1 试验材料
高山离子芥取材于新疆天山乌鲁木齐河源区,悬浮细胞的培养参照Guo等[9]的方法。
1.2 试验设计
将悬浮培养好的处于指数生长期的同一批材料转接于加入0.1 μmol/L EBR的MS液体培养基中,常温处理3 d后,立即置于0 ℃低温光照培养箱中摇床培养处理1~5 d,摇床转速为120 r/min,每天取样1次,以不加EBR的细胞为对照。研究EBR对CbCOR15基因表达的影响时取样时间为低温处理1、3、6、9、12、24、48、72、96和120 h,以不加EBR的细胞为对照。除处理时间外,其他环境条件均一致。处理结束后,按照Ishikawa等[10]提供的方法用400目双层筛网过滤细胞,用蒸馏水清洗3遍,用滤纸吸干表面水分,鲜样称重,测定以下各生理指标。
1.3 测定项目与方法
1.3.1 生理生化指标测定
脯氨酸、可溶性蛋白、可溶性糖含量和PAL活性的测定参照李合生等[11]的方法。
1.3.2CbCOR15基因的表达分析
1)总RNA提取及反转录。采用Trizol法提取总RNA。取2 μL RNA在1.0%的Agarose胶上跑电泳检测,其余-70 ℃保存或者直接以总RNA为模板,用引物oligdT进行反转录得到相应的cDNA,放置于-20 ℃冰箱中备用。
2)基因扩增引物序列。根据离子芥CbCOR15基因(基因登记号:EF208112)设计特异引物:上游引物:5′-CGCAAGAAGTCGTCGTT-3′,下游引物:5′-GTGGCATCCTTAGCATCT-3′。同时根据已知的高山离子芥Actin基因(基因登记号:AY825363)设计特异引物作为内参,来调节每个样品中的RNA含量。上游引物:5′-ATACGCTCTTCCACACGCTATTC-3′,下游引物:5′-TCACGATTTCACGCTCTGCT-3′。
3)实时荧光定量PCR检测。按SYBR Premix ExTaq(TaKaRa)操作手册的要求在Multicolor Real-Time PCR Detection System(Bio-Rad)上进行实时荧光定量PCR检测。离子芥CbCOR15基因的扩增程序为95 ℃预变性10 s;95 ℃变性15 s,55 ℃退火20 s,72 ℃延伸20 s,共进行40个循环。高山离子芥Actin基因的扩增程序为95 ℃预变性10 s;95 ℃变性5 s,59 ℃退火及延伸20 s,共进行45个循环。
4)标准曲线的绘制。以梯度稀释的cDNA为模板进行与样本条件相同的实时荧光定量PCR反应,用仪器配套软件绘制标准曲线。
1.4 数据分析
所有试验至少重复3次,用SPSS 19.0对试验数据进行统计和方差分析,用Origin 9.0绘制数据图。
2 结果与分析
2.1 低温胁迫下EBR对细胞脯氨酸含量的影响
如图1所示,在0 ℃胁迫下,对照细胞脯氨酸含量呈缓慢上升趋势,在第5天又有所下降,经过EBR处理的细胞脯氨酸含量在前3天显著上升,虽然在第4天和第5天有所下降,但比未处理的对照分别提高了29.11%和46.26%。
2.2 低温胁迫下EBR对细胞可溶性蛋白含量的影响
如图2所示,在0 ℃胁迫下,EBR处理的细胞和未经过EBR处理的对照细胞中可溶性蛋白含量均呈先上升后下降的趋势,EBR处理的细胞中可溶性蛋白含量显著增加,虽然在低温处理第5天时,可溶性蛋白含量有所下降,但比对照提高了21.00%。
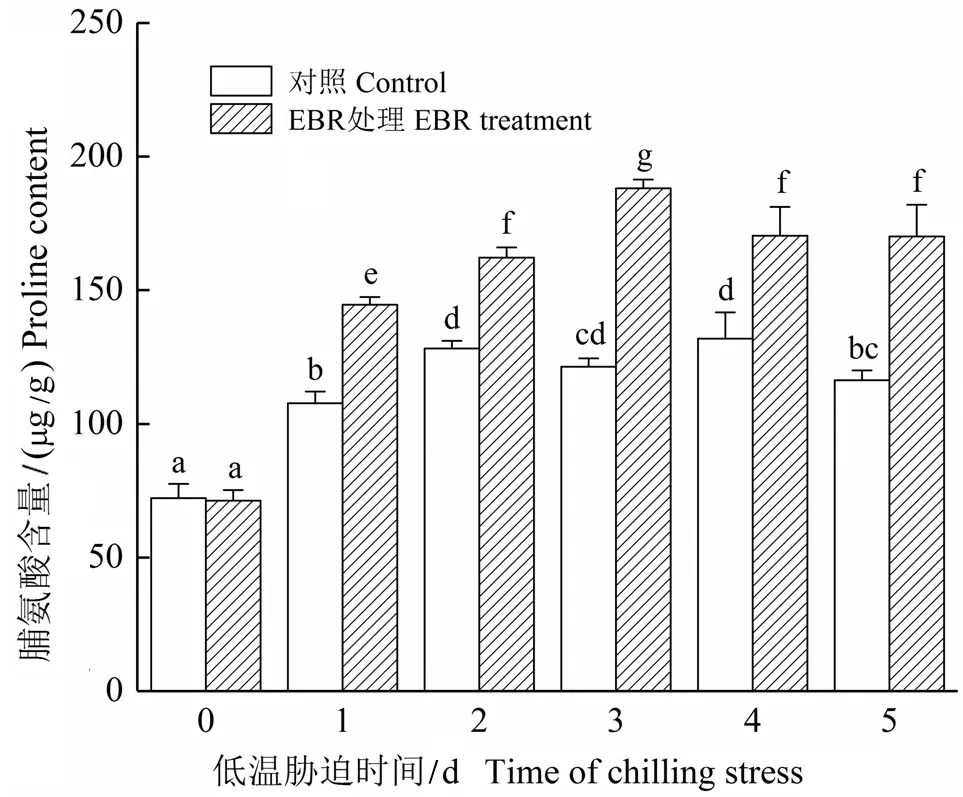
注:图中数据为平均数±标准差(SD);柱上不同字母表示经Duncan法检验在P<0.05水平差异显著;下同
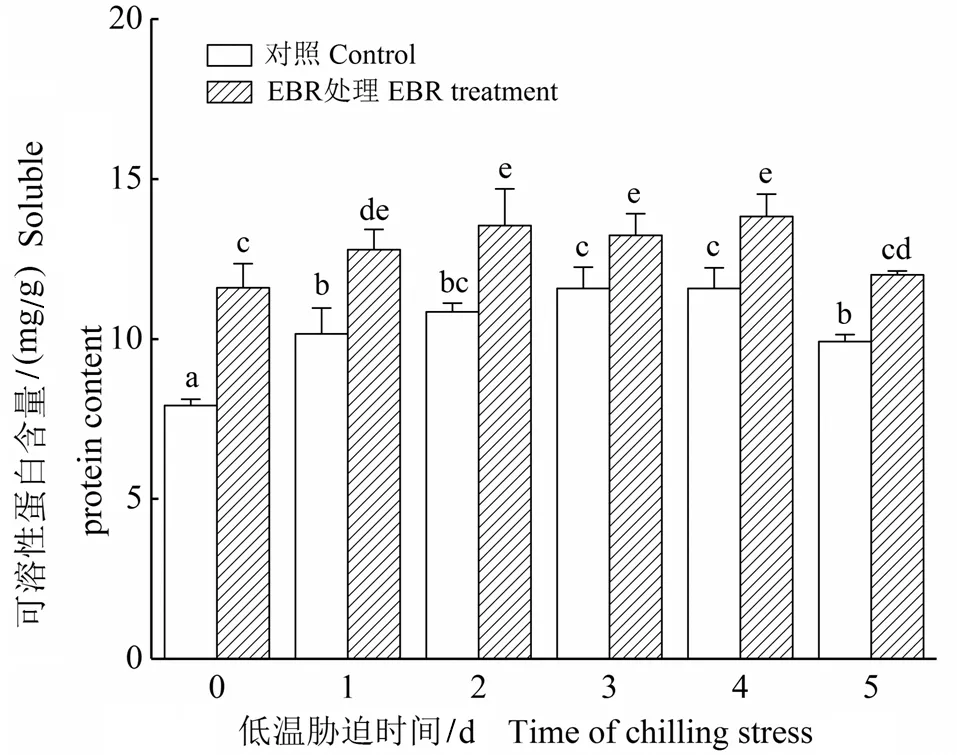
图2 低温胁迫下EBR对高山离子芥悬浮细胞可溶性蛋白含量的影响
2.3 低温胁迫下EBR对细胞可溶性糖含量的影响
如图3所示,在低温胁迫前4天,EBR处理可以明显提高细胞可溶性糖含量,到第5天EBR处理和未经过EBR处理细胞的可溶性糖含量没有明显差异。未经过EBR处理细胞的可溶性糖含量在低温胁迫前3天没有变化,到第4天呈上升趋势。经过EBR处理细胞的可溶性糖含量在前4天呈明显上升趋势,在第5天时又有所下降。
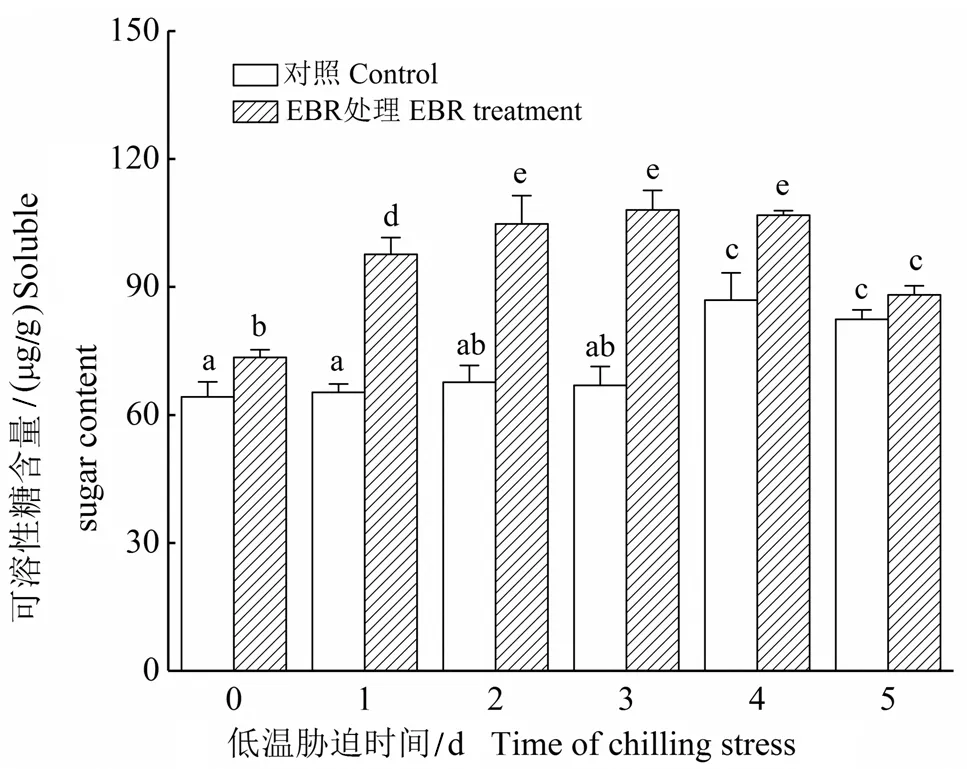
图3 低温胁迫下EBR对高山离子芥悬浮细胞可溶性糖含量的影响
2.4 低温胁迫下EBR对细胞PAL活性的影响
图4显示了在0 ℃低温胁迫下EBR处理对悬浮细胞PAL活性的影响。对照细胞的PAL活性在低温胁迫前4天缓慢上升,第5天恢复到正常水平(0天);EBR处理明显提高了悬浮细胞的PAL活性,尤其是在处理后的第4天达到最大值,比对照提高了174.01%,处理后第5天细胞的PAL活性比对照提高了478.60%。
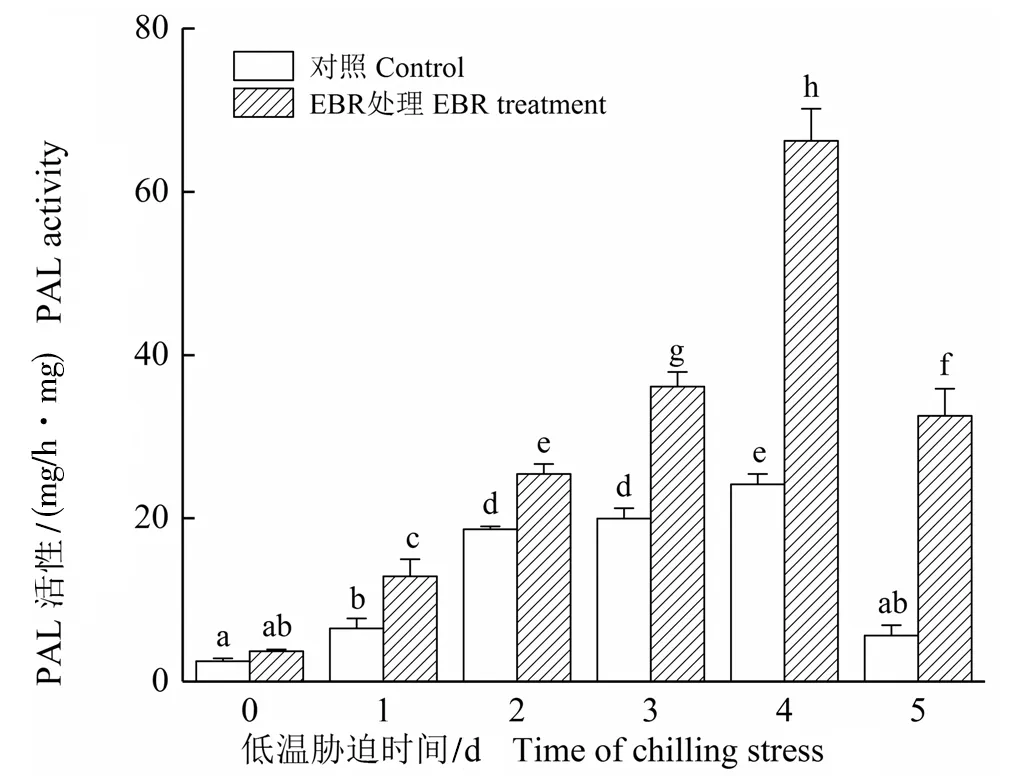
图4 低温胁迫下EBR对高山离子芥悬浮细胞PAL活性的影响
2.5 低温胁迫下EBR对细胞CbCOR15基因表达的影响
如图5所示,0 ℃低温胁迫诱导了对照细胞CbCOR15基因在短时间内大量表达(1~24 h),随后呈缓慢上升的趋势。在低温胁迫初期(1~12 h),EBR处理的细胞中CbCOR15表达量显著高于对照,随着胁迫时间的延长,EBR处理并没有提高CbCOR15基因的表达量,对照和EBR处理细胞的CbCOR15表达量没有显著差异。
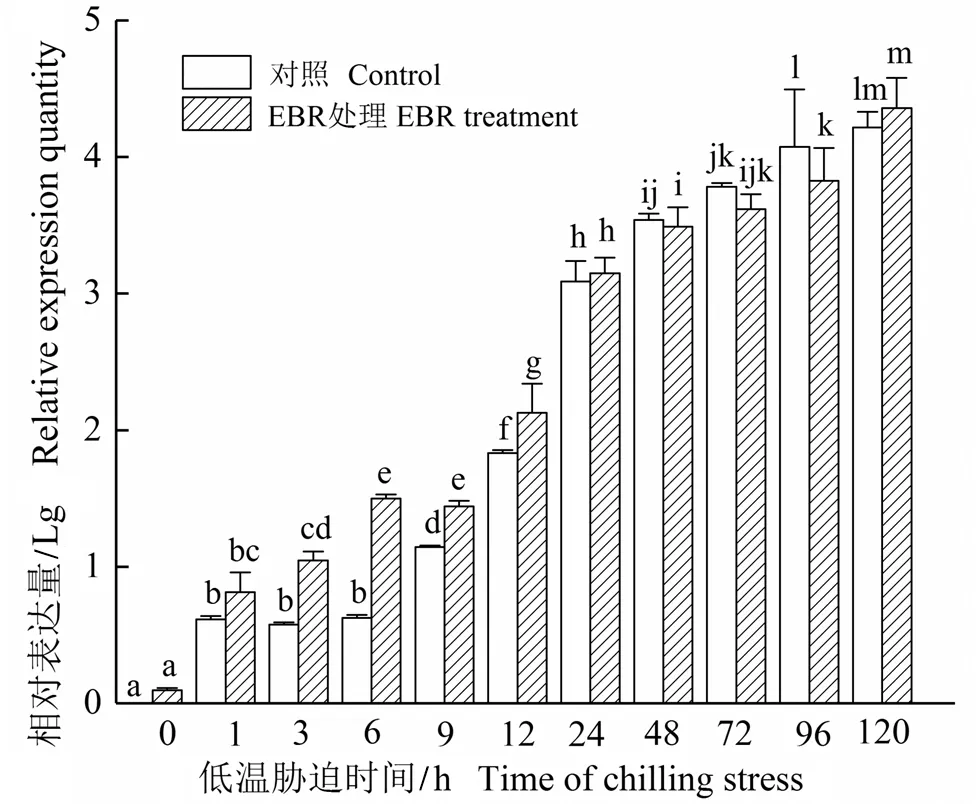
图5 低温胁迫下EBR对高山离子芥悬浮细胞CbCOR15基因表达的影响
3 讨论与结论
在本研究中,低温胁迫促进了对照细胞和EBR处理细胞脯氨酸、可溶性蛋白和可溶性糖含量的上升,但在EBR处理的细胞中,这3种渗透调节物质含量升高的程度明显高于对照(图1~图3)。以上结果与前人[12-14]在其他植物上的研究结果相一致。EBR处理可以增强低温胁迫下细胞积累渗透调节物质的能力,增强细胞的渗透调节功能,防止细胞过度脱水,缓解低温对植物细胞造成的损伤,从而提高植物的抗寒能力。近几年的研究[15]发现,脯氨酸可以稳定生物膜的结构和功能,还可以清除活性氧,是羟基自由基清除剂。EBR处理可以清除冷害所造成的活性氧自由基大量积累,缓解氧化损伤[14]。本研究中,EBR诱导低温胁迫下脯氨酸大量积累,EBR清除活性氧的生理功能可能与其对脯氨酸的调节有关。
PAL在植物形成次生物质如木质素、植保素等方面起重要作用,对植物生长发育、抵御病虫害、防紫外辐射及构成植物支撑系统等方面具有重要意义[16]。此外,许多植物在遭受到低温、高温、干旱、机械损伤及紫外辐射时,植物的防卫系统特别是苯丙烷类代谢被激活,PAL活性也会迅速上升,因此PAL活性可以作为植物抗逆境能力的一个生理指标[3]。本研究结果表明EBR处理可以明显提高悬浮细胞PAL活性,这种促进效应在0 ℃低温胁迫后期表现得尤为显著(图4),这表明EBR可以通过提高植物的PAL活性来增强植物对低温胁迫的抗逆性。目前,BRs对PAL活性的影响多局限于对病原体胁迫的研究中,BRs可以提高植物对病原体胁迫的抗性,这与BRs处理激活PAL活性有关[17-18]。可见,BRs提高植物抗寒性和抗病性的机制存在一定的相似性,都有可能通过激活植物的苯丙烷类代谢防卫系统来增强植物对逆境胁迫的抗性。
经过长期的研究,大量冷调节基因被分离并鉴定出来。在众多的冷调节基因中,对拟南芥AtCOR15a的研究比较深入和系统。AtCOR15a编码的多肽具有两亲性的α-螺旋结构域,有可能通过影响膜磷脂层内部的弯曲性来减少膜遇冷时所产生的由脂双层向六角形HII相位转变的发生率,从而稳定膜结构以抵抗由于低温或冰冻等引起的细胞脱水而造成的膜伤害[19]。高山离子芥CbCOR15基因编码的亲水性多肽也具有类似的功能[20]。在本研究中,低温胁迫可以诱导CbCOR15大量表达,EBR处理可以明显提高低温胁迫最初期(1~12 h)CbCOR15基因的表达水平(图5),从而在低温胁迫一开始就防止细胞膜六角形HII相位的产生,这有利于稳定细胞的膜结构和功能,从分子水平上提高植物的抗寒能力。
综上,在低温胁迫下,EBR处理通过提高高山离子芥悬浮细胞中渗透调节物质的含量,促进PAL活性的升高以及诱导CbCOR15基因大量表达来增强其抗寒性。本研究结果可为合理利用外源EBR提供一定的理论依据和技术支持。

