白藜芦醇对线粒体质量调控研究进展
张 虎, 梁计陵, 钱帅伟, 蒋留军, 陈 宁
(1. 武汉体育学院 研究生院, 武汉 430079; 2. 武汉体育学院 健康科学学院, 武汉 430079; 3. 复旦大学附属华山医院北院, 上海 200040; 4. 武汉体育学院 健康科学学院 运动训练监控湖北省重点实验室 天久运动营养食品研发中心, 武汉 430079)
白藜芦醇,又称3,5,4′-三羟基芪,分子式为C14H12O3,相对分子量为228.25。Res作为广泛存在于植物中的非黄酮类多酚,在葡萄、桑葚、花生等植物中均有存在,且具有抗肿瘤、保护心脑血管和免疫调节等作用[1]。Res自1939年在白藜芦的根部被发现继而被提取,有顺、反结构之分,因反式结构相对稳定而被广泛使用。在小鼠急性口服15 g/kg体重和大鼠90 d [167~500 mg/(kg·d)]的大剂量Res干预中,均未发现急性和遗传毒性[2]。随着研究的深入,Res在调控线粒体异常导致的疾病和抗衰老等方面逐渐成为研究热点。
线粒体作为具有独立遗传基因的双层膜结构细胞器,普遍存在于绝大多数真核细胞中,通过三羧酸循环和氧化磷酸化为机体提供大部分能量。线粒体参与细胞内众多生理活动,如细胞增殖、分化、衰老和凋亡等。然而,当线粒体功能受损破碎、ATP合成与呼吸减少、膜电位降低、氧化应激水平升高时均会诱导线粒体质量异常而加速衰老和疾病的进展[3-4]。此外,异常的线粒体形态学改变甚至会严重影响线粒体功能和线粒体自噬活性,导致异常线粒体的过度堆积而诱发细胞凋亡。随着研究的增加,Res可能作为一种有效的干预方式,通过调控线粒体的生物合成、分裂与融合、线粒体自噬等途径来改善线粒体质量。本文主要从Res在线粒体质量调控中的作用和使用剂量进行系统综述,为更好地使用Res调控线粒体质量缓解代谢、神经相关疾病提供一定的理论参考(图1)。
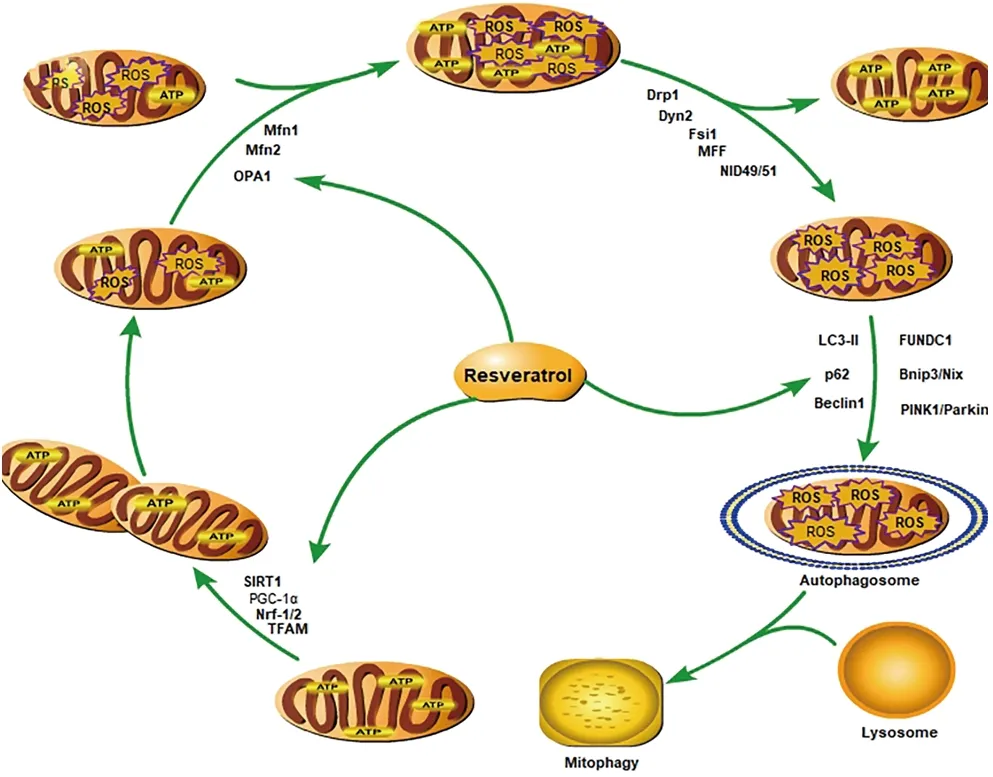
图1 Res在线粒体质量调控中的作用
1 线粒体质量控制
线粒体作为细胞内主要的能量转换器,可通过调节自身的生物合成、融合与分裂,以及清除衰老和损伤线粒体而达到维持线粒体数量和质量的作用。线粒体质量控制主要通过线粒体的生物发生产生功能良好的新生线粒体,而损伤的线粒体则通过彼此间的融合后分裂产生健康和待清除的线粒体,以便及时清除异常线粒体而减少对细胞正常功能的影响。其中,机体能量需求旺盛会诱导线粒体的生物合成的发生,而过氧化物酶体增殖物激活受体γ共激活因子-1α(Peroxisome proliferators-activated reptory coactivator-1α,PGC-1α)在线粒体生物发生过程中扮演着重要的角色,可提高线粒体DNA(mtDNA)水平和线粒体数量。线粒体的融合与分裂过程是线粒体动力学主要部分,并由一系列蛋白参与调节线粒体膜结构的运动,如视神经萎缩症蛋白1(opticatrophy 1, OPA1)、线粒体融合蛋白1和2(mitofusion 1/2, Mfn 1/2)、线粒体动力相关蛋白1(dynamin-related protein 1, Drp 1)、动力学蛋白2(dynamin-2, Dyn 2)、线粒体分裂蛋白1(fission 1, Fis1)等。而线粒体膜结构的破坏会引起线粒体间隙或基质中促凋亡因子的释放,会诱导细胞凋亡的发生,如细胞色素C(Cytochrome c,Cyt-c)等。线粒体分裂出的异常线粒体通过自噬途径进行降解,健康线粒体则继续参与正常的生理活动。在线粒体自噬的过程中,由线粒体诱导的自噬标记、自噬囊泡的包裹和与溶酶体结合来完成,主要由BNIP3(BCL2/adenovirus E1B 19 ku interacting protein 3, BNIP3)/Nix(NIP3-like protein 3, Nix)、PINK1(PTEN-induced putative kinase protein 1, PINK1)/Parkin(Parkin protein, Parkin)、FUN14结构域包含蛋白-1(FUN14 domain containing 1, FUNDC1)、微管相关蛋白1轻链3(Microtubule associated protein 1 light chain 3,LC3)、p62(Sequestosome 1, p62)等线粒体自噬关键调节蛋白完成。
2 Res在调控线粒体质量中的相关机制
Res作为一种植物次生代谢产物,其抗氧化、抗衰老以及提高运动能力等作用可能是通过改善机体线粒体质量而实现,且在线粒体的各个阶段均存在积极的调控作用而有利于体内线粒体的及时更替。
2.1 Res与线粒体的生物发生
新生线粒体形成过程即线粒体的生物发生,主要由细胞核基因与mtDNA相互作用共同组成。而PGC-1α作为线粒体生物发生的重要调节蛋白,能够促进核基因与mtDNA转录来协调线粒体生物发生。正常表达的PGC-1α可提高如核转录因子NF-E2相关因子1/2(Nuclear respiratory factor-1/2, NRF1/2)和线粒体转录因子A(Mitochondrial transcription factor A, TFAM)等转录水平而促进线粒体生物发生。而钝化PGC-1α蛋白会导致线粒体基因表达降低、活性下降并出现线粒体机能不良。虽然目前研究发现PGC-1α在人、小鼠和大鼠的不同肌纤维中存在差异,但值得注意的是PGC-1α蛋白水平通常与线粒体数量成正比。
随着研究增多,发现Res在促进线粒体生物发生中具有与运动训练相似的效果。Res可通过激活PGC-1α信号通路提升Nrf-1、TFAM、mtDNA等水平参与线粒体生物发生的调控[5]。相关RNA-seq分析也显示出Res导致的转录本变化与mtDNA存在密切关联[6]。Res作为SIRT1(Silent mating type information regulation 2 homolog-1, SIRT1)的激活剂可通过SIRT1/PGC-1α通路参与线粒体生物发生的调节。Res还可通过影响miR-27b水平来激活SIRT1参与调节线粒体质量控制[7]。但SIRT1基因敲除相关实验发现,适量的Res的添加似乎可以独立于SIRT1而达到促进线粒体的生物发生的作用[8]。但目前所了解的Res促进线粒体的生物发生主要与SIRT1/PGC-1α途径有关,而通过Res诱导miRNA和独立于SIRT1在促进线粒体生物发生的相关研究报道有限,还有待进一步研究。
2.2 Res与线粒体的融合与分裂
线粒体的融合与分裂即两个线粒体的结合与单个线粒体分为两个的过程,也是线粒体动力学的主要组成部分。线粒体融合由Mfn1和Mfn2连接两个独立的线粒体完成线粒体外膜融合,OPA1诱导内膜融合。Drp1在线粒体分裂时主要负责线粒体分裂过程的形态改变,最终由Dyn2完成线粒体分裂。研究发现在神经、代谢以及癌症中均出现线粒体动力学的异常改变,同时也可能是相关疾病的潜在治疗靶点。如肥胖和2型糖尿病患者骨骼肌线粒体Mfn2的表达降低,肿瘤细胞Drp1异常活跃导致的线粒体分裂增加,并且Drp1、Mfn1/2和OPA1与神经系统病变也存在紧密联系[9-10]。
相关实验表明Res可通过TyrRS/PARP-1分子通路和提高线粒体融合相关蛋白(如Mfn1/2、OPA1)达到抑制线粒体断裂的作用[11]。Res以依赖Drp1的方式改善了衰老心机细胞线粒体的延伸,且通过调节线粒体动力学缓解氧化应激导致的线粒体损伤[12]。同时,Res还可通过上调线粒体融合相关蛋白的表达以减少细胞凋亡而缓解疾病进展[13]。如在视网膜损伤中通过增加SIRT1、OPA1和Fis1 mRNA水平调节线粒体质量达到改善视力的作用[14],以及通过调控线粒体动力学改变而逆转衰老以及干细胞活力的下降[15]。但是也有研究发现,Res可抑制线粒体的过度融合与分裂的发生。例如,抑制糖尿病小鼠骨骼肌线粒体的融合与分裂以及自噬异常[16]。也可通过激活miR-326/pkm2诱导线粒体过度分裂,甚至凋亡的发生[17]。
由上可知,Res可通过上调线粒体融合相关mRNA和蛋白促进线粒体融合的发生,而单一的线粒体融合促进并不一定有利于细胞功能改善。也有文献[18-19]报道,Res在癌症相关治疗中可促进线粒体分裂导致癌细胞凋亡的发生,其主要原因可能是Res的使用和剂量存在模型差异。
2.3 Res调控线粒体自噬
线粒体自噬主要负责及时清除老化损伤的线粒体来保证细胞内线粒体质量以维持机体的正常运转。其中PINK1/Parkin通路和线粒体自噬介导受体Bnip3/Nix、FUNDC1等是诱导线粒体自噬的主要途径。线粒体自噬与机体能量供应和运动能力有着密切联系,当线粒体自噬发生障碍会导致受损线粒体的堆积和细胞凋亡的发生,甚至会诱导包括神经系统和骨骼肌等相关疾病的发生,如帕金森综合征、阿尔兹海默病等。线粒体的及时清除可降低ROS水平,预防炎症、Tau蛋白过度磷酸化以及β-淀粉样蛋白堆积等缓解神经细胞损伤[20]。
研究发现,Res在调控线粒体自噬中涉及多个分子信号通路,可明显促进细胞自噬水平的提升,同时检测到自噬相关蛋白表达的改变。例如,LC3-II/LC3-I、Parkin和Beclin1水平的显著增加和p62的减少等。在细胞培养实验中也发现Res的添加明显提高了LC3-II水平和自噬体的数量[21]。除此以外,Res还可通过激活SIRT1/PGC-1α/HIF-1α信号通路提升缺氧状态下自噬水平加速异常线粒体的清除,减少缺氧导致的线粒体功能障碍和细胞凋亡,以及Res通过p38和细胞外调节激酶(ERK)信号通路诱导自噬清除损伤线粒体达到保护细胞的作用[12]。值得注意的是Res明显改善心肌细胞线粒体异常堆积,但在衰老心肌细胞线粒体中却降低了Parkin和PINK1的磷酸化水平,甚至出现抑制LC3-II的增加[22]。因此,Res在不同组织或模型中线粒体自噬过程中可能存在差异性调控。但Res在如Bnip3/Nix、FUNDC1等介导的线粒体自噬过程中的作用鲜有报道,具体机制尚不清楚。
3 Res剂量对不同模型线粒体的相关影响
随着更深入的研究,科学家发现Res对线粒体在不同的组织和模型中的作用存在一定差异,可能也与使用剂量、给药方式以及辅助药物和运动有关。表1中选取部分相同组织,如在骨骼肌中Res可有效促进线粒体的生物发生、改善机体运动水平和抗衰老等作用,但未发现因饮食剂量过多而导致线粒体异常的报道。与此同时,在不同的病理模型中Res的作用也不同,如在糖尿病骨骼肌中有抑制自噬发生的作用,而在衰老性肌萎缩和杜氏肌营养不良小鼠的骨骼肌中又可改善线粒体自噬水平的低下,说明Res在不同的病理环境中的作用可能也存在差异,提示Res可能是一种自噬平衡的调节剂。在细胞培养中低剂量的Res可促进线粒体质量的改善,一旦超过一定的剂量范围则会导致细胞死亡的发生,且具有一定的剂量依赖性。有相关综述统计[23-24]显示:在细胞培养中Res浓度小于50 μmol/L,在胞内线粒体质量调控起到积极作用,但当浓度大于50 μmol/L时,则会导致线粒体损伤而诱导凋亡的发生;在神经细胞培养中加入Res超过50 μmol/L时仍存在积极作用,而且对不同分化程度的神经细胞作用效果也具有差异,可见其在神经组织中的使用剂量和作用仍需进一步探索。此外,在饮食和细胞培养中加入适量Res对神经细胞的凋亡有一定的改善作用,但从饮食、腹腔注射和细胞培养的Res介入剂量来看,相差巨大。而当Res在饮食干预时加入合适的生物碱类以及配合有氧锻炼与单独的Res相比,对线粒体质量控制表现出更佳的效果[25]。这可能与提高了生物利用率或起到一定的协助作用有关。Res也被认为具有独特的双重作用,对正常细胞有保护作用,但对肿瘤细胞具有毒性。可能与Res在改善线粒体质量的同时也有利于有氧呼吸供能,并非与癌细胞主要的糖酵解供能方式有关,而有氧呼吸的改善是否影响代谢途径达到间接抑癌作用还值得商榷[26]。但从目前的研究来看,使用Res来达到保健和防治疾病的作用可能需要根据疾病和个体吸收能力的不同进行用药量和入药方式的调整,以及配合适量的锻炼和协助药物的补充从而达到较好的效果。

表1 白藜芦醇剂量对线粒体质量控制的影响
4 小结与展望
Res在疾病预防与治疗的作用在不断被挖掘,其通过调控线粒体生成、融合与分裂和线粒体自噬来改善线粒体质量,因此Res可能通过调控线粒体质量在线粒体诱导的相关疾病和衰老中存在潜在治疗价值。但Res生物利用度较低,寻找增加机体吸收的辅助药物、运动方式和给药途径具有一定的现实意义。而在相关的研究中,Res的疗效差异可能主要是在使用剂量、动物模型以及干预时间等因素上存在差异。因此,筛选Res在调控线粒体质量中的靶基因、microRNAs和蛋白值得进行更深入的研究,这将有助于为线粒体异常导致的疾病提供精确的靶向干预疗法的开发。

