Cpf1核酸酶的原核表达、纯化及多克隆抗体制备与鉴定
董 彬, 王 君, 孙 静, 王报贵, 孙春龙, 吴 涛
(滨州学院 生物与环境工程学院 山东省黄河三角洲野生植物资源开发利用工程技术研究中心, 滨州 256603)
CRISPR-Cas是近年来研究发现在古细菌和细菌中用来抵抗外部核酸入侵的一类获得性免疫系统[1-2]。外部病毒首次侵入细菌,可使其DNA整合至宿主自身的CRISPR序列中,CRISPR序列转录后可以生成CRISPR RNA(crRNA),当与crRNA配对的外部DNA片段再出现时,Cas核酸酶能够切断这些DNA,并为细菌提供免疫保护作用[3-5]。到目前为止,CRISPR系统可以分为3大类型[6]:Ⅰ型、Ⅱ型和Ⅲ型,其中Ⅰ型和Ⅲ型在进行DNA剪切时,需要多种Cas蛋白参与,而Ⅱ型系统仅需一个Cas蛋白发挥作用即可。CRISPR/Cas9是第1个成功应用在基因编辑上的Ⅱ型CRISPR/Cas系统[7]。CRISPR/Cas9由一段带有与目的基因序列相同的guideRNA指引Cas9蛋白到达指定位置发挥作用,导致DNA双链破坏(Double strand break, DSB),利用生物体本身具有的非同源性末端接合(Non-homologous end joining, NHEJ)自身修复机制,在修复时引起碱基改变达到基因编辑的目的[8-9]。现已证实,CRISPR/Cas9可以在酵母菌、哺乳动物细胞、小鼠、果蝇、斑马鱼、拟南芥、水稻等多个物种中发挥基因编辑作用[9-17]。
CRISPR/Cpf1是2015年新发现的一种Ⅱ型系统[18],与CRISPR/Cas9相比,CRISPR/Cpf1系统具有许多优点[19-20]:1)只需一个协助RNA分子,Cas9需要2个RNA分子协助;2)Cpf1蛋白分子量相比Cas9蛋白较小,易于进入目标宿主;3)CRISPR/Cpf1具有独特的识别位点序列,能使脱靶率降低;4)剪切位置与Cas9不同,选择余地更大;5)产生黏性末端,便于新DNA序列插入。利用 CRISPR/Cpf1 进行操作的基本条件是:1)研究对象能高效表达Cpf1蛋白这一核酸切割“剪刀”;2)靶基因的原型间隔序列毗邻基序 PAM(Protospacer-adjacent motif)为 NGG,只要目的基因满足这一基本条件,就有可能利用这一系统对靶基因进行定点遗传操作。因此,制备高特异性和灵敏性的Cpf1核酸酶抗体研究其在不同生物体中的表达、分布以及定位,将会进一步推动CRISPR/Cpf1系统作为基因编辑工具的发展。目前,关于Cpf1核酸酶抗体的报道并不多见。本研究选用大肠杆菌作为宿主细胞,将LbCpf1核酸酶N端166个氨基酸的DNA编码序列进行重组表达,并利用6×His纯化标签得到重组蛋白作为抗原进行动物免疫,获得抗血清,并对纯化后的抗体特异性和灵敏性进行系统分析。
1 材料和方法
1.1 材料
1.1.1 菌株、质粒和动物
大肠杆菌EscherichiacoliXL1-blue、BL21(DE3)感受态细胞和pET28a质粒购自北京全式金公司。
1.1.2 主要试剂
核酸内切酶、T4 DNA连接酶、高保真DNA聚合酶和蛋白分子量Marker均购自美国Thermo Fisher公司;质粒提取、DNA凝胶回收相关试剂盒购自北京天根生化科技有限公司; DNA Marker购自北京全式金公司;Ni SepharoseTM6 Fast Flow蛋白纯化介质和Protein A SepharoseTM购自美国GE Healthcare公司;NC膜购自美国Pall公司;His抗体购自美国Sigma-Aldrich公司,HRP标记的羊抗兔抗体购自美国Jackson immunoresearch公司,ECL显色试剂购自美国Millipore公司。其他常规试剂均购自北京索来宝公司。
1.1.3 实验动物
免疫用新西兰大白兔2只,体重1.5~2.0 kg,由滨州畜牧兽医研究院提供。
1.2 方法
1.2.1 原核表达载体的构建
以pMAL-c2X-6His-Cpf1质粒为模板,扩增Cpf1基因N端166个氨基酸的DNA编码序列,通过EcoR I和XhoI进行双酶切并切胶回收,连接至同样双酶切回收后的pET28a(+)表达载体中,转化至大肠杆菌XL1-blue中,在含有卡那霉素的LB平板中过夜培养,从平板中挑取阳性克隆的单菌落进行培养并提取质粒,然后酶切、测序验证。
1.2.2 Cpf1(1-166)在大肠杆菌细胞内的条件改良
将重组质粒转入大肠杆菌BL21中,将阳性克隆挑至LB培养基中过夜活化,随后将菌液按照5%的添加比例加入新的LB培养基中,在37 ℃、200 r/min的条件下培养至对数期(OD600=0.6),然后分成2组,1组加入不同浓度(0.05~1.20 mmol/L)的IPTG继续培养12 h后收集菌体,另1组加入0.2 mmol/L的IPTG培养16 h,每2 h取1次样。将收集后的菌体进行SDS-PAGE蛋白电泳分析,并以未诱导的含pET28a(+)载体的大肠杆菌BL21(DE3)作为蛋白表达的对照。
1.2.3 融合蛋白6×His-Cpf1(1-166)的纯化
按照优化后的诱导表达条件培养含pET28a-Cpf1(1-166)重组质粒的大肠杆菌BL21,收集菌体后加入裂解液(50 mmol/L Hepes,0.5 mol/L NaCl,5 mmol/L MgCl2,1 mmol/L PMSF,10%甘油,20 mmol/L咪唑,4 mmol/L β-巯基乙醇,1 mg/mL溶菌酶,pH 7.4)冰上放置30 min后进行超声波破碎,12 000 r/min离心后收集上清液。使用5倍平衡柱体积的裂解缓冲液对Ni柱平衡,随后加入裂解后的上清液,4 ℃过夜结合,将结合后的上清液流出,使用5倍柱体积的裂解液将Ni柱漂洗3遍,最后用洗脱液(含500 mmol/L咪唑)洗脱,获得目的蛋白,使用Brand ford法对蛋白进行浓度分析。
1.2.4 多克隆抗体的制备
将新西兰大白兔饲养至10周大时开始免疫。首次免疫前,从兔子耳部取少量血样,作为后期实验中的阴性对照血清。首次免疫时,将纯化后的蛋白作为抗原取2 mg 与免疫用弗氏完全佐剂充分混匀,然后将动物颈背部毛发褪去,在皮下进行多点位注射,每只动物注射1 mg抗原,2周后进行1次加强免疫,抗原剂量相同,但使用弗氏不完全佐剂充分混匀,共加强免疫4次。最后1次免疫后,取少量血样进行效价测定,符合要求后,从动物股动脉取血,离心后除去血浆获得抗血清。
1.2.5 ELISA法测定效价
使用纯化后的蛋白作为酶标板的包被抗原,并用5%浓度的脱脂牛奶在37 ℃封闭1 h,用PBS溶液对抗血清进行分级稀释并加入酶标板孔内1 h,再加入稀释比为1∶20 000的HRP标记山羊抗兔二抗孵育1 h,最后加入TMB溶液显色,在450 nm下测定吸光值,抗血清OD450/对照血清OD450≥ 2.0则为阳性,阳性抗血清的最大稀释倍数即为效价。
1.2.6 抗血清的纯化
将获得的抗血清与预先使用结合缓冲液(12 mmol/L Na2HPO4,8 mmol/L NaH2PO4,pH 7.0)平衡过的Protein A抗体纯化柱在4 ℃结合4 h,随后使用3倍平衡柱体积的结合液漂洗2次,最后用洗脱缓冲液(0.1 mol/L甘氨酸,pH 2.7)进行洗脱,并用1 mol/L Tris-HCl(pH 9.0)缓冲液将洗脱组分pH值调至中性并保存在-80 ℃冰箱备用。
1.2.7 SDS-PAGE和Western Blot分析
取5 μL定量分析后的样品加入5 μL的2×蛋白上样缓冲液,混匀后在沸水中煮5 min,然后将20 μg样品加至15%的凝胶中,在150 V电压条件下电泳1.5 h,随后使用考马斯亮蓝染液直接对电泳后的凝胶进行分析或将凝胶表面蛋白在电流作用下转移至NC膜表面进行抗体杂交。以5%浓度的脱脂奶粉对印迹膜在室温下封闭1 h,然后用His 抗体(1∶2 000)或纯化后抗血清在室温下孵育1 h,再用TBST漂洗3次后,加入HRP标记的羊抗兔二抗在室温下孵育1 h并漂洗。最后用ECL发光液进行显影,化学发光扫膜仪进行拍照。
2 结果与分析
2.1 原核表达载体的构建及鉴定
使用EcoR I和XhoI酶切验证构建后的重组表达质粒pET28a-Cpf1(1-166),结果如图1所示,获得了498 bp的目的基因Cpf1(1-166),且测序正确,说明表达质粒构建成功。
2.2 Cpf1(1-166)在大肠杆菌细胞内表达的条件改良
根据表达后重组蛋白条带灰度分析,重组Cpf1(1-166)蛋白在大肠杆菌中成功表达,分子质量为20 ku,且IPTG的浓度变化对Cpf1(1-166)蛋白的表达水平并没有显著影响(图2)。以0.2 mmol/L IPTG进行蛋白诱导表达时间的优化时,每2 h取1次样品,设定诱导6 h的蛋白表达水平为100%, 8、10、12、14和16 h的重组表达量分别为251%、238%、236%、235%和233%(图3)。因此,表达Cpf1(1-166)的最佳条件为IPTG 0.2 mmol/L,诱导8 h。

1: pET28a-Cpf1(1-166) 质粒使用EcoR I和Xho I进行双酶切后的条带;M: DNA Marker
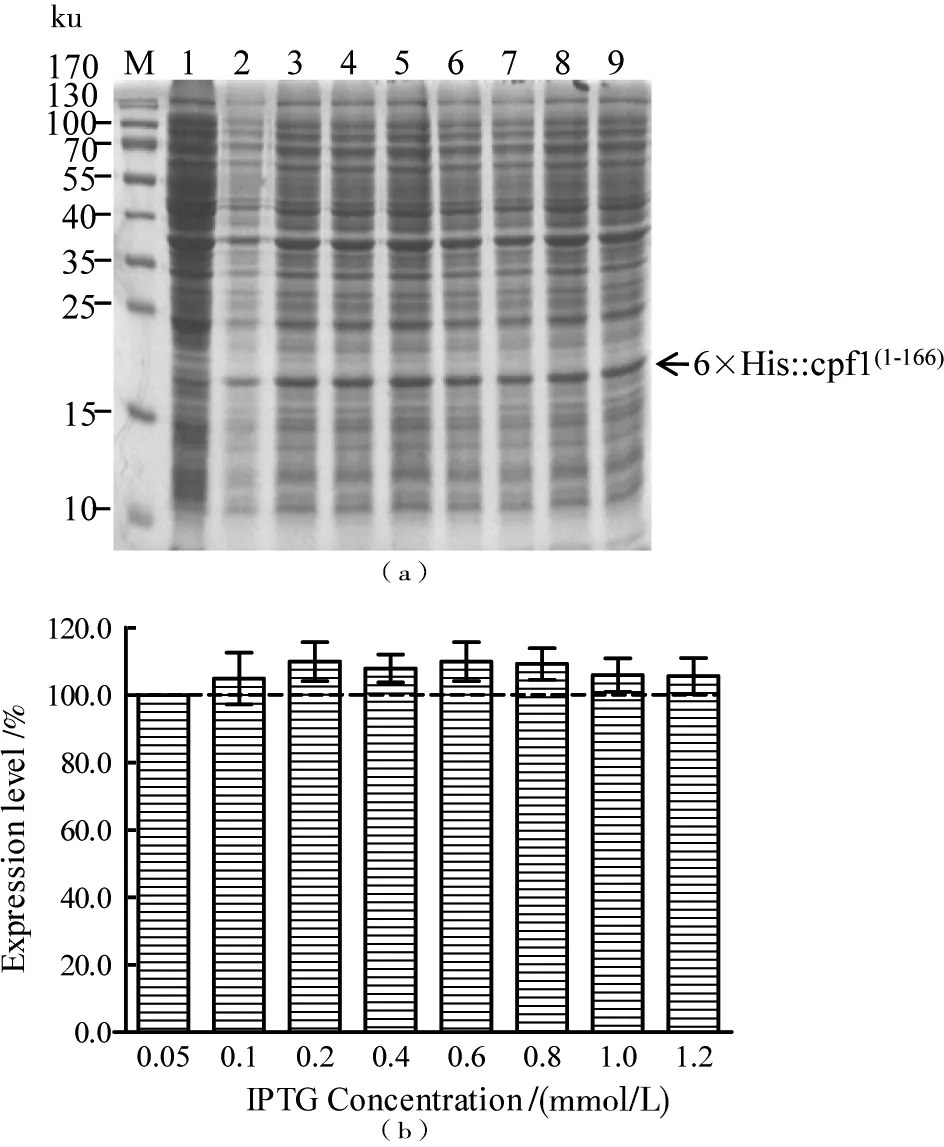
M:蛋白分子量Marker;1:未加入IPTG的空载体对照组菌体;泳道2、3、4、5、6、7、8和9分别为加入0.05、0.1、0.2、0.4、0.6、0.8、1.0和1.2 mmol/L IPTG诱导的菌体表达蛋白
2.3 重组蛋白的纯化及Western Blot分析
为了进一步分析重组表达蛋白的溶解性并进行纯化,使用优化后的培养条件对重组菌进行培养。结果显示重组Cpf1(1-166)蛋白以水溶性形式在大肠杆菌中存在[图4(a)],并且Western Blot分析显示重组蛋白为特异性表达[图4(b)]。利用Ni柱纯化获得的Cpf1(1-166)蛋白进行SDS-PAGE蛋白电泳和Western Blot,获得预期分子量大小的重组蛋白(图5)。
2.4 ELISA测定抗血清效价
将最后1次免疫后获得的动物血清样品梯度稀释后进行效价测定,在450 nm下测定吸光值,抗血清OD450/对照血清OD450≥ 2.0则为阳性,阳性抗血清的最大稀释倍数即为效价。由结果(图6)可知,1∶128 000为抗血清的效价。

M:蛋白分子量Marker;1:空载体对照组菌体;泳道2、3、4、5、6、7、8和9分别表示诱导时间为2、4、6、8、10、12、14和16 h的菌体表达蛋白

M:蛋白分子量Marker;1:未加入IPTG的空载体对照组菌体;2:诱导表达后全细胞裂解液组分;3:诱导表达后上清液组分;4:诱导表达后沉淀组分

(a)M为蛋白分子量Marker;1为纯化后的蛋白SDS-PAGE电泳分析。(b)1为纯化后蛋白Western Blot分析
2.5 多克隆抗体的特异性检测
以重组表达Cpf1(1-166)蛋白和Cpf1蛋白的大肠杆菌作为纯化后抗血清特异性检测的对象,分析其能否识别细胞中所表达的蛋白。Western Blot显示纯化后的抗血清可以识别大肠杆菌细胞内的Cpf1(1-166)和Cpf1蛋白(图7),分子质量符合预期大小,说明可以用于后续对Cpf1的研究。

图6 ELISA测定抗血清效价
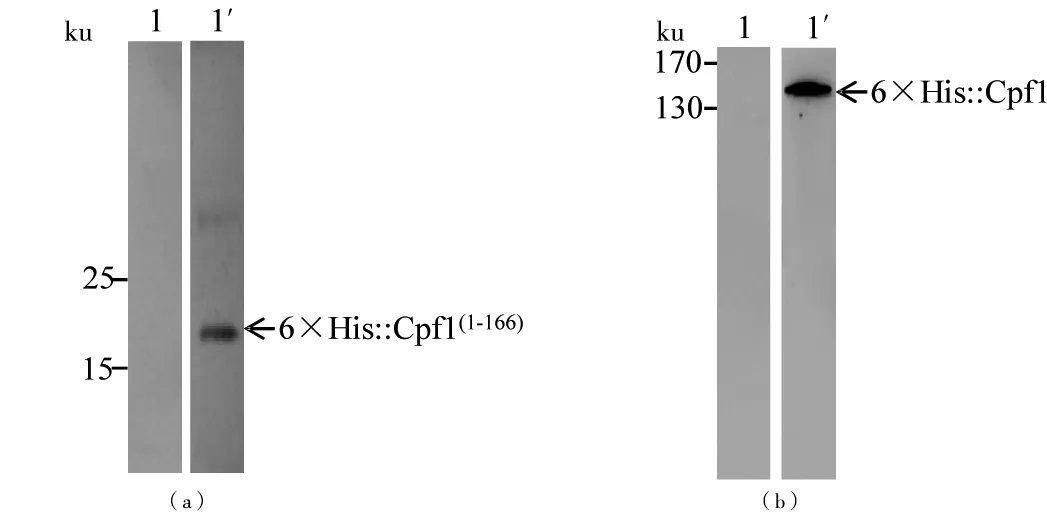
(a)检测抗血清对大肠杆菌细胞内Cpf1(1-166)的特异性结合,1:使用阴性血清检测组;1′:使用亲和纯化后的抗血清(1∶1 000)检测Cpf1(1-166)蛋白。(b)检测抗血清对大肠杆菌细胞内Cpf1的特异性结合,1:使用阴性血清检测组;1′:使用亲和纯化后的抗血清(1∶1 000)检测Cpf1蛋白
3 讨论与结论
CRISPR/Cpf1系统现已成功应用在多种动物、植物和微生物中进行基因组编辑,由于其系统组成更简单,编辑效率更高,脱靶率更低,因此,越来越受到研究人员的青睐。使用CRISPR/Cpf1系统的首要条件是细胞中得含有Cpf1核酸酶这一基因剪刀,目前往往通过在生物体中进行Cpf1的异源表达来满足,同时指导RNA在生物体胞内进行转录,指引Cpf1至特定位置来发挥基因编辑功能。所以,对于Cpf1核酸酶在生物体中的检测就显得至关重要,而基于抗原抗体结合的免疫分析检测是最常用和灵敏度较高的一类方法[21-22]。因此,具有高特异性和灵敏性的Cpf1核酸酶抗体制备就显得尤为重要。
在抗体的制备中,单克隆抗体由于特异性和灵敏度出色,受到普遍关注,但其制备成本昂贵,费时费力也是其较为突出的缺点。以新西兰大白兔和大鼠等作为免疫动物制备多克隆抗体的方法近年来应用较多,其具有成本低、时间短、实验技术要求低等特点,目前已有多种抗体已经被成功制备。大多数抗原的制备都是通过在大肠杆菌细胞中进行异源表达,采用不同标签进行亲和纯化而获得,包括重组木聚糖酶、绿色荧光蛋白GFP、莱茵衣藻IFT70蛋白等[23-25]。大肠杆菌是首个应用于外源蛋白重组表达的宿主微生物,具有遗传背景清晰、容易培养、成本较低、转化效率较高等优点,并且其表达量远高于其他表达系统,重组表达蛋白含量甚至会超过总蛋白量的30%。因此,大肠杆菌是截至目前蛋白表达应用中使用最广泛的表达系统。将Cpf1蛋白N端166个氨基酸与6×His标签在大肠杆菌中进行重组融合表达,亲和纯化后免疫动物获得抗血清,Werstenn Blot证实该抗血清能识别大肠杆菌中表达的Cpf1和Cpf1(1-166)。综上所述,本研究成功获得了Cpf1核酸酶的兔源多克隆抗体,并通过Western Blot实验证实其具有较好的结合特异性,这将为Cpf1在生物体中的检测提供工具,且将为推动CRISPR/Cpf1系统的应用奠定良好的实验基础。

