人工细胞构筑途径研究进展
贺亚青, 郭振振, 刘巧玲
(湖南大学 生物学院, 长沙 410082)
人工细胞具有类似生物细胞的结构,并表现出生物细胞的一些关键特征和功能[1]。在人工仿生系统研究方面,人工细胞具有更容易控制和更稳定的特点,被用于研究细胞特性和模拟细胞功能。人工细胞可通过自上而下和自下而上两种途径构筑[2](图1)。自上而下的途径起始于一个生物体,主要是通过减少或简化活细胞的基因组来构建最小的细胞。在理论上,最小的细胞拥有最少数量的基因来完成最基本的生命功能,此方法旨在简化细胞,从而有利于研究和调节复杂的生命过程。相比之下,自下而上法则利用非生命组分的人工模块作为原材料来构建生命系统。基于人工模块的可操控性和可设计性,采用自下而上的方法构筑人工细胞操作简单,可重复性好。因此,受到生物、化学、材料等研究领域相关研究人员的广泛关注。在这篇综述中,主要从自上而下和自下而上两种途径介绍人工细胞的构建,以期为人工细胞的研究提供参考依据。
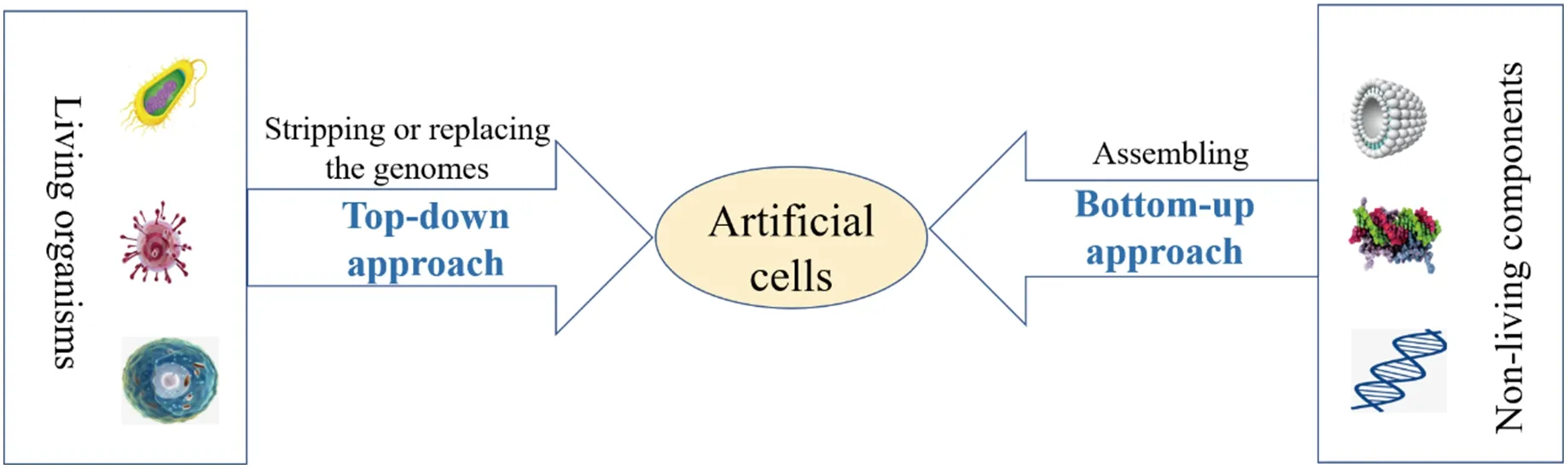
图1 人工细胞的构筑途径
1 人工细胞的概述
细胞是生物体内最基本的生命系统,是生物体结构和功能的基本单位和功能单元,与生物大分子一起完成生命的各项活动,它是最基本的“生命基石”。现代细胞生物学不满足于仅仅研究细胞的结构、功能和工作原理。该研究已扩展到许多新的领域,如生命起源、细胞工程技术、药物传递系统和生物传感器等。然而,随着细胞生物学的迅速发展,由于生物细胞固有的复杂性和易碎性而出现很多急需解决的问题,例如在体外容易丧失活性或死亡。为了有效地克服这些问题,同时具备模拟生物细胞的功能,1957年,Chang[3]首次提出人工细胞的概念,此后很多研究者致力于人工细胞的研究,期望能够构筑具有生命功能的最简细胞,同时拥有比天然细胞更容易操纵和更稳定的特点。人工细胞应该具有多种细胞结构,并能表现出一些活体生物细胞的关键特性,如区域化、自我繁殖和能量供应等。在理想情况下,人工细胞应该具有与活细胞相似的结构和性质,具有3个主要成分来执行生命的基本功能:1)一种稳定的半透膜,包裹细胞成分,保护它们免受外界环境的破坏,同时允许选择性的物质和能量交换;2)携带遗传信息,控制细胞动态并赋予细胞进化能力的生物大分子(DNA或RNA);3)为细胞提供能量,保证自我维持、自我更新和自我处理信息的一系列代谢途径的能量供应。目前,合成这些成分、构筑细胞结构、实现细胞的功能,以期能够将复杂的细胞结构和功能在体外通过人工设计来实现是当前人工细胞的研究热点。
2 人工细胞构建途径
2.1 自上而下的构建途径
自上而下地构建人工细胞主要是通过减少或简化活细胞的基因组来构建“最简单”细胞,理论上拥有最少数量的基因即能发挥最基本的生命功能。1995年,Fraser等[4]发现寄生的生殖支原体只有517个基因,但是却拥有DNA复制、转录和翻译、DNA修复、细胞运输和能量代谢所需的基因,这是已知最简单的生物体。如此小的基因组激发了科学家把非必需基因敲除,并保证细胞的存活率,以期得到仅拥有必需基因的“最简单细胞”。
在自上而下的构建途径中,用合成的基因替换生物细胞的原始基因深受研究者的青睐。目前这种方法还没在人工真核细胞中实现,但是关于一些原始生物如病毒和细菌的构筑已经取得成功。2002年,Cello等[5]从头合成了全长脊髓灰质炎病毒DNA(cDNA)。然后用T7RNA聚合酶将合成的cDNA转录为高传染性病毒RNA。随后,发现在未感染细胞的细胞质提取物中,病毒RNA能够复制和翻译,表达具有与自然病毒相似的生理和病理特性。该病毒DNA的成功合成为通过自上而下途径构筑人工细胞提供了方向。2008年,Gibson等[6]在两株已被破译的Mycoplasmamycoides亚种capri GM12上设计了名为“M.mycoidesJCVI-syn1.0”的基因组序列。该基因组与原始基因组有一定的差异,有些基因被改变、增加或删除。为了测试所设计的基因是否能够表达与原基因组相同的性状,2010年,他们将这些基因经过化学合成后导入酵母中,然后植入到山羊支原体细胞中,结果能表现M.mycoides的性状,并且可以自我复制[7]。2016年,Hutchison等[8]对先前的设计进行改进,在保留必要基因的情况下,经过3个周期的设计、合成和测试,产生了JCVI-syn3.0(531个碱基对,473个基因),其基因组比自然界中任何自主复制细胞的基因组都要小。JCVI-syn3.0保留了几乎所有参与大分子合成和加工的基因,这大大推动了人们利用自上而下途径构筑最简单人工细胞的进程。此外,构筑的基因组为创造具有自我复制能力的新生物提供了必要的遗传信息,不仅有助于理解细胞的最小单元,而且还提供了多种新功能,具有潜在的应用前景。
尽管利用自上而下的途径取得了这些重要进展,但是,由于基因组的复杂性,以及敲除基因实验较繁琐,利用自上而下的途径设计、改造和创造更完善的人工细胞还有很多问题需要解决。
2.2 自下而上的构建途径
鉴于细胞的复杂性,在人工细胞构筑方面并不主要着眼于重建一个完整功能的人工细胞,而是将细胞的功能进行细分,分开来重构。研究者设计了自下而上的构筑途径,该途径不是从现有生物体开始的,而是使用非生命物质分模块构建人工细胞,此途径的依据是最原始的生命来自于非生命物质的进化。此外,该途径可以将非生物世界和生物世界联系起来,有助于探索生命的起源。在此从区室化、生长和分化、信息交流及能量供应这4个模块来介绍人工细胞的自下而上构筑途径,如图2所示。
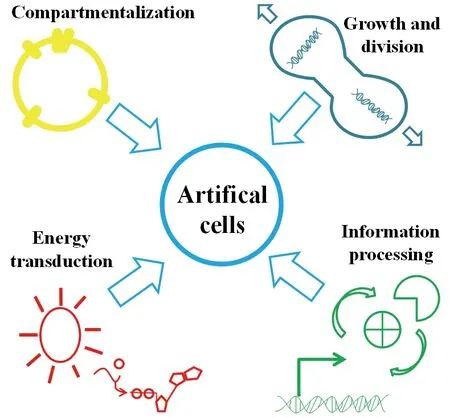
图2 自下而上途径构筑人工细胞区室化、生长和分化、信息交流和能量供应示意图
2.2.1 区室化
所有已知的细胞都有质膜将细胞内物质与外界环境隔离,实现区室化。尽管生物细胞膜非常复杂且难以模仿,但人工细胞膜隔间有望具备一些天然细胞膜的关键特征。在人工细胞的构筑中,常利用脂质体、脂肪酸囊泡、多聚体等作为膜隔间来实现细胞的区室化。这些膜隔间的研究历程已有报道[9],这里主要比较它们作为人工细胞膜隔间的优缺点。脂质体由磷脂分子自发地组装成可紧密形成充满水的双层球形囊泡[10]。通常使用微流控技术生产和操纵脂质体,以重构脂质体内的功能性生物机制[11]。脂质体是一种没有修饰的细胞膜简化模型,具有较好的生物相容性。脂质体中存在和细胞膜相似动态迁移率,这使脂质体成为构筑人工细胞的膜隔间。但是,由于缺乏膜蛋白,脂质体比细胞膜更薄,封装效率低。脂肪酸是一种重要的两亲性分子,它具有饱和或不饱和的疏水脂质尾部和亲水的羧酸头部。由Gebicki等最先提出一种不饱和脂肪酸在弱碱环境中能自组装形成囊泡[12]。脂肪酸囊泡中缺乏特定结构的跨膜蛋白,对一些阳离子的通透性明显高于脂质体,但是较高的通透性损害了对封装物质的保护能力,营养物质和废物可以被动流入和流出。脂肪酸囊泡可以经过多轮基本的生长-分裂循环,但是,脂肪酸在存在少量二价阳离子(如Mg2+)的情况下会沉淀,而Mg2+在转录翻译中必不可少,所以严重限制了其封装进行转录翻译机制的物质。此外,脂肪酸抑制许多酶的活性,如DNA和RNA聚合酶。这两种效应都阻碍了它们成为构筑人工细胞的主要膜隔间。多聚体是两亲性大分子嵌段共聚物合成的类似于囊泡形态的膜隔间[13],最常用的单体是二嵌段共聚物(由一个亲水域和一个疏水域组成)和三嵌段共聚物(两个亲水域被一个疏水域分开),多嵌段、接枝和超支化共聚物也可以作为合成多聚体的单体[14]。多聚体相对于脂质体的一个主要优势是有更广泛的构建模块可供选择,这有助于调整诸如厚度、稳定性和渗透性等性能。但是多聚体与细胞膜成分相差较大,生物相容性低,这限制了多聚体成为人工细胞膜隔间。本课题组利用羧基富勒烯与各种贴壁细胞孵育,都能制备出巨型细胞膜囊泡[15],其具有较好的生物相容性,同时也保留了膜的特性,以及对外源分子的表面修饰和封装适应性,有望成为人工细胞构筑的膜隔间。
2.2.2 生长和分裂
新细胞的产生最终来自于现有细胞的生长和分裂。在这个过程中,膜隔间必须能够生长、变形和最终分裂以及在时间和空间上进行全面调节。参与细胞生长和分裂的成分可以在体外重组,这增强了对其生物学功能的理解,也激发了人工细胞的合成。
细胞生长必须考虑膜的生长,膜生长最简单的方法是自发地将合成的成分插入到预先形成的囊泡膜中。脂肪酸囊泡被认为可能是生物出现前的膜隔间,其生长和分裂受外部环境的驱动[9]。这些隔间是动态的,可以通过在已有的隔间中自发加入新的脂肪酸分子来生长[16],甚至通过使用二肽催化剂来促进两亲体的募集[17]。在脂质体系统中,纯化蛋白的简化通路被重新构建[18]。替代性的非酶方法已利用基本的脂类化学和化学催化剂从两亲性前体生成磷脂膜[19]。然而,这两种方法都不能合成含有不同磷脂的多样性细胞膜。最近,通过结合有纯化的蛋白质的合成磷脂,可以有效地整合到膜中,增加囊泡的大小和复杂性,解决了这一问题。
在人工细胞的构筑中使用的膜隔间应具备模拟自然细胞的膜形变,从而产生膜分裂。膜形态可以通过改变脂质或多腔室的外部环境来控制[20],例如通过改变盐浓度[21]、增加膜的生长[19]和使用渗透冲击[22]。膜分裂系统可由体外重组的纯化蛋白组成,Dynamins是一种GTP酶,它与脂质膜的外表面结合,促进囊泡的形成,其聚合作用可能由BAR结构域蛋白辅助[20]。Dynamin蛋白以螺旋结构聚合,导致膜变形成管状,在GTP酶水解后,蛋白构象发生变化,进一步压缩膜,导致分裂。在脂质膜中结合一些蛋白质来模拟膜的复杂性,通过脂质体包裹参与细菌分裂过程的关键蛋白(FtsZ和FtsA),研究了隔膜的形成和膜的收缩。细胞在膜形变和膜分裂的发生过程中必须要有细胞骨架的参与[23]。细胞骨架使真核细胞具有抵抗变形,运输细胞内物质并在运动过程中改变细胞形状的能力[24]。在人工细胞合成方面,脂质囊泡中包裹细胞骨架系统合成的人工细胞能改变细胞的形状[25],并且通过渗透原理[26],还可以调节人工细胞体积的大小。这有望使人工细胞能够完成像迁移和有丝分裂这样复杂的任务。像生命一样的行为,人工细胞应该有一个自主的和遗传的手段来改变它们的膜形态,导致分裂。到目前为止,膜分裂系统主要由体外重组的纯化蛋白组成。为了使这些系统可遗传,最终必须使用封装的转录翻译系统(IVTT)在内部生成这些组件。
细胞成分的空间组织对于细胞的正常功能和分裂是至关重要的。自底向上的技术不能自我调节,但却是创建更复杂的空间组织的第一步。细胞内的浓度梯度和极化不仅保证了资源和遗传物质平均分裂成两个子细胞,而且保证了分裂所需的蛋白质机制的正确定位[27]。在将低丰度分子平均分配到子细胞中时,扩散是不可靠的。自然界的解决方案包括通过支架蛋白[28]或使用蛋白ParA/B[29]将物质均匀分布到杆状细菌的相对两极。这种现象还没有被复制到人造隔间中。
2.2.3 信息交流
人工细胞除了具有生长分化还应该具有信息交流的功能,以实现细胞更复杂功能的模拟。构建的人工细胞应该能感知周围环境并进行交流,还能根据这些信号调整自己的行为。参与细胞外通信的信号可以延伸到核酸之外,包括小分子、蛋白质和多肽,以及整个囊泡[30]。人工细胞模拟细胞信息处理的途径发展很快,从核酸到蛋白质代谢途径,再到细胞膜上的信号转导和处理,以期实现对环境和内部变化做出反应[31-33]。研究者通过合成可以响应信号的门控离子通道,接收信号的受体和能够携带信号的载体[34]。将人工构建的特定膜孔嵌入到隔室膜表面提供额外的调节[35],如生成质子梯度[36]或合成多肽孔隙传导离子和结合阻断剂[37]。自适应调节可以通过共价修饰的方式纳入这些蛋白质基础的孔隙中,例如,通过将肽连接到OmpF蛋白上,利用pH值[38]或氧化还原环境[39]的作用来打开和关闭孔隙。然而,在选择性信息处理中,细胞使用膜受体来触发内部信号级联。在自底向上的原始细胞中复制这些复杂的级联还有待实现,但是已经采取了初步步骤将膜受体嵌入到人工表面中。离子通道的行为可以通过合成的疏水性并且可以选择性地结合和释放特定离子的离子载体来模拟[40]。通过细胞膜的信号转导导致对信号的控制释放也已经实现[41]。在不同的原始细胞群体中,通过信号扩散并开启内部级联反应,模拟两个人工细胞群体间的通信[42]。模拟其他形式的类似生命交流,以实现在人工环境中调节复杂的生命活动[43]。细胞膜的自组织信息处理是由细胞膜形状、细胞骨架动力学和信号转导三部分的级联反应,来实现依赖于环境的运动和形态变化。为了实现信号的级联反应,本课题组利用从活细胞中提取的囊泡封装一个信号网络[44],由不同的模块组成,能够依次启动一系列的下游反应,构建了一个能接收、转导和响应的人工信号系统。然而,由于真正实现细胞信息交流需要很多复杂的反应来协同完成,因此,对于人工细胞信息交流功能的模拟还有待更深入的研究。
2.2.4 能量供应
活细胞的一个独特特征是能够从它们所处的环境中吸收能量,并利用这些能量进行生长、运动或繁殖等活动。于是,人工细胞的研究致力于能够将化学能或光能以耗散的方式转换到细胞能量来源的系统中,以ATP的形式持续向人工细胞提供能量,模拟自然细胞的自给自足。细胞系统中,ATP是通过来自营养(细胞呼吸)或光(光合作用)的能量经过呼吸或光合电子传递链转化为横跨细胞膜的质子梯度来产生。光驱动的质子泵细菌视紫红质和ATP合酶已成功地重组到小的单层囊泡[45]和聚合物囊泡[46],产生ATP。Otrin等[47]利用接枝共聚物膜和混合接枝共聚物/脂质膜,重组ATP合酶和末端氧化酶,组装了一个化学能驱动的ATP生成人工模块。通过将产生ATP的前体物质分装在基于蛋白质的液滴中能够模拟光合作用产生能量[48]。模拟光合作用还可以合成其他涉及生物分子能量转换的小分子,例如NAD(P)H和H2O2[49]。这些都是利用化学能转化为ATP的过程,真正实现能量再生的报道几乎没有。到目前为止,还没有合成系统能够从底物(如葡萄糖)转化成化学能,并通过烟酰胺辅因子循环耦合ATP再生。因此,自下而上合成系统的能量供应问题基本上没有得到解决,从生物和化学成分设计合成能量转换系统仍然是一项非常复杂的任务。为了应对这些问题,有必要对天然细胞能量供应系统进行巧妙的简化。在未来的研究中可以组装功能性部件并将其集成到功能模块中,其中功能部分由膜蛋白或化学催化剂嵌入合适的膜隔间(脂质体或来源于活细胞的囊泡)组成,有望解决能量供应问题。此外,开发完善的膜隔间,并用ATP酶进行功能化,也可能成为未来的一项重要研究。
3 总结和展望
构筑人工细胞有助于研究细胞生命进程,联系非生命物质与生命物质,增加生物细胞中缺乏的功能,为生命起源提供可靠的理论。利用自上而下的途径可以深入了解生命系统的基本过程,从而使人造细胞发挥作用。利用自下而上途径构建的人工细胞可以构建细胞结构和模拟部分功能,通过优化,这些人工设计的细胞仿生系统有可能替代活细胞的某些功能,将在生命科学研究中发挥重要作用。自上而下途径中通过逐个敲除现有生物的基因或者全部替换它们从而达到简化的目的,操作比较繁琐。通过自下而上途径设计的系统只包含执行功能所需的最小基因组,更简单,更可控,可以克服自上而下途径的限制。
目前的研究进展局限于构筑人工细胞所必需的基本结构和功能,如区域化、生长和分裂、信息处理和能量转换等。控制每个纳米级组件的时空分布以及解决当前人工细胞平台的兼容性,以支持生命的所有特征还没有实现。受热力学限制,还没有研究出新陈代谢和能量耗散是以哪种形式来实现真正的生命行为。没有解决多细胞系统自下而上合成的挑战,甚至包括组织和整个生物体等更高阶的装配。解决这些问题并非易事,要想成功实现这一复杂目标,就需要有多次且趋同的生物模拟和生物仿生,需要对信号转导、细胞外的结构和其他超出当前技术研究范围的生理特性进行精确控制需要多学科的合作并融合多种研究方法。因此,构建具有活细胞功能的人工细胞仍将是这个新兴的跨学科研究领域的巨大挑战。

