荧光定量PCR方法分析鲜鸡蛋贮藏过程蛋壳表面优势菌的变化
石一,武颂文,李文涓,袁璐,李焱,张浩帆,马国柱,刘东立*
1(陕西省疾病预防控制中心,陕西 西安,710054)2(西安医学院,陕西 西安,710021)3(西安交通大学医学部,陕西 西安,710061)4(西安市疾病预防控制中心,陕西 西安,710054)5(咸阳市疾病预防控制中心,陕西 咸阳,712000)
鸡蛋随着贮存时间的延长,其新鲜度下降,营养成分也会丢失[1]。国内外学者围绕鸡蛋品质积极探索主要是针对哈氏单位、质量损失率、蛋黄系数和微生物含量等指标[2-4]。传统微生物计数的方法可以从整体上反映鸡蛋的卫生学情况,但很难反映出某种微生物具体的数量,不同培养基的选择往往也会带来一定程度的偏差[5],操作复杂,时效性较慢。近年来越来越多的研究者通过分子生物学方法鉴定微生物的种类和变化情况,如变性梯度凝胶电泳(denaturing gradient gel electrophoresis, DGGE)、16S~23S rRNA扩增片段长度多态性(amplified fragment length polymorphism, AFLP)和单链构象多态性(single strand conformation polymorphism, SSCP)等[6-8]。虽然这些技术方法具有免培养、快速等特点,但是不能对微生物的数量进行绝对定量。
荧光定量PCR技术最大的特点就是可以准确定量样品中微生物的含量,SHI等[9]利用荧光定量PCR技术研究了米酒在酿造过程中酵母菌和乳酸菌的变化情况;TOFALO等[10]利用荧光定量PCR技术研究了餐用油橄榄在发酵过程中总酵母的数量变化情况,也有学者通过监测食醋发酵过程中醋酸菌、乳酸菌的变化控制和提高产品的风味[17]。
本研究旨在通过荧光定量PCR的方法,对3个地区鲜鸡蛋在储存过程中蛋壳表面4种优势菌属(葡萄球菌属、乳酸杆菌属、链霉菌属和肠球菌属)进行定量分析,从而为具体研究鸡蛋腐败微生物、延长鸡蛋的货架期奠定理论基础。
1 材料与方法
1.1 标本来源
在榆林(YL)、汉中(HZ)和西安(XA)3个地市,分别选取一家具有代表性的蛋鸡养殖场进行取样,采集当天生产的鸡蛋,每个养殖场收集30枚鸡蛋,共3个批次。所有样品遵循无菌采样要求,存放于25 ℃恒温培养箱。采样当天即为第0天,并于后续4个时间点(第14、28、42和56天)分别使用一次性棉拭子收集蛋壳表面微生物标本。所有拭子保存于-40 ℃冰箱,等待提取核酸。
1.2 实验方法
1.2.1 DNA提取
使用德国Qiagen公司DNA提取试剂盒(51304),采用改良的核酸提取方法提取样本DNA。将采样标本拭子头剪入1.5 mL离心管中。加入180 μL 20 mg/mL的溶菌酶,旋涡振荡混匀37 ℃金属浴30 min。加入25 μL蛋白酶K、200 μL AL,旋涡振荡混匀56 ℃金属浴过夜。短暂离心,将离心管中液体全部吸出转移至新的1.5 mL离心管中。加200 μL无水乙醇,振荡混匀,剩余步骤参照说明书。
1.2.2 扩增插入片段
针对4种菌属按照文献[11-13]合成特异性引物,引物序列见表1。25 μL PCR反应体系包括:10×buffer 2.5 μL,正向/反向引物(10 μmol/L)各0.5 μL,dNTP(10 mmol/L)0.5 μL,MgCl2(25 mmol/L)2.5 μL,rTaq(5 U/μL)0.2 μL,DEPC 水 16.3 μL,模板2 μL。PCR反应程序如下:预变性95 ℃ 5 min;变性95 ℃ 30 s,退火30 s(温度见表1),延伸72 ℃ 2 min,共40个循环;最终延伸72 ℃ 5 min,4 ℃保存。PCR产物用2%琼脂糖凝胶电泳检测。使用北京天根公司DNA纯化回收试剂盒(离心柱型)对琼脂糖电泳条带清晰的PCR产物进行纯化。
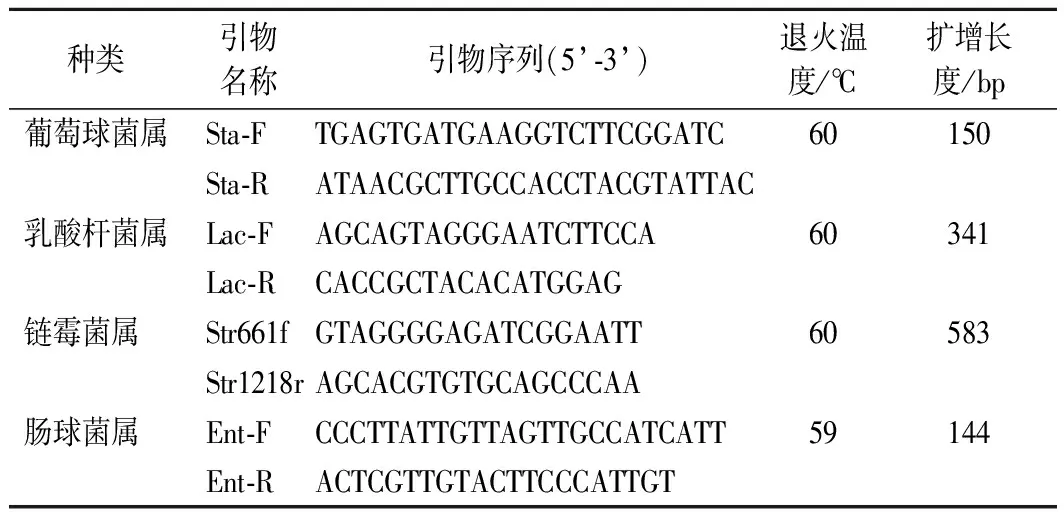
表1 四种优势菌属引物序列和退火温度Table 1 Primer sequence and annealing temperature of four dominant bacteria
1.2.3 插入片段与pMD18-T载体的连接
吸取1 μL载体 pMD18-T,1 μL PCR扩增产物,3 μL DEPC 水和5 μL SolutionⅠ充分混合,室温孵育1 h。
1.2.4 连接产物的转化
吸取100 μL感受态细胞DH5α悬液到1.5 mL离心管中,将10 μL连接产物全部加入,吹打混匀,冰浴30 min。取出离心管,42 ℃金属浴45 s,再放置冰中1 min。向离心管中加入890 μL SOC培养基,混匀后置于37 ℃摇床振荡培养1 h。吸200 μL悬液铺于倒好的LB/Amp/X-gal/IPTG固体培养基上,37 ℃培养过夜。
1.2.5 筛选阳性转化子
取出隔夜培养的平板,室温放置1~2 h,观察平板上的蓝白斑菌落,挑取白色菌落至5 mL LB/Amp培养液试管中,37 ℃摇床培养12 h。吸取1 mL菌液,送至上海生工生物工程公司测序。
利用DNASTAR软件对测序结果核苷酸序列进行处理,得到目的片段基因序列。利用NCBI数据库对得到的基因片段进行BLAST比对,确定转化效果。
1.2.6 质粒提取
根据比对结果,选取转化成功的质粒,使用日本Takara公司MiniBEST Plasmid Purification Kit Ver.4.0试剂盒进行质粒提取,最后得到标准品。
1.2.7 测定质粒浓度
使用 Nanodrop微量核酸蛋白检测仪测定质粒浓度,应用 Avogadro’s常数(1摩尔溶液大约有6.022 141 5×1023拷贝数)计算质粒拷贝数,按公式(1)、(2)、(3)和(4)计算:
质量=质粒质量浓度(ng/μL)×体积(μL)
(1)
分子质量(平均分子质量)=(载体质粒片段大小+插入片段大小)×(330 Da×2)
(2)
(注:每个碱基平均分子质量为330 Da,每对碱基平均分子质量为660 Da)
溶液摩尔数=质量/分子质量
(3)
拷贝数=溶液摩尔数×6.022 141 5×1023
(4)
1.2.8 标准曲线的制作
取8个0.2 μL PCR反应管编号,每管加入20 μL DEPC水。从提取的质粒溶液中吸取5 μL,加入到第1管中,旋涡振荡3 s,充分混匀。更换枪头后,从第1管中吸取5 μL溶液加入到第2管中,同样振荡3 s。以此类推直至第8管,按体积比1∶5进行稀释,盖紧后短暂离心后备用。
1.2.9 荧光定量PCR扩增
20 μL反应体系包括:SYBR Green Realtime PCR Mix 10 μL,正/反向引物(10 μmol/L)各0.8 μL(引物序列同前),ROX Reference Dye 0.4 μL,DEPC 水 6 μL,模板2 μL。预变性95 ℃ 5 min,变性95 ℃ 10 s,退火15 s(温度同前),延伸72 ℃ 45 s,共40个循环,72 ℃收集荧光,溶解曲线设置为默认值。
1.2.10 统计分析
统计分析使用SPSS 18.0软件,组间差异性分析采用单因素方差分析的方法,当P<0.05时有统计学意义。
2 结果于分析
2.1 扩增插入片段
随机挑选3份提取好的样本核酸,利用4种优势菌属的特异性引物进行PCR扩增,结果如图1所示,扩增产物片段大小与预期长度基本一致,葡萄球菌属(150 bp)、乳酸杆菌(341 bp)、链霉菌(583 bp)和肠球菌(144 bp)。扩增产物无明显非特异性条带,说明菌属引物特异性较好,阴性对照均正常无污染。

a-乳酸杆菌属和葡萄球菌属;b-链酶菌属;c-肠球菌属图1 特异性引物扩增效果Fig.1 Specific primer amplification effect
2.2 阳性转化子筛选
经过平板筛选和DNA测序验证,4种优势菌属的标准品质粒均构建成功,通过提取质粒可以用于标准曲线样本的制备。
2.3 葡萄球菌属标准曲线及检测结果
经过qPCR测定,计算葡萄球菌属标准曲线各参数分别为:E=84.71%,R2=0.998,Slope=-3.753,Tm=83.67(图2-a),R2值较好。不同取样时间荧光定量PCR结果见表2。数据显示HZ、XA组葡萄球菌属的数量在14 d前均呈增多趋势,而后持续减少。
2.4 乳酸杆菌属标准曲线及检测结果
乳酸杆菌属标准曲线各参数分别为:E=88.73%,R2=0.996,Slope=-3.625,Tm=87.09(图3-a),不同取样时间荧光定量PCR结果见表2。由表2可知,随着时间延长,3组乳酸杆菌属的数量在14 d后均呈下降趋势。

a-标准曲线;b-熔解曲线;c-扩增曲线图2 葡萄球菌属荧光定量PCR结果Fig.2 Staphylococcus qPCR results

表2 三个地市4种优势菌属的比较 单位:拷贝数

a-标准曲线;b-熔解曲线;c-扩增曲线图3 乳酸杆菌属荧光定量PCR结果Fig.3 Lactobacillus qPCR results
2.5 链霉菌属标准曲线及检测结果
经过倍比稀释,链霉菌属标准品所测得的标准曲线各参数分别为:E=79.68%,R2=0.990,Slope=-3.929,Tm=89.93(图4-a)。从表2数据可以看出,随着时间的延长,YL、XA组链霉菌属的数量整体呈上升趋势。
2.6 肠球菌属标准曲线及检测结果
肠球菌属标准曲线各参数分别为:E=102.71%,R2=0.999,Slope=-3.259,Tm=84.86(图5-a),R2值也较好,不同取样点荧光定量PCR结果见表2。结果表明,HZ、XA组肠球菌属的数量在28 d后才出现下降。
综合来看,4种优势菌属的扩增曲线基线平整、指数区明显,标准曲线线性拟合度高,说明可信度高结果可靠,熔解曲线呈现单一熔解峰,说明无引物二聚体和非特异性产物。
2.7 不同地区间优势菌属的比较
比较不同地区间4种优势菌qPCR结果后发现,葡萄球菌属和肠球菌属3组之间存在显著统计学差异(P<0.01),说明受采样地影响较为明显。而乳酸杆菌和链霉菌2个菌属则无统计学差异。
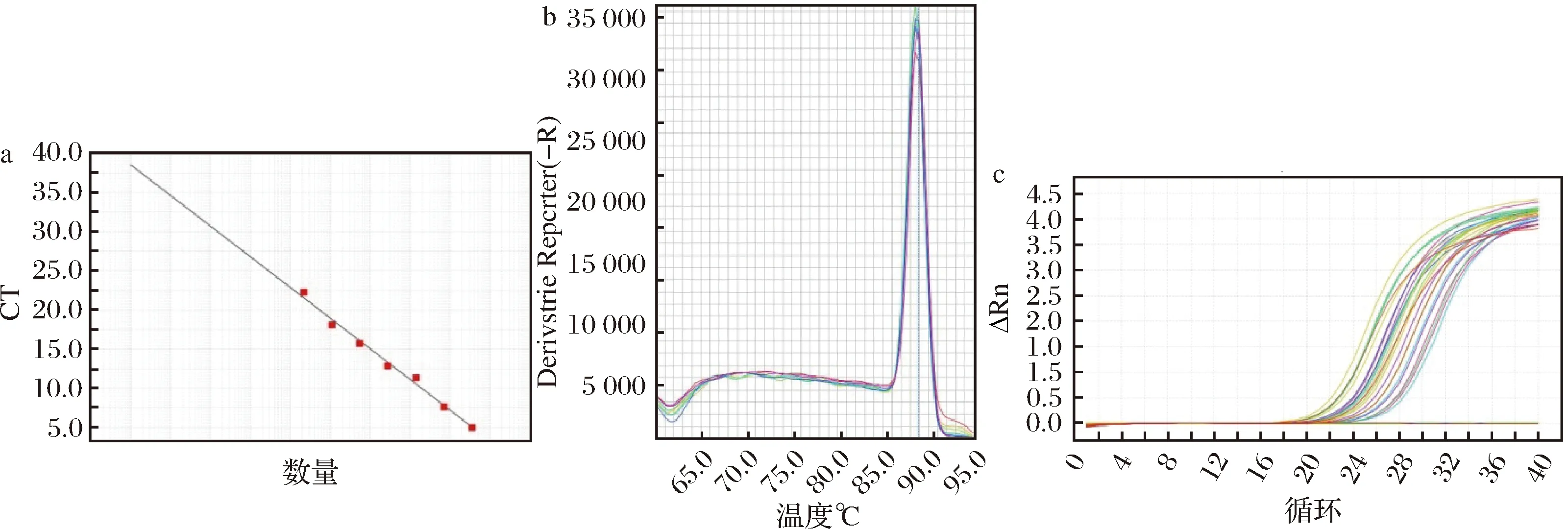
a-标准曲线;b-熔解曲线;c-扩增曲线图4 链霉菌属荧光定量PCR结果Fig.4 Streptomyces qPCR results
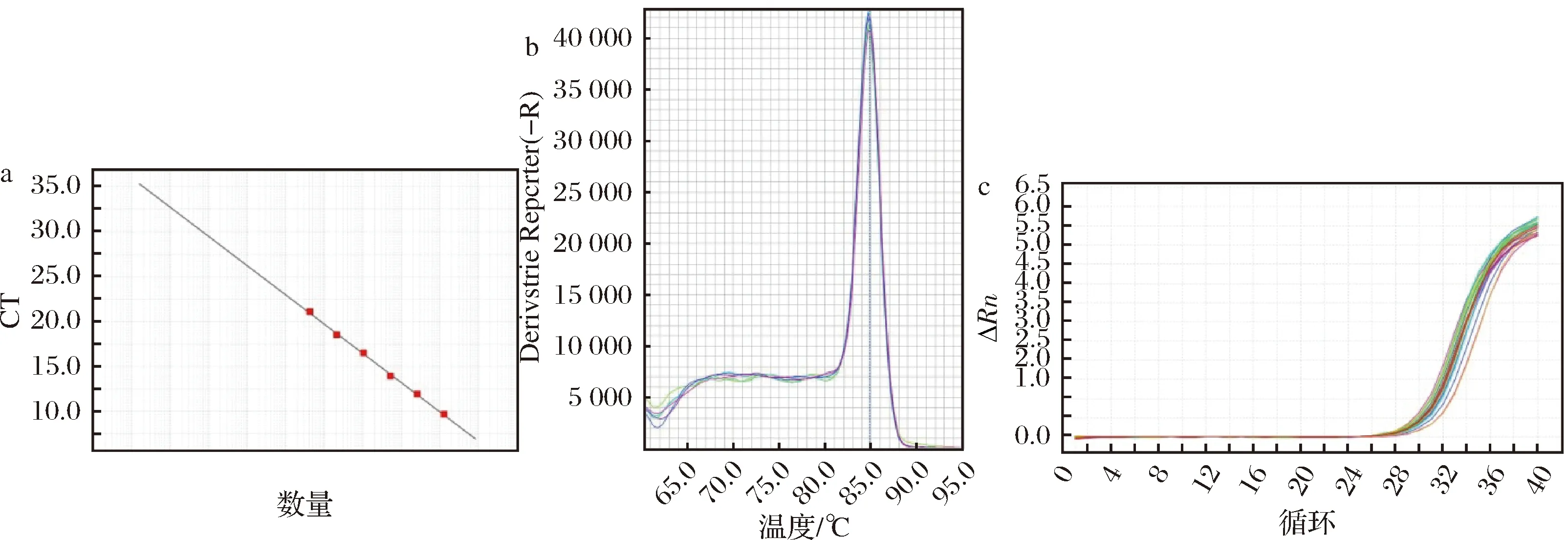
a-标准曲线;b-熔解曲线;c-扩增曲线图5 肠球菌属荧光定量PCR结果Fig.5 Enterococcus qPCR results
3 结论与讨论
不同品牌的鸡蛋蛋壳表面菌落总数在贮存初期介于9.315×102~1.367×104CFU/个[4],随着贮藏时间的变化呈上升趋势,贮藏时间越长受污染的程度越大[18]。然而蛋壳表面的菌群多种多样,只有少部分是致病菌,一些正常菌群的增加似乎起到了避免鸡蛋被致病菌定植,防止鸡蛋腐败变质的作用[22-23]。采用DGGE分析的方法与传统微生物培养的方法,所测得的细菌总数和多样性也不尽相同[24]。
在美国鸡蛋的货架期通常被限定为45 d[19],国内销售的散装鸡蛋目前大多没有标注生产日期,盒装品牌鸡蛋的保质期根据储藏温度也有所不同,通常在30~60 d且尚未有完善的鸡蛋货架期标准。此次通过荧光定量PCR的方法发现,4种蛋壳表面的优势菌属数量随着储存时间的变化各不相同,其中葡萄球菌属、乳酸杆菌属数量在储存的前14 d呈现增多的趋势,14 d后则下降。链霉菌属数量整体呈上升趋势,而肠球菌属数量在储存28 d 后呈下降趋势。葡萄球菌属是蛋内发现的主要细菌之一,除此之外还有链球菌、大肠杆菌、变形杆菌、假单胞菌和沙门氏菌等均能引起禽蛋不同程度的腐败变质[20]。蛋壳表面葡萄球菌属数量的增多与蛋内葡萄球菌的污染是否有关有待进一步研究。乳酸杆菌属适宜在厌氧的环境下生长,此次实验结果也显示蛋壳表面的乳酸杆菌属数量先增加后减少。有研究显示乳酸菌能够抑制某些腐败菌引起的产膜、变色和使汁液浑浊等腐败现象的发生[25],除此之外,链霉菌也具有一定的抗菌活性[21],此次实验结果中链霉菌属数量的增加是否与抑制其他细菌的生长有关还需要进一步验证。蛋壳表面乳酸杆菌属和链霉菌属的数量在3个地区间无统计学差异,也许可以反映鲜鸡蛋在储存过程中品质变化的真实情况。由于我们的样品数量有限, 4种优势菌属的统计学规律还有待进一步研究。

