玉米中伏马毒素B1、B2间接竞争酶联免疫吸附方法的建立
于瑶,李岩松,卢士英,杨勇,胡盼,任洪林,柳增善,周玉,2*
1(吉林大学 动物医学学院/人兽共患病研究所/人兽共患病研究教育部重点实验室(吉林大学),吉林 长春,130062)2(长江大学 动物科学学院,湖北 荆州,434023)
伏马毒素(fumonisins,FBs)是GELDERBLON等于1988年从串珠镰刀菌的培养液中首次分离出来[1],广泛分布于世界各地,污染各种粮食作物,尤其是玉米及其加工产品。此外,在其他作物或农产品中也检测到FBs污染,例如水稻、面粉、谷物及其制品、干豆、坚果等。FBs分为A、B、C、D四大类,目前已发现的有FA1、FA2、FB1、FB2、FB3、FB4、FC1、FC2、FC3、FC4和FD1,共11种。其中毒性最强的为FB1,在FBs粮食污染中占60%以上[2],其次为FB2,天然污染的玉米籽粒中被FB1和FB2污染的比例为3∶1[3]。
FBs具有多种毒性,主要包括神经毒性、组织器官毒性、致癌性、免疫毒性、细胞毒性、生殖毒性等[4-6]。据2016年中国饲料和原料霉菌毒素检测报告显示[7],最近几年全球FBs污染趋势明显升高, 在食品与饲料安全中的危害引发人们的广泛关注[8]。目前,我国对玉米中FBs残留限量标准为 4 mg/kg[9],欧盟及美国为2 mg/kg[10],瑞典为1 mg/kg[2]。现有的 FBs检测方法有高效液相色谱-固相荧光法[11]、免疫亲和柱净化-柱后衍生高效液相色谱法[12]、高效液相色谱-串联质谱联用法[13]、免疫学检测方法[14]等。这些检测方法需要大型仪器设备及专业操作人员,不便于实际检测中的样品筛查。免疫学检测方法相对简单,尤其是间接竞争酶联免疫吸附法(indirect competitive enzyme linked immunosorbent assay,ic-ELISA)在小分子物质的免疫学检测中应用最为广泛,具有简单、灵敏、高效的优点[15],适合大量样品的初筛。
1 材料与方法
1.1 材料与仪器
FB1、FB2、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)、玉米赤霉烯酮(zearalenone,ZEN)、T-2毒素、黄曲霉素B1(aflatoxin B1,AFB1),青岛Pribolab生物工程有限公司;FB1单克隆抗体为本实验室自制[16];吐温-20,美国Amresco公司;辣根过氧化物酶(horse radish peroxidase,HRP)标记羊抗小鼠 IgG,北京中杉金桥生物技术有限公司;牛血清蛋白(bovine serum albumin,BSA),生工生物工程(上海)有限公司;四甲基联苯胺(tetramethylbenzidine,TMB),北京梅科万德生物科技有限公司;酶标板,广州洁特生物过滤制品有限公司。
酶标仪,瑞士TECAN公司;电子天平,德国赛多利斯集团;高速低温冷冻离心机(Biofuge Primo R),美国Thermo Fisher科技公司;酶标板振荡器(MTS2/4)、高速匀浆机(ULTRA-TURRAX T-10 basF),德国IKA;-80 ℃超低温冰箱,三洋电器;恒温培养箱(DHP-120),上海实验仪器厂。
1.2 实验方法
1.2.1 ic-ELISA条件优化
抗原BSA-FB1梯度稀释为2、1、0.5、0.25、1.25、0.062 5 mg/L。单抗体分别稀释为0.4、0.2、0.1、0.05、0.025 mg/L。通过ic-ELISA方法确定抗原和单抗体的最佳使用质量浓度。
根据上述优化条件,在相同反应条件下,分别进行包被条件(4 ℃ 12 h、4 ℃ 24 h、37 ℃ 4 h、37 ℃ 2 h、37 ℃ 1 h),酶标二抗稀释倍数(1∶2 000、1∶3 000、1∶4 000、1∶5 000、1∶6 000)和底物作用时间(5、10、15、20、25、30 min)3组ic-ELISA实验,比较不同条件的P/N (阳性孔OD450nm值/空白孔OD450 nm值),选择最大值以确定检抗原包被条件、酶标二抗稀释倍数、底物作用时间。
1.2.2 标准曲线的建立
将8个质量浓度的FB1溶液(100、50、25、12.5、6.25、3.125、1.562 5、0 μg/L),每个质量浓度重复5孔,按照ic-ELISA法测定获得相应的OD450 nm,以抑制率为纵坐标,以标准品质量浓度的对数值为横坐标,绘制标准曲线。抑制率按公式(1)计算:
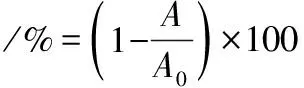
(1)
式中:A0,标准品0 ng/mL的吸光度值;A,标准品不同质量浓度的吸光度值。
1.2.3 特异性验证
为验证建立的方法特异性,选FB1、FB2、DON、ZEA、T-2、AFB1六种真菌毒素做交叉反应试验。交叉反应率按公式(2)计算:

(2)
1.2.4 加标回收
将磨细的玉米样品1 g加至5 mL 体积分数为70%的甲醇缓冲液中,超声10 min后将固液混合物4 000×g离心5 min。取上清液用磷酸缓冲盐溶液10倍稀释用于ic-ELISA。设定FBs(按FB1与FB2总量计,FB1与FB2质量比为3∶1)加标质量分数分别为2、1、0.25 g/kg,每个质量分数做3个重复,按公式(3)计算回收率[17-18]。

(3)
2 结果与分析
2.1 抗原包被和单抗体质量浓度的确定
ic-ELISA检测方法结果见表1。OD值是1左右相对应的质量浓度为抗原、抗体最佳使用质量浓度[15],选择抗原包被质量浓度为0.5 mg/L,抗体质量浓度为0.2 mg/L。

表1 包被抗原、抗体最佳用量的确定Table 1 The optimal amount of coating antigen and antibody
2.2 抗原最佳包被条件的确定
包被条件结果见图1。在相同温度下,包被时间过短会因抗原包被量少导致P/N值降低;包被时间过长则N值变大从而导致P/N值降低。结果表明,4 ℃ 12 h 时P/N值最大,因此抗原最佳包被条件为4 ℃包被12 h。

图1 最佳包被条件优化Fig.1 Optimization of coating condition
2.3 酶标二抗稀释倍数的确定
在ic-ELISA检测中,单克隆抗体与酶标二抗结合至关重要,稀释倍数大,可节约二抗,但稀释倍数过大会导致底物显色不完全。将0.4 mg/L HRP-山羊抗小鼠IgG分别稀释2 000、3 000、4 000、5 000、6 000倍,做ic-ELISA。由图2可知,3 000倍稀释时P/N值较高,故选择3 000倍作为酶标二抗最佳稀释倍数。
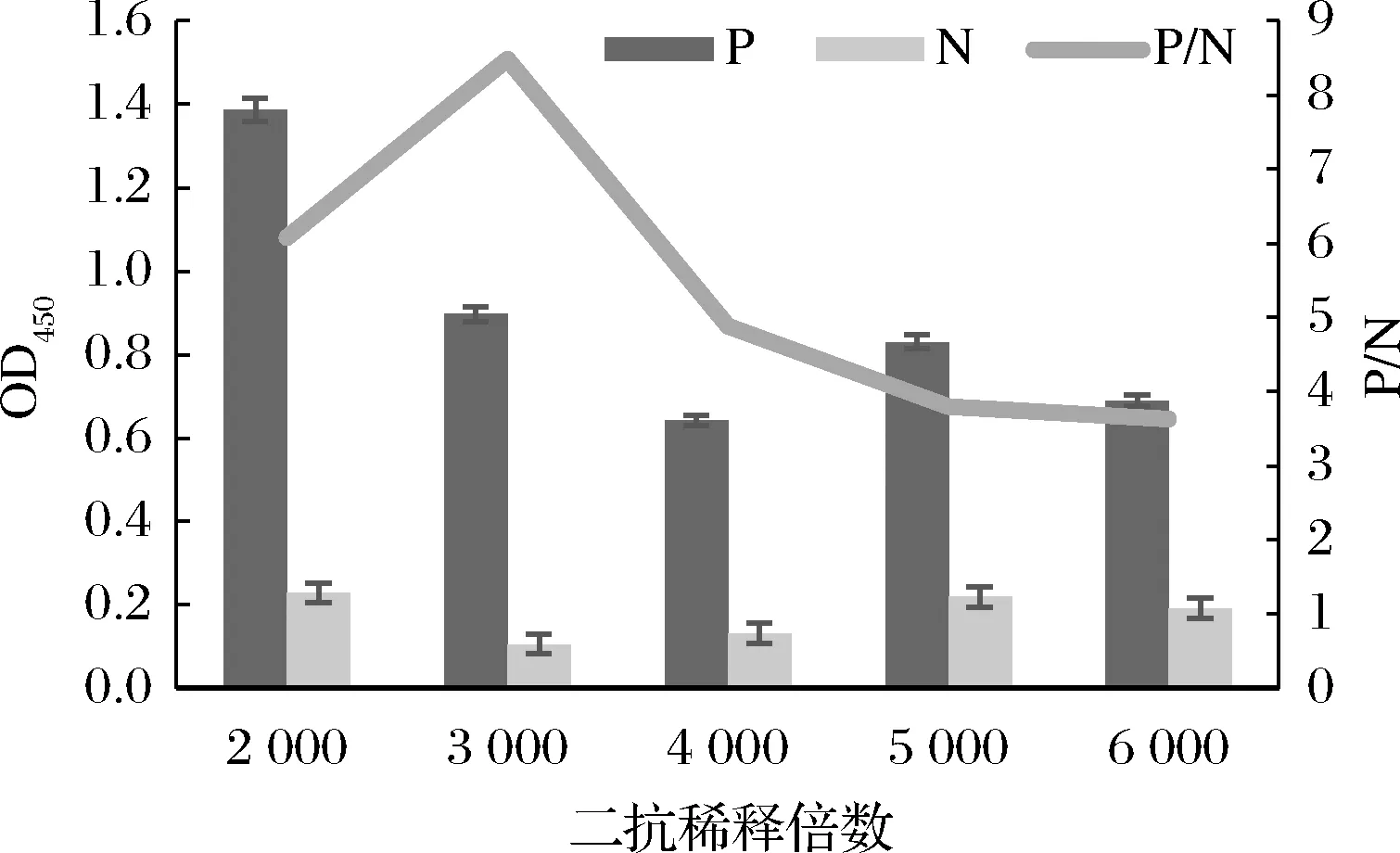
图2 酶标二抗工作质量浓度的优化Fig.2 Optimization of IgG-HRP working concentrations
2.4 底物作用时间的确定
对底物作用时间进行测定,结果如图3。随着底物作用时间增加,P/N值逐渐增加后趋于平稳,但底物作用时间过长时,P/N值下降。综合反应时间和P/N值,选择15 min作为合适的底物作用时间。

图3 底物最佳作用时间的优化Fig.3 Optimization of reaction time of substrate
2.5 标准曲线的建立
按1.2.2中的方法绘制抑制曲线,结果见图4。线性回归方程为:y=37.869x-99.289,R2=0.973 6。线性范围(抑制率20%~80%)为 1.41~54.2 mg/L,最低检测限(抑制率10%)为 24.5 μg/kg。

图4 标准曲线的建立Fig.4 Establishment of standard curve
2.6 特异性
取真菌毒素FB1、FB2、DON、ZEA、T-2、AFB1,按照已经优化好的ic-ELISA条件进行检测,结果见表2。FB1与FB2交叉反应率为129.88%,与DON、ZEA、T-2、AFB1的交叉反应率均小于10%。

表2 交叉反应率的测定Table 2 The determination of the cross-reactivity
2.7 加标回收
为验证所建立方法的准确度,对玉米样品进行加标回收。在加标回收之前,所有的玉米样品都进行ic-ELISA检测,没有发现FBs。回收率测定结果(表3)表明,本研究所建立的方法回收率为89.36%~108.54%,且变异系数低于5%,说明稳定性良好。这些结果表明,本研究所建立的ic-ELISA检测方法可以应用于玉米样品中FB1、FB2的检测。

表3 加标回收试验Table 3 The recovery of ic-ELISA
3 讨论
本方法最低检测限为 24.5 μg/kg,与我国现行有效的食品中FBs测定方法,包括免疫亲和柱净化-柱后衍生高效液相色谱法(17 μg/kg),高效液相色谱-串联质谱联用法(7 μg/kg),免疫亲和层析净化-柱前衍生高效液相色谱法(17 μg/kg)[19],出口花生、谷类及其制品中FBs测定方法液相色谱-质谱检测法(20 μg/kg)[20]接近,并且不需要高效液相色谱仪等大型仪器。优于国家规定的粮油中FBs测定方法超高效液相色谱法(50 μg/kg)[21]检测限。满足国家规定的玉米中FBs最大残留限量要求[9]。
本方法对玉米的加标回收率为89.36%~108.54%,优于报道的其他免疫学方法[22-23]。回收率的大小可以评价定量分析的准确度,通常情况下,回收率越高,定量分析结果的准确率就越高[24]。影响加标回收率的因素很多,包括测定方法本身的缺陷、加标量的水平及准确性、加标体积、操作人员水平、样本底值和样品的均匀性等[25]。饶正华等[23]利用免疫亲和层析-荧光度法对饲料中的FB2进行测定,平均回收率为89.22%,蛋白质污染问题使其准确度明显低于ic-ELISA方法。管笛等[22]利用磁微粒酶联免疫吸附法测定玉米中的FB1,回收率在 76.4%~92.0%,该方法虽提高了检测灵敏度,但准确度不及ic-ELISA。
4 结论
本研究建立了对于FB1、FB2的ic-ELISA检测方法,并对条件参数进行了优化,线性检测范围为 1.41~54.2 μg/L,最低检测限为24.5 μg/kg,实测玉米样品加标回收率为89.36%~108.54%。交叉反应结果显示,与伏马毒素FB1和FB2交叉反应率分别为100%和129.88%,与其他真菌毒素交叉反应均小于10%。本检测方法可特异性地检出FB1和FB2。

