冻藏时间对养殖大黄鱼体色和肌肉品质的影响
郭全友,李松,李保国,杨絮
1(中国水产科学研究院 东海水产研究所,上海,200090) 2(上海理工大学 医疗器械与食品学院,上海,200093)
大黄鱼(Pseudosciaenacrocea)是我国重要的经济鱼类之一,体色金黄、肉质鲜美,深受广大消费者的青睐,其年产量约为19.19万t,位居我国养殖海水鱼之首[1]。
冻藏保鲜是目前使用较广泛的一种水产品保鲜方法。冻藏保鲜不仅可以延长水产品货架期,而且能够有效抑制微生物和内源酶的作用,最大程度地保持食品的风味和肌肉品质[2-4]。许婷婷等[5]研究发现鲐鱼在-20 ℃贮藏过程中硬度、弹性、黏聚性及咀嚼度等质构参数随着冻藏时间延长总体呈下降趋势;欧阳杰等[6]研究了浸渍冻结大黄鱼在贮藏期间鱼肉的持水力逐渐下降,且冻藏第6个月时鱼肉持水力下降显著;汪兰等[7]比较了-10和-18 ℃冻藏对鲈鱼品质的影响,结果发现,-10 ℃下贮藏的鲈鱼在第24周后硫代巴比妥酸(thiobarbituric acid, TBA)值和鲜度K值已超过可食用上限,开始进入初期腐败,而-18 ℃下贮藏的鲈鱼的各项指标变化较慢。在冻藏过程中,冰晶的产生及生成量是衡量水产品品质的一个非常重要的参数。冻藏时生成的冰晶引起的组织破坏以及冻结过程中肌红蛋白和脂肪的氧化、水分的蒸发等理化性质的变化都影响着色泽的改变[8]。李娟等[9]比较了-20 ℃冻藏温度下的鱼与冰鲜鱼腹背部的色差值,发现腹部和背部的L*、a*、b*值均显著下降;廖明涛等[10]研究了蓝鳍金枪鱼在-18 ℃冻藏期间腹背部鱼肉的红度指标(a*/b*)和总色素含量的变化,结果显示腹背部肌肉的红度指标和总色素含量均随贮藏时间延长而持续下降,红度指标在180 d达到最低值,腹部总色素含量在90~180 d贮藏期显著低于背部。而目前针对大黄鱼在冻藏期间的口唇和体表(腹背尾)色差值以及色素细胞面积变化的相关研究较少。因此,开展大黄鱼在冻藏期间的体色变化和肌肉品质研究,为冻藏过程中的色泽和鲜度保持具有重要的理论意义。
以冰鲜大黄鱼为对照组,比较养殖大黄鱼在冻藏过程中各阶段的体表色差、总色素含量、色素细胞大小变化率、肌肉品质和感官评价等差异性,旨在探究冻藏时间对大黄鱼的体色和肌肉品质影响的变化规律,为养殖大黄鱼的冻藏保鲜提供理论支撑。
1 材料与方法
1.1 材料与试剂
2019年6月在福建省宁德市霞浦县取得人工养殖大黄鱼, 规格为(358.01±9.29) g/尾,肥满度(1.57±0.94)。养殖过程:鱼苗使用网眼0.8 cm×0.8 cm、2个3.3 m×3.3 m网箱框位、网箱深4.0 m(2通框)养殖1个月,更换网眼1.2 cm×1.2 cm的2通框养殖第2个月,再更换网眼2.0 cm×2.0 cm的9通框养殖第3个月,最后更换网眼2.0 cm×2.0 cm的36通框养殖至捕捞。捕捞后层冰层鱼放置于泡沫箱,迅速运至实验室。
丙酮、无水Na2SO4、石油醚(沸程30~60 ℃)、KOH、三氯乙酸、2-硫代巴比妥酸、2,6-二叔丁基对甲酚、氯仿等均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
CR-400色彩色差仪,日本Chroma Meter公司;TMS-Pro质构仪,美国Food Technology Corporation;Avanti J-301高性能离心机,美国Beckman Coulter公司;BX53生物荧光显微镜,奥林巴斯株式会社;UV-3300紫外可见分光光度计,北京莱伯泰科仪器有限公司。
1.3 实验方法
1.3.1 前处理
将大黄鱼进行单条真空包装后,在-80 ℃冰箱冻结至中心温度-18 ℃,置于-18 ℃冰箱中冻藏。对照组冰鲜大黄鱼记为F0,以2个月为间隔周期(F2:第2个月,F4:第4个月,F6:第6个月)取出冻结样品,置于4 ℃冰箱中解冻后测定感官、体色(体表色差、总色素含量、色素细胞大小)、pH、电导率、质构、保水性(汁液损失率,蒸煮损失率)、TBA、过氧化值等指标。
1.3.2 感官评定
将大黄鱼去鳃去内脏,取背部肌肉(2 cm×2 cm×1 cm)于100 ℃蒸5 min[11]。选取6名人员组成评定小组,从外观、色泽、气味和质地4个指标进行感官评价。根据GB/T 18108—2008 和SC 127—1984 规定大黄鱼的感官指标制定感官评定表(表1),评价标准采取5 分制,每个样品的感官评分去掉最高和最低评分后取算术平均值。同时各感官评定员采用对比平均法[12],即对反映大黄鱼4个感官指标间两两进行比较,根据大黄鱼感官评价中的重要程度,确定外观、色泽、气味和质地的权重比例分别是22%、28%、24%和26%。根据公式(1) 计算感官综合得分:
(1)
式中:Ni代表某感官指标的感官评分;Ui代表对应感官指标的权重比例。

表1 大黄鱼感官评定表Table 1 Sensory evaluation rules for Pseudosciaena crocea
1.3.3 色差值
用色差计进行腹部(A1~A5)、背部(B1~B5)和尾部(C1~C6)色差值测定,测量点如图1所示。采用国际标准CIE规定的L*、a*、b*值表示色泽,根据测量的色差值,研究大黄鱼体表色泽分布的规律性。

图1 大黄鱼鱼体色泽测量点示意图Fig.1 Skin color measurement point diagram of Pseudosciaena crocea
1.3.4 总类胡萝卜素含量
大黄鱼皮肤总类胡萝卜素提取及纯化参照赵艳等[13]的方法,并适当修改,精确称取大黄鱼腹部(图1的A2~A4区域)、背部(图1的B2~B4区域)去鳞的皮肤各5.0 g,加入适量无水Na2SO4匀浆,用2,6-二叔丁基对甲酚质量浓度为500 mg/L,V(丙酮)∶V(石油醚)=4∶3的抽提液,抽提至溶液无色,将每次所得提取液吸入250 mL 圆底烧瓶中,通入N2,加 10 mL 500 g/L 的KOH-甲醇溶液,混匀,置于40 ℃恒温水浴箱振荡皂化15 min,将皂化液分装于离心管中5 000 r/min离心5 min,取黄色有机相,40 ℃旋转蒸发浓缩至约2.0 mL,浓缩液经 LC-NH2固相萃取柱净化。净化液用丙酮稀释一定倍数后,以丙酮作对照,用紫外可见分光光度计对大黄鱼皮肤提取液总色素进行波长(300~700 nm)扫描,在最大吸收波长处测定吸光度,按公式(2)计算总类胡萝卜素含量[14]:
(2)
式中:m,取样所含总类胡萝卜素含量,mg;A,样品在最大吸收波长处的吸光度;K,稀释倍数;V,样品体积,mL;2 500,类胡萝卜素摩尔消光系数(E1%);1即为1 cm,光学路径长度。
1.3.5 色素细胞面积
皮肤及鳍色素细胞的观察参考李小兵等[15]方法,取大黄鱼各鳍、背部皮肤和腹部皮肤,面积1 cm2,厚度约 1.5 mm,用显微镜进行观察并拍照(物镜倍率均为10×,标尺100 μm,下同)。鳞片色素细胞观察参考闫珊珊[16]的方法,在大黄鱼鱼体侧线上鳞部位,取鳞片4~6片,磷酸缓冲液清洗干净,滤纸吸干,按正常鳞片上下层放至载玻片,显微镜观察鳞片色素细胞分布并拍照。根据HAN等[17]测量冰鲜大黄鱼色素细胞面积时,分别在遮光与不遮光状态下完全发散(面积大小恒定)和完全收缩的面积之差定义为Am。通过生物荧光显微镜拍照后软件的面积测量工具,测量对照组大黄鱼各部位的色素细胞面积大小(5个色素细胞均值,5点分布取样),以及不同冻藏时期后色素细胞面积,按公式(3)计算冻藏各阶段色素细胞面积变化率:
(3)
式中:A,各个冻藏时期后大黄鱼的色素细胞面积;A0,冻结前色素细胞面积;Am,色素细胞完全发散后的面积减去完全收缩的面积之差[17]。
1.3.6 pH值和电导率值
称取5 g鱼肉,加入45 mL蒸馏水,均匀静置30 min后过滤,用pH计和电导率仪分别测其滤液的pH值与电导率。
1.3.7 质构
取背肌鱼块(2 cm×2 cm×1 cm)去皮,拭干后采用全质构面剖析法(TPA模式)进行测试[18],采用P/5探头,测试速度50 mm/min,形变量50%,回程距离30 mm;剪切实验,测试速度50 mm/min,回程距离30 mm。
1.3.8 保水性

(4)
蒸煮损失[20]:取(5±0.2)g解冻后的样品置于烧杯中,80 ℃水浴加热30 min后取出,冷却至室温后称量鱼肉质量。按照公式(5)计算蒸煮损失率:

(5)
1.3.9 TBA值
参照VYNCKE[21]和吴林洁等[22]方法,称取肉样10.0 g,研磨后加入50 mL 75g/L的三氯乙酸溶液(含体积分数0.1%的 EDTA),振荡摇匀,静置30 min,滤纸过滤。移取上清液5 mL,加入5 mL 0.02 mol/L TBA溶液,混匀置于100 ℃水浴锅内,保温40 min,取出冷却1 h,10 000 r/min 离心25 min。将上清液倒入25 mL 比色管内,加入5 mL 氯仿,摇匀、静置、分层,吸出上清液,测定532 nm 和600 nm 波长处吸光值,按照公式(6)计算TBA 值:
(4)
式中:m, 样品质量,g;A532、A600, 样品在波长532和600 nm处的吸光度。
1.3.10 过氧化值
测定方法参照标准GB 5009.227—2016,每个样品平行测定3次。
1.3.11 数据分析
数据采用Excel、Origin、SPSS等软件处理分析,结果以“均值±标准偏差”表示,进行单因素方差分析,若数据有显著性差异,再进行Duncan氏法多重比较,P<0.05表示差异性显著。
2 结果与讨论
2.1 冻藏时间对大黄鱼感官评分的影响
养殖大黄鱼在-18 ℃冻藏过程中的感官评分如表2所示。由表2可知,随着冻藏时间的延长,大黄鱼外观、色泽、气味、质地和综合得分均呈现下降趋势,且差异性显著(P<0.05)。经过冻藏6个月后,气味指标下降的幅度最小,而色泽指标下降的幅度最大,表明大黄鱼色泽在冻藏期间的变化程度最高,可能是冻藏期间大黄鱼肌肉色素的褐变、鱼肉绿变、美拉德反应和冰晶生长的多重影响导致。冻藏2个月时,大黄鱼外观和气味感官指标和F0相比差异不显著(P>0.05),色泽和质地感官指标与F0相比差异显著(P<0.05)。F4和F6大黄鱼感官各指标均显著低于F0(P<0.05)。到达第4个月时,大黄鱼肌肉色泽由富有光泽变为暗黄色,这是由于鱼皮中原本存在的黄色类胡萝卜素溶解于肌肉中的脂质,在贮藏期间逐渐向肌肉扩散的缘故[23],这与F4大黄鱼体表b*值下降显著的结果相一致。到达F6时,鱼块稍散裂,色泽暗淡,肌肉松软,弹性不足,这是由于随着贮藏时间的延长,微生物和自身酶的作用,导致鱼肉的色香味形均变差。根据权重比例的加权综合得分的变化趋势和各感官指标的变化趋势相同,且采用综合感官得分可反映出大黄鱼感官品质随着贮藏时间的变化[9]。

表2 冻藏时间对大黄鱼感官评分的影响Table 2 Effect of frozen storage time on sensory score of P.crocea
2.3 冻藏时间对大黄鱼体表色差的影响
大黄鱼冻藏过程中口唇和肌肉色差如表3所示。

表3 冻藏时间对大黄鱼口唇和肌肉色差值变化Table 3 Changes of lip color and muscle color of P.crocea during frozen storage
随着冻藏时间的延长,除了冻藏F4的L*值,大黄鱼口唇和肌肉体表色差均逐渐下降。大黄鱼口唇色差中随冻藏时间延长a*值逐渐下降且均发生了显著变化(P<0.05)。口唇b*值∶F0>F2、F4>F6(P<0.05),推测一方面由于贮藏过程中小冰晶的逐渐消失和大冰晶的逐渐增多,影响内分泌系统调节中色素细胞的代谢和分化等形态学变化过程,另一方面由于鱼肉褐变逐渐向四周扩散从而影响到口唇部位的扩散变化过程。扩散变化的较弱影响与大黄鱼肌肉b*值的逐渐下降且均变化显著(P<0.05)的结果相似。肌肉部位a*:F0、F2> F4> F6(P<0.05),鲜红色的下降推测是由于冻藏环境中供氧中止,鱼肉中肌红蛋白以及少量的血红蛋白离解氧成为还原型,发生化学反应产生褐变,氧化肌红蛋白生成率逐渐降低,导致颜色变淡变暗。
大黄鱼冻藏过程中体表色差值和分布规律如图2所示,由图2-a可知,冻藏各阶段过程中,L*值均有从头至尾方向中间深头尾两端浅的分布规律。除背部B5外,大黄鱼腹部和背部L*值均有F0> F2、F4>F6(P<0.05),尾部L*值呈现近头端(C1、C2、C3)>远头端(C4、C5、C6)的规律,且近头端L*值F0、F2>F4、F6(P<0.05),但远头端间差异不显著(P>0.05)。由图2-b可知,冻藏过程中大黄鱼腹部偏红,尾部和背部偏绿(除F0外)。腹部a*值F0> F2、F4>F6(P<0.05),背部a*值F0、F2、F4>F6(P<0.05),尾部a*值F0> F2、F4> F6(P<0.05),且近头端a*值显著大于远头端(除F0外),说明冻藏过程中随着贮藏时间延长大黄鱼a*值逐渐减小,颜色变淡,与肌红蛋白发生的褐变化学反应有关。

由图2-c可知,随冻藏时间延长,大黄鱼体表b*值逐渐降低,黄色变暗并有一定发白现象,这是由于在冻藏过程的缺氧加速了鱼肉绿变,以及酶影响了还原糖和氨基酸的化学反应产生褐色。除A5和B2两个部位外,腹部和背部b*值均有F0> F2、F4> F6(P<0.05)的变化规律。尾部除C3外,b*值F0> F2、F4> F6(P<0.05),但尾部b*值差异不显著,推测结果是尾部黄类胡萝卜素和红类胡萝卜素色素细胞的形态学和生理学变化过程较弱导致。
2.4 冻藏时间对大黄鱼总色素含量的影响
大黄鱼冻藏过程中总色素含量变化如图3所示,由图3可知,养殖大黄鱼在冻藏过程中腹部皮肤的总色素含量(84.24~143.14)>背部(41.45~53.94)(P<0.05),说明大黄鱼体色各种色素着色在腹部较集中。腹部总色素含量在冻藏过程中F0>F2、F4>F6(P<0.05),其中从开始到冻藏第2个月之间显著下降,原因是冻藏初期大黄鱼体内微生物和自身酶的新陈代谢仍然较快,鱼肉褐变、绿变等化学反应发生导致自然色泽的分解;而F4到F6冻藏期间总色素含量下降显著,推测是经过F2到F4期间的积累,导致色素颗粒量在贮藏时的变化以及表皮层的色素细胞在表层中迁移,这个缓慢的形态学变化使得总色素含量下降显著[24]。背部总色素含量在冻藏过程中各个阶段下降但均不显著(P>0.05),表明大黄鱼背部皮肤在-18 ℃冻藏条件下鱼肉褐变以及色素细胞的形态学和生理学变化均不明显。

图3 冻藏过程养殖大黄鱼皮肤总色素含量变化Fig.3 Changes of total pigment content in skin of cultured P.crocea during frozen storeage
2.5 冻藏时间对大黄鱼色素细胞面积的影响
大黄鱼冻藏过程中各部位色素细胞平均面积大小如表4所示。由表4可知,大黄鱼在-18 ℃冻藏0~6月过程中,鱼鳍和鳞片部位的黑、黄色素细胞均为发散(平均面积变大),皮肤部位的黑、黄色素细胞均为收缩。由于大黄鱼组织细胞周围有薄而软富有弹性的原生质膜,细胞内水分受冻膨胀时,一般情况下不会破裂而导致细胞增大[25]。推测鱼鳍和鳞片部位的色素细胞内水分冻结膨胀及冻藏过程中冰晶的缓慢增长导致细胞面积增大,而皮肤部位色素细胞在冻藏过程中的冰晶增长较强,导致细胞破裂而细胞面积变小。随着冻藏时间的延长,鱼鳍部位的黑和黄色素细胞平均面积大小均有F0< F2< F4< F6,且除F4至F6期间的黄色素外,其发生的变化均有显著性差异(P<0.05);而鳞片部位的黑和黄色素细胞平均面积大小均有F0

表4 冻藏过程养殖大黄鱼色素细胞平均面积Table 4 Average area of pigment cells in cultured P.crocea during frozen storage
大黄鱼冻藏过程中各部位色素细胞平均面积变化率如图4所示。随着冻藏时间的延长,鳞片部位的黑和黄色素细胞平均面积变化率逐渐增大,均有F2< F4< F6(P>0.05)的变化规律,推测是由于鳞片部位色素细胞受冻膨胀和冰晶生长影响较弱。鱼鳍部位的黑色素细胞平均面积变化率逐渐增大,且F2
2.6 冻藏时间对大黄鱼pH和电导率的影响
pH和电导率均是判定水产品品质优劣的重要指标,在冻藏过程中,微生物不断地把蛋白质、脂肪等分解成小分子物质从而产生大量离子,使鱼肉浸出液导电能力发生变化[26]。冻藏过程养殖大黄鱼pH和电导率值如图5所示。养殖大黄鱼pH在冻藏过程中随着冻藏时间的延长先下降后上升,与张志广[27]和廖媛媛等[28]研究的大黄鱼冻藏期间pH值变化规律一致。这是因为当水产动物停止呼吸时,血液循环停止而供氧也停止,组织呼吸转变为无氧的糖酵解途径,体内的糖原就开始分解,产生乳酸使肌肉的pH值下降[29-30]。随着冻藏时间的延长,蛋白质开始分解,随着呈碱性产物地不断增加,使肌肉pH值开始回升[27]。大黄鱼在冻藏过程中电导率值呈先降低后升高的变化趋势,与车旭等[31]的研究中电导率变化趋势一致。这是由于冻藏初期鱼肉中酶和微生物活性被迅速抑制,但催化等作用仍继续缓慢进行,随着冻藏时间的积累,冻藏后期鱼肉在蛋白酶和微生物的作用下分解成小分子物质,产生大量离子,使鱼肉中的电解质浓度增大,导致其电导率增加的结果。
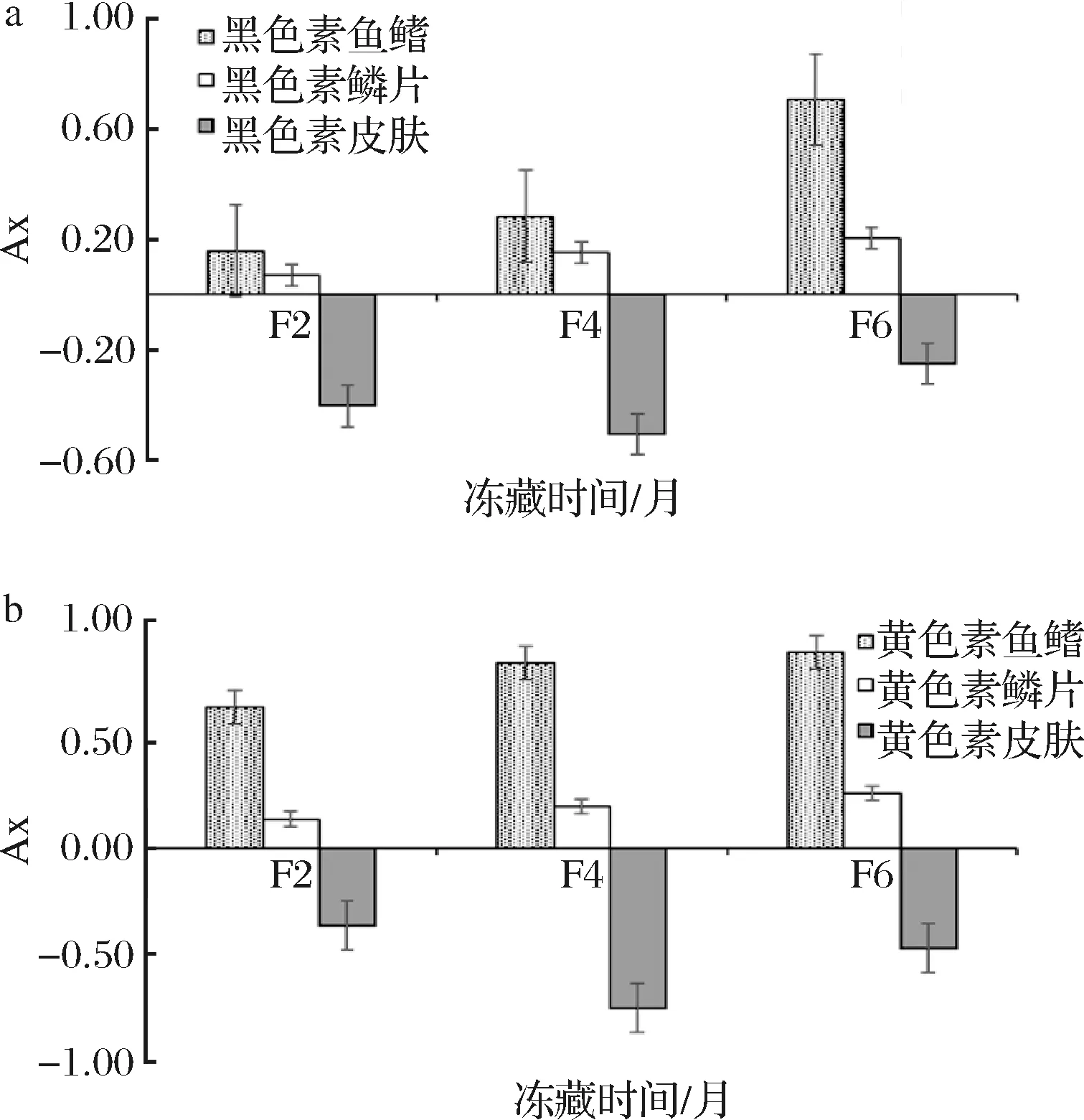
a-黑色素;b-黄色素图4 冻藏过程大黄鱼各部位色素细胞面积变化率Fig.4 Changing rate of pigment cell size in P.crocea during frozen storage
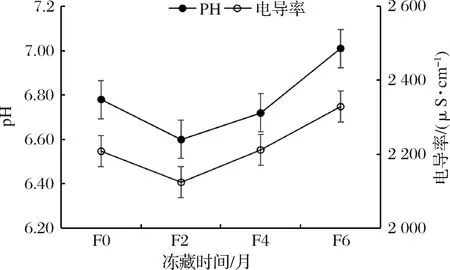
图5 冻藏过程养殖大黄鱼pH和电导率值变化Fig.5 Changes in pH and conductivity of cultured P.crocea during frozen storage
2.7 冻藏时间对大黄鱼质构特性的影响
冻藏过程中冰晶的形成重结晶是影响水产品组织在冻融过程发生相应变化的主要因素[32]。冰晶形成使组织液态水减少,组织比表面积增大对组织细胞造成机械损伤,细胞间隙增大,从而使肉质失去弹性,组织软塌,严重影响鱼肉质构特性[33-35]。冻藏过程中养殖大黄鱼质构特性指标如表5所示,随着冻藏时间的延长,除了内聚性外,硬度、弹性、胶黏性、咀嚼性和剪切力质构特性均逐渐下降。其中肌肉弹性、胶黏性和咀嚼性均为F0>F2>F4、F6(P<0.05),冻藏前4个月下降显著;冻藏过程中硬度F0>F2>F4>F6(P<0.05),随着冻藏时间延长,各阶段硬度均显著下降;剪切力在冻藏过程中前2个月变化不显著,F0>F2(P>0.05),而冻藏2个月后剪切力下降显著,F0、F2>F4>F6(P<0.05)。

表5 冻藏过程养殖大黄鱼质构特性变化Table 5 Changes in texture profiles of cultured P.crocea during frozen storage
2.8 冻藏时间对大黄鱼保水性的影响
肉及肉制品的保水性影响其质构、外观和贮藏稳定性,可反映肌肉在冻藏过程中对原有水分的保持能力,是重要的品质参数[28],冻藏过程养殖大黄鱼保水性指标变化如图6所示。由图6可知,大黄鱼鱼肉的汁液损失率随着冻藏时间的延长不断增大,从冻藏初始的11.31%上升至冻藏第6个月的28.61%,结果与唐佳楣等[36]研究的慢冻组在冻藏过程的汁液损失率结果相近(第0天12%,第180天27%),且F0< F2< F4< F6(P<0.05),冻藏各阶段发生的变化均显著,且在冻藏第2~4个月期间上升速率最快。蒸煮损失率随冻藏时间增长不断增大,从冻藏初始的14.23%上升至冻藏第6个月的31.94%,冻藏各阶段发生的变化均显著(P<0.05),且在冻藏第2~4个月期间上升速率最快,大黄鱼肌肉保水能力下降相对明显。表明鱼肉经过冻藏后肌肉组织细胞受到冰晶生长或重结晶的影响,导致在离心力的作用下自由水更易渗出以及蒸煮时的热变形使细胞结构破坏,肌肉保水性整体下降。

图6 冻藏过程养殖大黄鱼保水性指标变化Fig.6 Changes of water retention indexes of cultured P.crocea during frozen storage
2.9 冻藏时间对大黄鱼脂肪氧化的影响
鱼体脂类分为组织脂肪和贮藏脂肪,主要是甘油三酸酯,还有一些脂类,如磷酸甘油酯和固醇类等[37],脂类物质极易发生水解和氧化这2种和品质有直接影响关系的生物化学反应[38]。大黄鱼富含高不饱和脂肪酸,冻藏过程中双键部位被缓慢氧化分开后生成醛、酮等物质,进一步和蛋白质、糖反应影响风味和鲜度。冻藏过程养殖大黄鱼脂肪氧化如图7所示,随着冻藏时间的延长,过氧化值和TBA值均逐渐升高,其中过氧化值由F0的3.36 mmol/kg上升至F6的4.93 mmol/kg,其中F0的结果与唐宏刚等[39]研究的养殖大黄鱼对照组结果相近,且F6、F4>F2、F0(P<0.05),表明在-18 ℃冻藏2个月后过氧化值开始显著上升。TBA值在冻藏期间由F0的0.26 mg/100 g上升至F6的0.60 mg/100 g,结果与张艳霞等[40]研究的120 d内真空包装组大黄鱼TBA值结果相近,且F4> F2> F0(P>0.05),F6>F2>F0(P<0.05),表明-18 ℃真空包装条件下冻藏初期到冻藏第4个月脂肪氧化程度上升较缓慢,真空包装方式可以在一定程度上减缓脂肪的酸败,从而保持大黄鱼鲜度,冻藏4个月后,TBA开始显著上升,脂肪氧化程度较强。

图7 不同冻结温度下养殖大黄鱼脂肪氧化情况Fig.7 Effect of frozen storage time on fat oxidation in cultured P.crocea
3 结论
本实验研究了真空包装养殖大黄鱼在-18 ℃冻藏过程中的体色和肌肉品质特征变化。结果表明:随着冻藏时间的延长,大黄鱼各感官得分均呈现下降趋势,冻藏6个月后,气味感官下降的幅度最小,色泽下降的幅度最大。冻藏期间大黄鱼口唇和肌肉的a*、b*均显著降低,F2至F4阶段变化相对平缓,而L*先下降后上升;腹背部L*和a*冻藏过程中遵循中间深头尾两端浅的分布规律,F0至F4下降相对平缓,F6时显著降低;尾部近头端色差值均大于远头端,除了F6的a*,下降均不显著。腹部总类胡萝卜素含量逐渐减小(P<0.05),而背部总色素含量下降相对缓慢(P>0.05);随着冻藏时间的延长,鱼鳍和鳞片部位的黑、黄色素细胞均为发散,且色素细胞大小变化率逐渐增大,鳞片部位变化相对平缓;皮肤部位的黑、黄色素细胞均为收缩,色素细胞平均面积变化率先上升后下降。冻藏期间大黄鱼的pH和电导率值均先减小后增大,F6时显著增大(P<0.05);随着冻藏时间的延长,大黄鱼质构特性出现不同程度的劣化,除了内聚性,硬度、弹性、胶黏性、咀嚼性和剪切力质构特性均逐渐下降;汁液损失率和蒸煮损失率在冻藏期间均显著升高(P<0.05), F2至F4期间上升最快,肌肉保水性明显下降;肌肉过氧化值和TBA值均逐渐增大,且F4到F6期间上升显著,脂肪氧化程度加重。综合表明,-18 ℃冻藏6个月养殖大黄鱼的体色和肌肉品质特征均逐渐下降,除保水性外,F4至F6阶段品质均下降较快,研究可为养殖大黄鱼冻藏过程中体色变化机制和品质保持提供支撑。

