藤黄酸/CaAl-层状双金属氢氧化物的制备及其缓冲性能研究
刘 琦,武毓琦,吴 茜,赵 柔,韩晓燕*,张 毅
(1.天津中医药大学中药学院,天津 300193;2.天津中医药大学中药制药工程学院,天津 300193)
藤黄酸(gambogic acid,GA)是从中药藤黄中提取的一种弱酸性化学物质,具有广泛的抗肿瘤活性[1-2]。GA在水中的溶解度极小,稳定性较差且在体内半衰期短,极大地限制了其临床应用。目前,大多采用注射剂、纳米粒、脂质体等构建GA靶向纳米药物递送系统,以改善其不足。
层状双金属氢氧化物(layered double hydroxides,LDH)[3-4]是由带正电荷的主体层板和层间阴离子通过非共价键的相互作用组装而成的一类无机层状纳米材料,具有优异的离子交换能力和生物相容性,作为新型的药物缓释载体被广泛应用于医药领域。常见的LDH类型为MgAl-LDH。研究表明,CaAl-LDH可提供短期持续和高振幅的Ca2+,诱导线粒体水平升高,促使癌细胞凋亡[5],从而增强抗癌作用。
为探讨GA和CaAl-LDH的协同抗肿瘤作用,作者采用水热法制备载体CaAl-LDH,利用LDH层间阴离子的可交换性,将GA插入CaAl-LDH层间制备载药复合物GA/CaAl-LDH,通过FTIR、XRD对CaAl-LDH和GA/CaAl-LDH进行表征,采用正交实验优化制备工艺,并研究其缓冲性能。
1 实验
1.1 材料、试剂与仪器
藤黄酸,南京春秋生物工程有限公司。
二水氯化钙、六水氯化铝,上海凛恩科技发展有限公司;其它试剂均为分析纯。
ME104E/02型万分之一电子天平,梅特勒-托利多仪器(上海)有限公司;DF-101S型集热式恒温加热磁力搅拌器,巩义予华仪器有限责任公司;ZKXFB-2型电热真空干燥箱,上海树立仪器仪表有限公司;SCIENTZ-950E型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;高效液相色谱仪,日本岛津公司;Varian 640型傅立叶变换红外光谱仪;Miniflex 600型X-射线粉末衍射仪。
1.2 载体CaAl-LDH的制备
取二水氯化钙、六水氯化铝溶于200 mL去CO2的去离子水中,使Ca/Al值(Ca与Al物质的量比)分别为2∶1、3∶1、4∶1,N2保护下缓慢滴入1.26 mol·L-1NaOH溶液将pH值调至11,常温磁力搅拌24 h后,陈化5 h;过滤,沉淀用去离子水洗净后分散于100 mL去CO2的去离子水中,150 ℃下水热8 h;过滤,沉淀水洗2次,于65 ℃真空干燥24 h,即得不同Ca/Al值的白色块状物CaAl-LDH。
1.3 载药复合物GA/CaAl-LDH的制备
参照文献[6]方法,取0.25 g不同Ca/Al值的CaAl-LDH溶于60 mL去离子水中,超声分散制成混悬液;同时取0.05 g GA溶于30 mL甲醇中;两者混合,N2保护下60 ℃、500 r·min-1反应10 h;过滤,沉淀水洗2次、乙醇洗2次,于40 ℃真空干燥24 h,即得不同Ca/Al值的GA/CaAl-LDH。
1.4 CaAl-LDH及GA/CaAl-LDH的结构表征
分别通过FTIR和XRD对CaAl-LDH、GA/CaAl-LDH的结构进行表征。
1.5 GA/CaAl-LDH中GA含量的测定
参照文献[7]方法,进行GA含量测定方法学考察,得到GA标准曲线方程为A=15002c+1419.3(R=0.9998)。精密称取10 mg GA/CaAl-LDH置于10 mL容量瓶中,滴加2滴浓H3PO4破坏载药复合物,加入甲醇溶解GA并定容;经0.45 μm微孔滤膜过滤,吸取20 μL,按色谱条件[7]进样测定。将峰面积代入GA标准曲线方程,得GA含量,再分别按式(1)、(2)计算包封率和载药量:

(1)
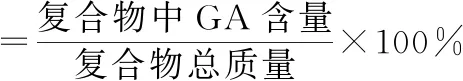
(2)
1.6 GA/CaAl-LDH的制备工艺优化
在确定最佳Ca/Al值的基础上,以反应温度、药载比(药物与载体的质量比)、反应时间、转速为考察因素,以载药量为指标进行L9(34)正交实验,优化GA/CaAl-LDH制备工艺。正交实验的因素与水平见表1。
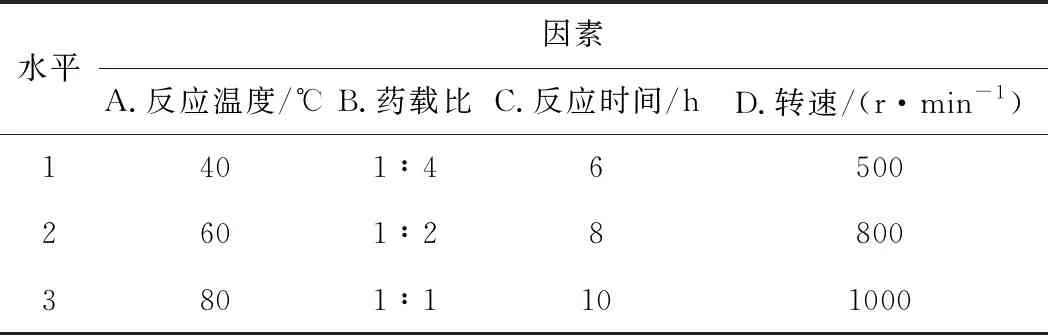
表1 正交实验的因素与水平
1.7 GA/CaAl-LDH的缓冲性能测试
在最佳工艺条件下制备载药复合物GA/CaAl-LDH,滴加0.1 mol·L-1HCl溶液制成悬浮液,测定溶液pH值,以HCl溶液消耗体积为横坐标、溶液pH值为纵坐标绘制缓冲曲线,评价其缓冲性能[8]。
2 结果与讨论
2.1 CaAl-LDH及GA/CaAl-LDH的表征
2.1.1 FTIR分析(图1)
从图1可知,CaAl-LDH在3 635 cm-1和3 489 cm-1处出现吸收峰,归因于LDH层板上的O-H和LDH层间水分子的O-H伸缩振动,1 620 cm-1处的吸收峰归因于LDH层间水分子的O-H弯曲振动,400~800 cm-1处的吸收峰是由M-O、M-O-M和O-M-O(M=Ca、Al)的拉伸振动引起的,与文献[9]报道一致。GA/CaAl-LDH的FTIR图谱中出现了GA的特征吸收峰:2 925 cm-1、2 969 cm-1处甲基和亚甲基的吸收峰,1 416 cm-1、1 547 cm-1、1 594 cm-1处苯环骨架伸缩振动峰,1 736 cm-1处羧酸的C=O伸缩振动峰。表明,GA成功插入CaAl-LDH层间。
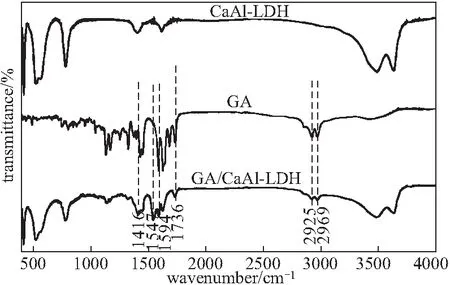
图1 CaAl-LDH、GA、GA/CaAl-LDH的FTIR图谱Fig.1 FTIR spectra of CaAl-LDH,GA,and GA/CaAl-LDH
2.1.2 XRD分析(图2)
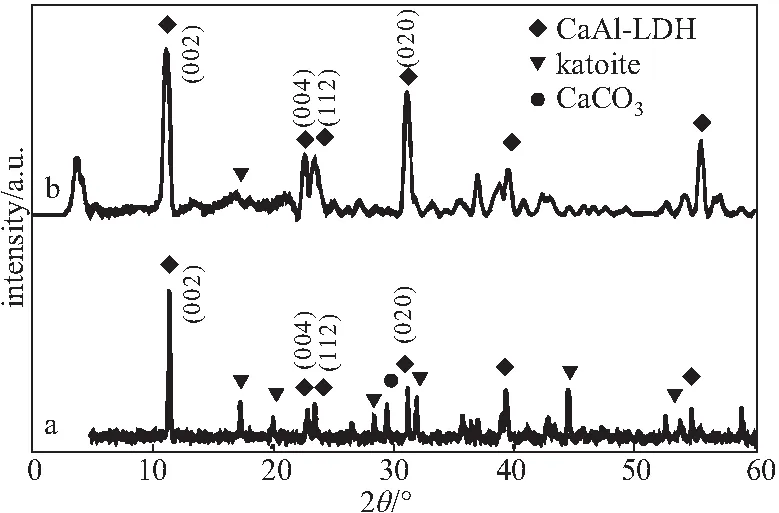
a.CaAl-LDH b.GA/CaAl-LDH
从图2可知,CaAl-LDH的尖峰主要集中在11.48°、22.92°、23.54°和31.18°处,分别对应六边形晶体系统中的(002)、(004)、(112)和(020)晶面,进一步计算出晶胞参数a=9.85 Å、b=5.72 Å、c=16.89 Å,证明CaAl-LDH的晶体结构与文献[10]报道的一致。此外,在制备CaAl-LDH的过程中,同时产生水钙铝榴石(katoite)和碳酸钙副产物,推测可能是水解反应时溶液中盐离子较少导致水钙铝榴石的形成。与CaAl-LDH比较,GA/CaAl-LDH的(002)晶面对应的2θ向低角度移动,层间距增大,这是由于GA分子插入CaAl-LDH层间时引起晶格结构膨胀,进一步验证载药成功。
2.2 最佳Ca/Al值的确定
以不同Ca/Al值的CaAl-LDH制备的GA/CaAl-LDH的载药效果见表2。
从表2可知,当Ca/Al值为2∶1时,GA/CaAl-LDH的载药量最大。这是因为,随着Ca/Al值的减小,CaAl-LDH层板的正电荷密度逐渐增大,CaAl-LDH与GA之间的静电相互作用逐渐增强,载药量相应增大。因此,选择Ca/Al值为2∶1的CaAl-LDH制备GA/CaAl-LDH。
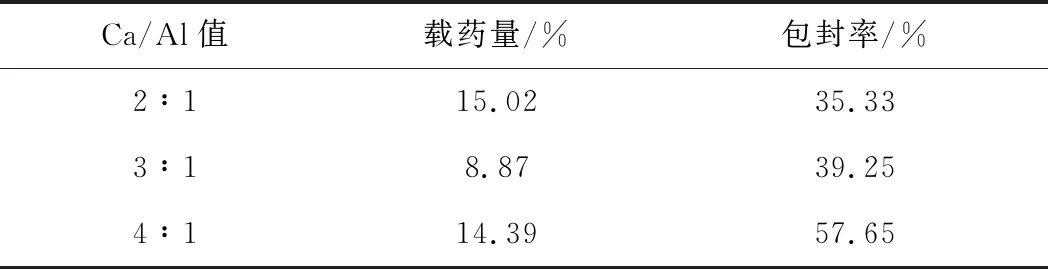
表2 不同Ca/Al值的GA/CaAl-LDH的载药效果
2.3 最佳制备工艺的确定
GA/CaAl-LDH制备工艺优化的正交实验结果见表3,方差分析见表4。
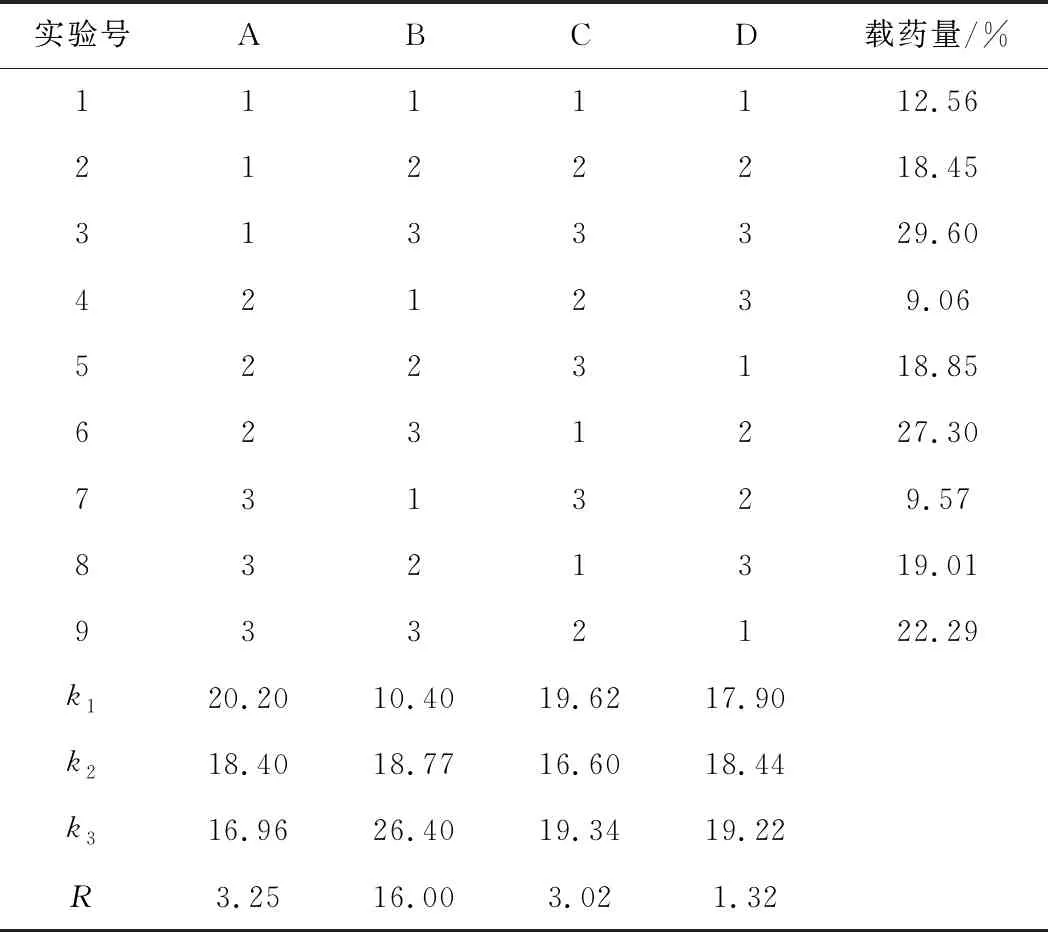
表3 L9(34)正交实验结果
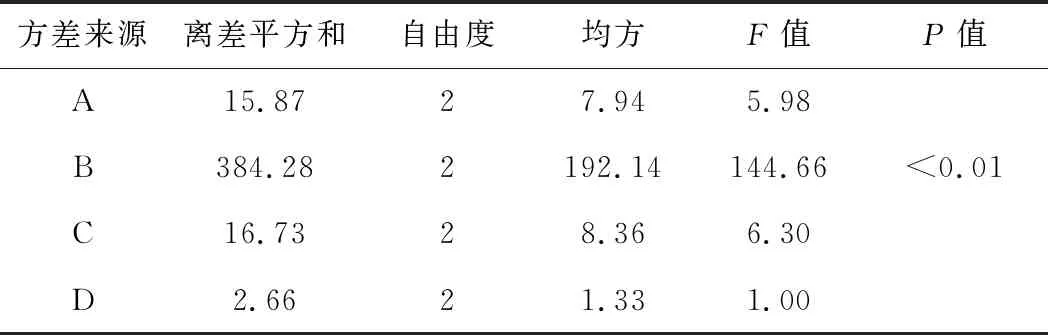
表4 方差分析
从表3可知,各因素对GA/CaAl-LDH载药量的影响大小为:B>A>C>D,即药载比的影响最大,反应温度与反应时间次之,转速最小;最佳制备工艺为A1B3C1D3,即反应温度40 ℃、药载比1∶1、反应时间6 h、转速1 000 r·min-1。从表4可知,因素B的P值<0.01,即药载比对载药量影响极显著。
2.4 GA/CaAl-LDH的缓冲性能
CaAl-LDH和GA/CaAl-LDH的缓冲曲线如图3所示。
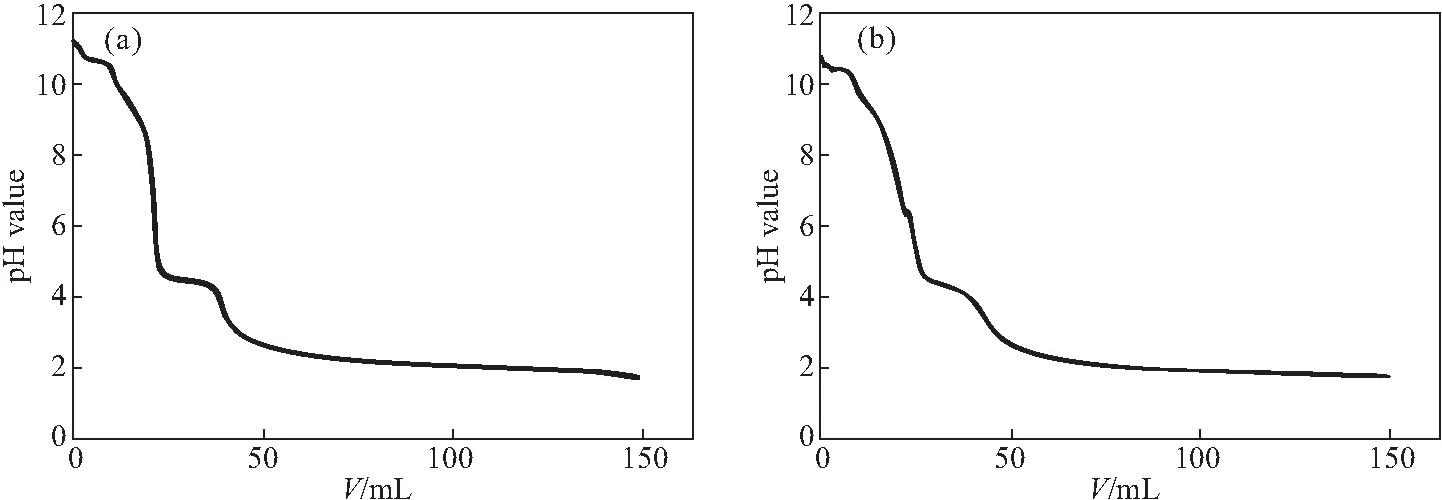
图3 CaAl-LDH(a)和GA/CaAl-LDH(b)的缓冲曲线Fig.3 Buffering curves of CaAl-LDH(a) and GA/CaAl-LDH(b)
从图3可知,载体CaAl-LDH的主要缓冲作用在pH值4.4处,推测CaAl-LDH的缓冲性能可能归因于层间的羟基,这也是它作为抗酸剂的原因;而载药复合物GA/CaAl-LDH的缓冲曲线与载体CaAl-LDH的相近,具有与载体CaAl-LDH相同的缓冲性能,主要缓冲作用在pH值4.2处。
3 结论
首先采用水热法成功制备了CaAl-LDH,然后采用离子交换法将GA插入到CaAl-LDH层间制备载药复合物GA/CaAl-LDH,最佳制备工艺为:Ca/Al值为2∶1、反应温度40 ℃、药载比1∶1、反应时间6 h、转速1 000 r·min-1。该载药复合物具有良好的载药性能和缓冲性能,CaAl-LDH有望成为一种新型的中药抗肿瘤成分高效载体。

