环糊精与表面活性剂主客体作用诱导的金纳米棒可控自组装
肖军燕 ,齐利民
1北京大学化学与分子工程学院,北京分子科学国家研究中心,北京 100871
2中国工程物理研究院科技信息中心,四川 绵阳 621900

1 引言
纳米粒子自组装是一种自下而上构筑新型功能材料和纳米器件的有效策略1-4。金纳米棒(GNR)是一种典型的各向异性等离激元纳米结构5,金纳米棒的自组装将引起表面等离激元共振(SPR)吸收峰的移动或表面增强拉曼散射(SERS)性能的提高,因此在传感和检测等方面具有应用前景6-11。例如,Kotov等人7通过生物分子识别作用,诱导金纳米棒分别发生头对头和肩并肩可控组装,并实现了对微囊藻毒素的检测。我们课题组则利用偶氮苯氧乙酸钠的光致顺反异构特性,在水溶液中实现了金纳米棒的光控可逆组装,并实现了溶液相SERS检测的开关设计11。
近年来,利用超分子主客体相互作用来诱导纳米粒子的自组装成为一大研究热点12-14。常用于诱导无机纳米粒子自组装的主体分子主要包括环糊精(CD)、葫芦脲、杯芳烃、柱芳烃等。例如Scherman等人15利用葫芦脲的超分子作用实现了金纳米棒的头对头组装。Yam等人16则利用Pt基超分子作用,诱导金纳米棒发生肩并肩组装。
环糊精作为一类典型的超分子主体,具有亲水表面和不同大小的疏水空腔,可以在水溶液中与许多疏水性的小分子结合,例如甲苯、卟啉、偶氮苯类分子、金刚烷胺、表面活性剂等17。利用这些超分子主客体作用可以直接引发或者阻止纳米粒子发生溶液相组装18-20。例如,Li等人12利用β-环糊精(β-CD)与负电性质的5,15-双(4-磺酸基苯基)卟啉分子的主客体相互作用,阻止了金纳米棒的组装。值得一提的是,Ma等人20则将金纳米棒两端用巯基β-CD修饰,然后引入含两个偶氮苯的对称分子,实现了其头对头光响应组装和解组装。目前有关利用主客体作用来诱导金纳米棒组装的工作中,大多需要预先使用含巯基的分子对金纳米棒进行表面化学修饰,该修饰过程显然增加了体系的复杂性和操作上的繁琐性。
本文利用α-环糊精(α-CD)与金纳米棒表面修饰的十六烷基三甲基溴化铵(CTAB)的超分子主客体作用,成功实现了金纳米棒在水溶液中的可控组装。通过调节α-CD浓度,可以选择性地获得金纳米棒的头对头和肩并肩组装体。借助于α-淀粉酶对α-CD的水解作用,还利用该组装体系实现了对溶液中微量α-淀粉酶的检测。
2 实验部分
2.1 实验试剂
十六烷基三甲基溴化铵(CTAB,纯度98%)购于Alfa Aesar;氯金酸(纯度99.9%)购于北京化学试剂公司。以下药品均为分析纯:硼氢化钠购于国药集团化学试剂有限公司;硝酸银购于北京北化精细化学品有限公司;L-抗坏血酸购于国药集团化学试剂有限公司;α-环糊精和β-环糊精购于Alfa Aesar;α-淀粉酶(来源为Aspergillus oryzae,35.7 U·mg-1)购于Sigma。
2.2 表征仪器
透射电子显微镜(TEM)表征仪器为日本JEOL JEM-2100型透射电镜(工作电压为200 kV)和日本JEOL JEM-200CX型透射电镜(工作电压为160 kV)。紫外-可见-近红外吸收光谱(UV-Vis-NIR)由日本Hitachi U-4100型紫外可见近红外分光光度计测得。红外光谱(IR)由美国Nicolet iN10MAX型微区傅里叶变换红外光谱仪测得。
2.3 金纳米棒合成与分散液制备
金纳米棒参考文献21报道的种子生长法,通过适当的条件优化后制备得到。种子溶液制备:将0.125 mL浓度为10 mmol·L-1的HAuCl4溶液加入3.75 mL浓度为0.1 mol·L-1的CTAB溶液中,再加入0.3 mL预先在4 °C冰箱冷却30 min的10 mmol·L-1的NaBH4溶液,搅拌2 min。然后在27 °C水浴中静置4 h,作为种子溶液。金纳米棒生长溶液制备:向25 mL浓度为0.1 mol·L-1的CTAB溶液中依次加入1.075 mL浓度为10 mmol·L-1的HAuCl4、0.24 mL浓度为10 mmol·L-1的AgNO3以及0.17 mL浓度为0.1 mol·L-1的抗坏血酸溶液,混合均匀,27 °C水浴预处理一段时间。然后再加入0.115 mL的种子溶液,混合10 s,然后在27 °C水浴中静置至少5 h,得到含有0.1 mol·L-1CTAB的金纳米棒原始分散液待用。
所制备得到的金纳米棒是[001]取向的单晶,长度为(37 ± 4) nm,直径为(11 ± 1) nm,轴径比约为3.4 (图S1,见Supporting Information)。据文献22报道,轴径比约(3.5 ± 0.7)的GNR的摩尔吸光系数(ε)为4.6 × 109mol-1·L·cm-1,根据Beer-Lambert定律计算,金纳米棒原始液中GNR的粒子浓度约为0.8 nmol·L-1。可通过多次离心以及再分散的方法调节分散液中GNR基元和CTAB至合适的浓度。采用的离心速度为12000 r·min-1,离心时间为10 min。在典型金纳米棒组装实验中,GNR的粒子浓度与原始液相同(0.8 nmol·L-1),CTAB浓度则是原始分散液的1/100 (1 mmol·L-1)。
2.4 α-环糊精诱导金纳米棒组装
采用2 mL的溶液体系研究环糊精诱导下的金纳米棒组装。具体实验步骤为:将0.8 mL GNR和CTAB浓度分别为0.8 nmol·L-1和1 mmol·L-1的分散液与0.8 mL去离子水混合,然后在搅拌速度约为150 r·min-1的情况下,快速加入0.4 mL一定浓度的α-CD水溶液;搅拌1 min后,用30 s的时间迅速转移样品至比色皿,并测试400-1100 nm范围的Vis-NIR吸收光谱。静置不同时间后,测试吸收光谱随组装时间的变化。向分散液中加入不同体积的α-CD时,相应调节水的加入量,使总体积始终保持2 mL。
测试光谱后,取15 μL溶液滴于电镜铜网,让溶液迅速铺展,避免溶剂蒸发对组装的影响,干燥后用于TEM表征。
2.5 利用金纳米棒组装体系实现α-淀粉酶检测
配置1 mg·mL-1的α-淀粉酶溶液,然后将一定体积的α-淀粉酶与0.2 mL 5 mmol·L-1的α-CD预混合30 min,让淀粉酶充分水解α-CD,再向体系中快速加入0.4 mL金纳米棒分散液(CTAB浓度为1 mmol·L-1)。搅拌1 min后,测试Vis-NIR吸收光谱。为保持2 mL总体积不变,需要根据α-淀粉酶用量的变化调节水的加入量。
3 结果与讨论
3.1 α-环糊精诱导金纳米棒可控自组装
3.1.1 不同α-CD浓度下GNRs的自组装
实验中观察到溶液中的金纳米棒可以在α-CD的诱导下发生自组装,并且α-CD浓度对GNRs的溶液相组装形式有很大影响。图1为一系列不同浓度的α-CD诱导GNRs发生组装的系列吸收光谱(均为加入α-CD转移至比色皿后直接测试,相当于搅拌1 min后静置~30 s后测得)。从图中可以看出,随着α-CD浓度逐渐增加至1.12 mmol·L-1,位于744 nm处的长轴方向SPR吸收峰(LSPR)的强度逐渐减弱,并且逐渐蓝移;与此同时,位于516 nm处的横轴方向SPR吸收峰(TSPR)逐渐红移。该结果意味着随着α-CD浓度的增加,纳米棒发生了肩并肩的组装23。当α-CD浓度继续增大时,LSPR则开始发生明显的红移和宽化,这意味着在高浓度α-CD的存在下金纳米棒可能更倾向于发生头对头的组装23。
为了探究不同浓度α-CD诱导下的GNR自组装,我们选取了分别对应于肩并肩和头对头组装的两个典型α-CD浓度(1.125和1.175 mmol·L-1),深入考察了GNR组装体系吸收光谱随时间的变化,并对组装体的形貌进行了TEM观测。

图1 不同浓度α-CD诱导GNRs发生组装后的吸收光谱Fig.1 Absorption spectra of GNRs after addition of different concentrations of α-CD.
3.1.2 低浓度α-CD诱导GNRs肩并肩组装
当加入α-CD的浓度为1.125 mmol·L-1时,金纳米棒分散液的吸收光谱随静置时间的变化如图2a所示。静置~30 s后测试的光谱与原始GNRs吸收光谱相比,LSPR强度减弱并且发生明显蓝移,从744 nm移动至727 nm,同时TSPR发生明显红移,从516 nm移动至540 nm。这意味着GNRs在α-CD加入后迅速发生肩并肩组装23。随着静置时间的延长,LSPR的强度进一步缓慢下降,说明组装体在继续变大,并引起沉降。大约24 h之后能观察到GNR完全聚沉,且难以通过超声处理再分散。
用TEM表征静置过程中GNRs组装体形貌,结果如图2b,c所示。可以看到,5 min时GNRs已发生了明显的肩并肩组装;15 min时同样以肩并肩组装为主,同时组装体明显变大。该结果与吸收光谱结果基本相符,表明在外加α-CD的浓度为1.125 mmol·L-1时,可以诱导GNRs发生肩并肩组装。
3.1.3 高浓度α-CD诱导GNRs头对头组装

图2 1.125 mmol·L-1 α-CD诱导GNRs发生肩并肩组装。(a)不同时间下的吸收光谱;静置(b) 5 min和(c) 15 min时所制样品的TEM照片Fig.2 Side-by-side assembly of GNRs directed by 1.125 mmol·L-1 α-CD.(a) Time-dependent absorption spectra of GNRs; TEM images of GNRs at (b) 5 min and (c) 15 min after addition of α-CD.
当加入α-CD的浓度增大到1.175 mmol·L-1时,金纳米棒分散液的吸收光谱随静置时间的变化如图3a所示。静置~30 s后测试的吸收光谱与原始GNRs光谱相比,发生明显下降,且LSPR强度降低并且发生明显红移和宽化,从744 nm移动至874 nm;而TSPR则仅有微小的移动,从516 nm移至520 nm。该结果意味着GNRs发生了头对头组装现象23,但LSPR峰的明显宽化说明聚集体的大小及聚集状态可能并不均一。随静置时间的延长,光谱进一步红移,说明组装体在继续变大,并引起沉降。与发生肩并肩组装的现象类似,大约24 h之后能观察到GNRs完全聚沉,难以通过超声处理再分散。
用TEM表征静置30 min后GNRs组装体的形貌,结果如图3b,c所示。可以发现,GNRs比较倾向于头对头的组装,能够形成一些明显的一维链状聚集,不过局部也存在一些无规聚集导致的分叉,总体呈现为网状。
3.2 α-环糊精诱导金纳米棒组装的机理探讨
3.2.1 α-CD与β-CD诱导GNRs组装的对比

图3 1.175 mmol·L-1 α-CD诱导GNRs发生头对头组装。(a)不同时间下的吸收光谱;静置(b,c) 30 min所制样品的TEM照片Fig.3 End-to-end assembly of GNRs directed by 1.175 mmol·L-1 α-CD.(a) Time-dependent absorption spectra of GNRs; (b, c) TEM images of GNRs at 30 min after addition of α-CD.

图4 不同浓度α-CD与β-CD诱导GNRs组装的吸收光谱图:(a) 1.25 mmol·L-1;(b) 1.50 mmol·L-1Fig.4 Absorption spectra of GNRs after addition of α-CD and β-CD with different concentrations:(a) 1.25 mmol·L-1; (b) 1.50 mmol·L-1.
为探讨α-CD诱导GNRs组装的机理,考察了与α-CD化学性质非常相似,但疏水空腔更大的β-CD对GNRs组装的作用。α-CD是由6个D-吡喃糖单元组成,空腔内径为5.7 Å (1 Å = 0.1 nm),而β-CD则是由7个D-吡喃糖单元组成,空腔内径为7.8 Å。在相同的实验方法条件下,图4a为两种CD都在1.25 mmol·L-1时诱导GNRs组装后吸收光谱发生的变化(图中实线对应于β-CD,虚线对应于α-CD)。可以明显的看出,该浓度下的α-CD已导致GNRs吸收光谱迅速降低或GNRs的组装;而β-CD加入后吸收光谱却非常稳定或未发生GNRs的组装。图4b为两种CD都在1.5 mmol·L-1时诱导GNRs组装后吸收光谱发生的变化。可以看出,在此较高CD浓度下,α-CD很快使得吸收光谱降至很低,对应于GNRs发生聚集沉降;而该浓度下β-CD的加入开始逐渐引起GNRs的组装。
上述结果表明,α-CD和β-CD在适宜的浓度下都可以引发GNRs的组装,但相比于α-CD,β-CD通常需要更高的浓度才能达到与α-CD相当的诱导组装程度。据文献24报道,α-CD和β-CD均具有疏水空腔,可以与带有烷基链的表面活性剂分子发生主客体包合作用,但其包合常数存在较大差异。因此,可以推测CD与CTAB的超分子主客体作用可能是GNRs发生自组装的主要诱因,而且该超分子作用的强度及超分子包合物的形态结构会显著影响GNRs的组装过程。
3.2.2 高浓度CTAB对GNRs自组装的影响
通过仔细观察图1,可以发现在α-CD浓度由0增加至1.0 mmol·L-1之前光谱基本不会发生变化,而从1.0 mmol·L-1开始,光谱才发生缓慢蓝移。考虑到混合后的GNRs分散液中存在0.4 mmol·L-1游离的CTAB,引入的α-CD分子可能会优先与溶液中游离的CTAB分子发生包合作用,当α-CD达到一定浓度之后才能进一步与GNR表面吸附的CTAB分子发生包合作用,并导致GNRs的组装。
根据以上分析可以推测,若向正在由α-CD诱导组装的GNRs体系中加入大量高浓度的CTAB,则可引入大量游离的CTAB分子,从而终止α-CD诱导的GNRs组装。为验证该推论,我们做了以下对照实验:在1.05 mmol·L-1α-CD诱导GNRs组装的体系中,当搅拌混合1 min后,向体系中加入0.7 mL 0.1 mol·L-1的CTAB溶液,使得体系中游离的CTAB浓度增加约90倍,再搅拌10 min后测试不同静置时间的光谱,结果如图S2 (见Supporting Information)所示。可以发现,静置30 min后光谱也不再发生变化,说明大量游离的CTAB分子可与金纳米棒表面吸附的CTAB分子发生竞争,阻止GNRs表面附着的CTAB分子与α-CD发生包合作用,从而避免GNRs的聚集。但需要指出的是,大量游离的CTAB分子只能终止聚集而不能使已经聚集的GNRs发生解聚。
3.2.3 α-CD诱导组装机理讨论
基于以上对照实验,获得了一些能支持环糊精与表面活性剂主客体作用诱导GNRs组装的实验证据,简述如下:(1) CD空腔尺寸可显著影响GNRs组装,即空腔更小的α-CD比β-CD能在更低浓度诱导GNRs组装;(2) α-CD浓度需要达到一定值才能诱导GNRs组装;(3)向α-CD诱导GNRs组装的体系中加入高浓度的CTAB后,可以阻止GNRs组装。
据此我们提出了α-CD与CTAB主客体作用诱导GNR组装的一个可能机理,如图5所示。该组装过程的关键在于GNR表面吸附有带正电的双层CTAB分子25,而这些起静电稳定作用的CTAB分子又可以与α-CD通过主客体包合作用形成超分子包合物26,从而导致GNR表面电荷的降低和胶体稳定性的降低。大致的组装过程是:α-CD首先与溶液中游离的CTAB发生包合作用,然后再与GNR表面CTAB相互作用形成包合物,进而导致GNR表面双层CTAB结构破坏,部分CTAB从GNR表面脱离,使得GNR表面电荷减少,溶液中的GNR逐渐失去稳定性,从而发生相互聚集或组装。图S3 (见Supporting Information)所示的红外光谱测试结果表明,相比于原始的CTAB包覆的GNR,由α-CD诱导的GNR聚集体在1025 cm-1出现了一个较强的对应于α-CD的吸收峰27,这意味着一部分α-CD/CTAB主客体复合物仍然吸附在金纳米棒的表面。
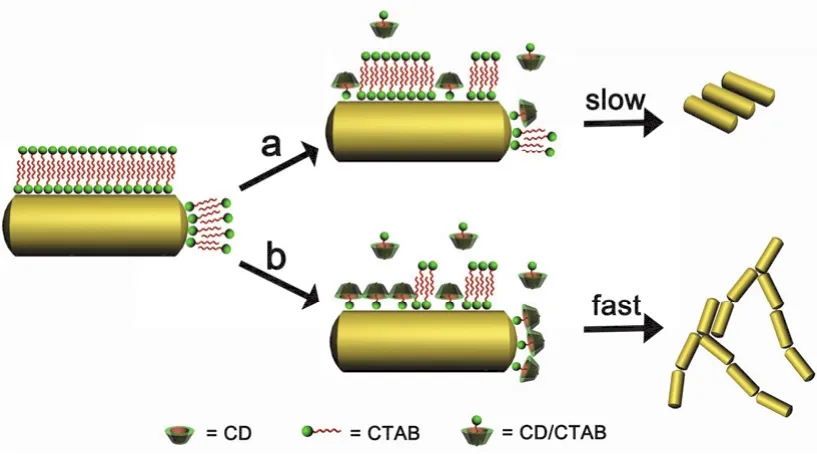
图5 α-CD与CTAB主客体作用诱导GNRs自组装的机理示意图.(a)较低α-CD浓度;(b)较高α-CD浓度Fig.5 Schematic illustration of mechanism of selfassembly of GNRs directed by host-guest interaction of α-CD and CTAB.(a) A lower α-CD concentration;(b) a higher α-CD concentration.
在α-CD浓度较低时(图5a),它们与GNRs表面少量CTAB发生包合作用,GNRs的稳定性略微降低,并以较慢的速度发生自组装,形成棒状粒子的优先聚集方式,即肩并肩组装体。根据文献28,29报道,GNRs形成肩并肩组装体时范德华吸引能更大。当α-CD浓度较高时(图5b),它们与GNR表面大量CTAB都发生明显的包合作用,GNRs极不稳定,发生快速聚集,形成动力学控制条件下的头对头组装体。值得指出的是,在高浓度α-CD存在下,GNR两端吸附的CTAB分子很有可能全部被α-CD/CTAB主客体复合物所取代,因而GNR两端所带的正电荷显著降低,端部与端部的静电排斥力大大减弱,从而有利于GNR的头对头组装。这与文献30报道的硫酸根离子诱导GNR的头对头组装具有一定的相似之处。由于聚集速度很快,同时也会出现一些无规的局部聚集形式。整体呈现为以头对头组装为主的网状聚集体。需要指出的是,这只是目前推测得到的一个可能机理,而其分子层次上的确切组装机理仍有待于深入研究。
3.3 基于金纳米棒自组装体系的α-淀粉酶检测
α-淀粉酶可以将α-CD逐渐水解至单个的D-吡喃糖单元(图6a)。因此,将α-淀粉酶引入环糊精参与的超分子主客体体系,可实现对α-淀粉酶的检测31,32。根据上述α-CD与CTAB主客体作用诱导GNRs的组装机理可以推测,因水解导致疏水空腔消失的α-CD将不能再与CTAB相互作用,即不能诱导GNRs组装。因此,我们系统研究了不同浓度α-淀粉酶对GNRs自组装的影响。这既能验证自组装机理,也可作为一种检测α-淀粉酶的方法。

图6 基于α-CD诱导GNRs组装体系的α-淀粉酶检测。(a) α-淀粉酶催化α-CD水解示意图;(b)不同浓度α-淀粉酶存在下的组装体系吸收光谱;(c) 734 nm处吸光度随α-淀粉酶浓度的变化曲线Fig.6 Detection of α-amylase based on self-assembly of GNRs directed by α-CD.(a) Schematic illustration of the hydrolysis of α-CD catalyzed by α-amylase; (b) absorption spectra GNRs after addition of α-CD in the presence of α-amylase with varied concentrations; (c) variation of absorbance at 734 nm with the concentration of α-amylase.
在保持总体积为2 mL的条件下,向不同浓度α-淀粉酶与α-CD的混合溶液中加入0.4 mL GNRs分散液,将导致GNRs不同程度的聚集,其吸收光谱如图6b所示。可以观察到随着α-淀粉酶浓度的增加,LSPR峰的下降程度逐渐减少,7.14 U·mL-1的α-淀粉酶基本可以阻止α-CD诱导的GNRs聚集。光谱中734 nm处吸光度(A734)与α-淀粉酶浓度在0-7.14 U·mL-1范围内呈正相关,如图6c所示。这也意味着可以在该浓度范围内实现对溶液中微量α-淀粉酶的检测。α-淀粉酶对α-CD诱导组装的抑制作用,进一步验证了前文对组装机理的推测。
4 结论
本文利用α-CD与GNRs表面CTAB分子的超分子主客体作用,成功诱导了GNRs在水溶液中的可控自组装。通过调节α-CD的浓度可以分别实现金纳米棒肩并肩组装或头对头组装。通过α-CD与β-CD的对比实验以及高浓度CTAB对组装过程的抑制作用,初步揭示α-CD与CTAB的超分子主客体作用是金纳米棒组装的主要诱因。提出α-CD与CTAB的主客体作用分两个阶段,即先与溶液中游离的CTAB相互作用,再与GNR表面CTAB相互作用。借助于α-淀粉酶对α-CD的水解作用,可以利用该组装体系实现对溶液中微量淀粉酶的检测。这种基于主客体作用的自组装策略有望拓展至其它由表面活性剂分子所稳定的胶体体系,从而为非球形纳米基元的可控自组装提供新的思路。
Supporting lnformation:available free of chargeviathe internet at http://www.whxb.pku.edu.cn.
- 物理化学学报的其它文章
- 基于两亲性喹喔啉的超分子凝胶:手性信号反转以及多重响应手性光学开关
- Solvent-Induced Inversion of Pickering Emulsions for In Situ Recycling of Enzyme Biocatalysts
- Structure-Property Relationship of Light-Responsive Wormlike Micelles Using Methoxycinnamate Derivatives as Light-Switchable Molecules
- Wormlike Micelle to Gel Transition Induced by Brij 30 in Ionic Liquid-Type Surfactant Aqueous Solution
- 含有酰胺基或酯基的可降解阳离子Gemini表面活性剂在水溶液中的聚集行为
- 基于多酯头基的“油-二氧化碳两亲分子”设计及其助混规律

