肽基超分子胶体
邢蕊蕊,邹千里,闫学海
中国科学院过程工程研究所,生化工程国家重点实验室,北京 100190

1 引言
超分子化学是基于分子间的非共价键相互作用(如氢键力、静电力、疏水作用、π-π作用以及范德华力等)而形成分子聚集体的前沿科学。在胶体化学的基础上,超分子化学的发展深化了人们对分子间的识别和组装的理解,推动了新物质及新功能的创造及发展1-7。传统的胶体如颗粒、囊泡、胶束、膜、介晶等,为兼具丁达尔效应、介稳性、电泳及聚沉效应等的系列胶状分散体系。它们广泛存在于自然界中,是多种复杂结构及功能的重要组成部分8,9。然而,传统胶体体系难以满足新型功能材料和仿生材料对分子多层级、多尺度有序排列的需求10-14。“超分子胶体”是基于分子之间弱相互作用的协同,自下而上自发形成的,具有有序的分子排布及规整结构,并兼具传统胶体及超分子特性的组装体系,其是胶体与界面化学和超分子化学学科发展有机结合的产物。
基于肽自组装的超分子胶体,因其特有的生物安全性、可降解性、可调的结构及功能等,在分子仿生、生物医学等领域具有重要的应用价值15-25。肽分子具有氨基酸规律排列且高度稳定的一级结构,在多重弱相互作用力的协同下,展现出了优异的多级组装能力,从而有潜力实现具有高级结构的功能胶体的构筑26-28。相对于传统的胶体,分子间弱相互作用力特有的动态性和方向性,赋予了肽基超分子胶体灵活可调的结构和功能29-35:1)通过对肽分子组装过程中热力学及动力学的有效调控,能够实现多级、多尺度的颗粒、囊泡、纤维束、凝胶等胶体结构的可控组装;2)肽基超分子胶体的可逆性、自愈性、环境响应性等物理化学特征,为实现胶体材料的智能化及功能化创造了灵活、有效手段。同时,肽分子具有高的安全性及特有的生物活性,拓展了肽基超分子胶体的应用范围。
结合肽分子结构明确、可编辑、高生物安全性及优异的超分子组装能力等优势,以肽作为构筑基元,通过对其分子的精准设计及分子间作用力的有效调控,构筑肽自组装的功能性超分子胶体,不仅丰富了胶体的制备途径,同时为超分子胶体的功能化应用提供了新的前景36-39。然而,肽基超分子胶体的研究也面临着重要的挑战:组装基元的精准设计及组装过程的有效调控为丰富的胶体结构的构筑奠定了基础,如何从分子设计出发,发展超分子自组装的方法学,实现具有特定结构的超分子胶体的构筑是目前所面临的挑战之一;深入探究胶体结构与功能的构效关系,实现超分子组装体的功能化是所面临的另一挑战。本综述将基于肽基超分子胶体研究领域所面临的关键性科学问题展开讨论,对肽基超分子胶体在能源光催化、疾病光诊疗领域的应用做重点论述。
2 超分子作用与肽基胶体结构
肽具有明确的生物来源及高的生物安全性,因此在生物医药等领域有着广阔的应用前景。作为蛋白质的简单组成基元,肽在一定程度上实现了对复杂蛋白质行为及功能的模拟,研究肽的超分子组装性质,为深入理解蛋白质的自组装行为开辟了新的途径40,41。在超分子组装的驱动下,肽分子能够被操纵形成多种结构明确、性能稳定的胶体体系。而肽自组装的超分子胶体的构筑通常涉及到两种或多种非共价作用的协同42。从分子层次出发,通过对肽序列的精准设计,调控肽分子-肽分子、肽分子-其它分子等间的相互作用,实现对胶体结构的精准调控,是一种行之有效的策略。
2.1 肽自组装
肽自组装的超分子胶体的构筑依靠于肽分子(如线性肽、两亲性肽、环肽、芳香肽、树突状肽等)间非共价键力的作用,这些弱相互作用力是驱动肽分子组装并维持胶体稳定的关键因素43,44。如,氢键作用强度适中,并具有方向性和一定程度的选择性,在稳定肽链的二级结构以及维持蛋白质三维构象方面发挥着关键性作用,氢键驱动自组装是一种被广泛应用于构筑稳定有序的超分子胶体的重要方法;静电组装技术常被应用于构筑基于带电肽的二元或多元颗粒、薄膜、三维凝胶等胶体体系;π-π堆积通常发生于基于芳香肽的胶体的定向组装;疏水作用自身存在着无方向性的特质,更容易驱动肽分子向胶束的组装;范德华力在两亲性肽的超分子组装过程中,发挥着关键性作用。肽自组装的超分子胶体的结构及功能的实现,主要依赖于超分子相互作用,而影响超分子作用的关键因素主要包括了组装环境的变化及组装基元自身的特征4,31,45。
苯丙氨酸二肽(FF)是一种最常用的超分子组装模块,Li及其团队对基于FF的系列超分子胶体体系,如纳米管、球形囊泡、纳米纤维、纳米线和有序分子链等作了详细综述6。在氢键作用及芳香族残基的π-π堆积作用下,FF可组装形成长程有序的纳米管结构18;在FF分子内引入巯基可改变肽的超分子自组装特性,如半胱氨酸二苯基丙氨酸三肽(CFF)能够自组装成球形囊泡结构46;FF在甲苯、氯仿等有机溶剂中,能够自组装形成三维水凝胶47;FF能够在二硫化碳(CS2)中自组装成单分散的刚性纳米线48。因此,通过对肽基元的分子结构、带电情况、亲疏水性质以及组装环境(温度、pH值、微量溶剂)等的精准调控,能够实现对肽自组装的超分子胶体的结构的有效调控。Lu及其团队在对基于两亲性肽的超分子胶体的综述中21,也提出了超分子作用对胶体结构的重要影响。比如,肽的序列和长度对组装结构产生了明显影响,肽分子I4K2可形成螺旋构象的纤维结构,而肽分子KI4K更倾向于生成纳米管结构49;AC-AmK-NH2(m=3, 6, 9)系列肽,随着疏水尾长m的延长,组装体结构的尺寸和形状发生明显变化,A3K倾向于形成不稳定的折叠堆积结构,A6K倾向于形成长的纳米管或纳米纤维结构,而A9K倾向于自组装成短的纳米棒结构(图1a),这种结构变化与分子堆积中的熵效应及静电斥力的改变有关50。

图1 (a) Ac-AmK-NH2 (m = 3, 6, 9) 肽的组装行为50;(b)焓ΔH及肽的组装形貌与含水量的关系31Fig.1 (a) Schematic illustrations of Ac-AmK-NH2 (m = 3, 6, 9) peptide self-assembly 50.(b) Dependence of ΔH and morphology of peptide assemblies on the content of water 31.
Yan等45在前期工作中阐明了微量溶剂在桥连氢键驱动下的肽基超分子胶体构筑中所发挥的关键作用。具有氢键形成能力的有机溶剂(如乙醇、N,N-二甲基甲酰胺和丙酮等),能够直接影响FF二肽分子中C―O与N―H之间的氢键相互作用。对比于FF在常规有机溶剂中表现出的强结晶倾向,定向的氢键作用,促进了FF的有序排列,使得FF更倾向于组装成为规整的纳米纤维或纳米带结构(图1b)。
除肽的序列及长度,以及组装环境对超分子组装行为的影响外,肽的固有属性在某种程度上决定了胶体的结构及性质。相对于线性肽,环肽具有高的分子刚性,因此它在生物体内表现出了低的降解率及高的生理稳定性51。环二肽(CDPs)是最小的环状肽,作为次级代谢产物,具有多种生物功能及药理活性。特别是,环二肽分子内含有两个氢键给体和两个氢键受体,在强的氢键力驱动下,环二肽表现出了高的超分子组装特性,能够组装形成三维的凝胶体系52。Yan等53选用了环-亮氨酸-苯丙氨酸(cyclo-(Leu-Phe),C-LF)作为组装基元,研究了其在纯水、缓冲液、培养基、酶裂解液中的组装行为,结果表明,C-LF能够在多种介质内组装形成三维凝胶并维持稳定,自组装的超分子凝胶表现出了灵活的流变学性质及极端环境下的高稳定性,这都归因于分子间强大的超分子氢键的作用(图2)。
2.2 肽调控协同自组装

图2 环肽C-LF组装形成纤维水凝胶。AAMD计算模拟指示出了分子内相互作用(白色、银色、蓝色和红色分别代表了氢、碳、氮和氧原子) 53Fig.2 Schematic illustration of C-LF self-assembling into fibrous hydrogels.AAMD simulations elucidating the intermolecular interactions in the hydrogels (white,silver, blue, and red spheres represent hydrogen,carbon, nitrogen, and oxygen atoms, respectively) 53.
除了上述通过对肽分子的设计及环境调控,实现其超分子胶体的可控组装之外,充分利用肽丰富的分子间作用位点,实现包含肽分子在内的二元或多元分子的协同组装,不仅为多种弱相互作用协同,构筑超分子胶体奠定坚实的理论基础,还能够进一步丰富肽自组装的超分子胶体的结构和功能54-56。
受到自然界中天然色素蛋白质的启发,Yan课题组提出了“肽调控光敏分子协同自组装”的方法,并深入研究了肽基超分子胶体自组装的物理化学机制4。简而言之,“肽调控协同自组装”就是基于对肽分子的设计,通过对其分子间超分子相互作用的协同性调控,实现对肽与光敏分子组装过程中热力学与动力学的调控,进而实现对超分子胶体的结构及功能的有效控制,它是一种简单、精准且有效的策略。
两亲性肽分子FF (微酸环境带正电荷,FF+)调控水溶性的卟啉分子H2TPPS (微酸环境带负电荷,[H2TPPS]2-)组装,倾向于形成多孔、多室的微球结构(图3a)。在这个组装过程中,H2TPPS先是以J-聚集的排布模式组装成纤维,在静电作用及疏水作用力的协同下,FF调控纤维束的定向排布和生长,最终形成高度有序的微球结构57;当用亲水性的肽分子KK替代两亲性肽分子FF之后,胶体的结构不再是微球,而是转变为长程有序的纤维束(图3b)。在这个过程中,H2TPPS先是通过分子间的ππ堆积形成J-聚集模式的纳米棒,由于长程静电斥力和短程范德华引力之间的平衡,最终自发堆积成为了有序的纤维束58。正是由于组装基元FF与KK的亲疏水性质的差异,使得其在调控同一光敏分子的组装时,表现出了不同的超分子作用力的协同,进而影响了胶体的分子排布模式及结构59。
3 超分子作用与肽基胶体性质
超分子作用对肽自组装的超分子胶体的构筑,及胶体的物理化学性质具有调控作用,特别是实现对其组装模式、能量转化、稳定性等的调控,进而实现了胶体功能的多样化。
3.1 组装模式的影响
芳香族肽是一类整合了芳香基团与疏水基团的组装基元,在多种分子间相互作用,特别是疏水作用、氢键作用、π-π堆积和范德华力等的驱动下,它们能够通过多尺度分层组装过程,自组装形成有序胶体结构。其中,N-芴甲氧羰基修饰的二苯基丙氨酸肽(Fmoc-FF)是一种典型的超分子胶体构筑基元,它能够组装成纤维状的三维水凝胶,在传感、细胞培养等领域得到了广泛应用60,61。Ulijn课题组61报道了此淀粉样衍生肽能够通过N-芴甲氧羰基与苯环基团之间的π-π内锁的β-折叠(π-πinterlocked β-sheets)结构,形成纳米柱(图4a),并进一步三维缠绕成为超分子水凝胶(图4b,c)。即,在氢键以及π-π堆积作用力的驱动下,Fmoc-FF倾向于形成具有反平行β-折叠二级结构的纤维水凝胶。

图3 (a) FF-H2TPPS微球组装机理示意图57;(b)单个微球横截面扫描电镜图像,显示多孔形貌57;(c) KK-H2TPPS纤维束组装机理示意图58;(d)纤维束的共聚焦显微镜照片,显示红光致发光58Fig.3 (a) Proposed mechanism for the self-assembly of FF-H2TPPS microspheres 57.(b) SEM image of a single microsphere cross-section showing porous structures 57.(c) Proposed mechanism for the formation of KK-H2TPPS fiber bundles 58.(d) Confocal image of fiber bundles showing red photoluminescence 58.
在上述基础上,Yan等62发展了一种Fmoc-FF组装过程中的二级结构由β-折叠向α-螺旋转变的电荷诱导策略(图4d)。通过对肽分子C末端所带电荷的调控,实现对分子末端静电作用的有效调控,进而实现了对其超分子组装模式的精准控制。通过对肽基元的超分子作用力的简单调控,实现组装体的二级结构由错误的β-折叠聚集向α-螺旋的转变,有助于了解阿尔兹海默症等神经性退行性疾病的发病机制,为理解超分子组织和生命活动中二级结构的形成和转变提供了新的视角63。同时,超分子作用的调控进一步拓宽了具有α-螺旋结构的肽基胶体的功能性及应用范围。
3.2 能量转化途径的影响
肽调控光敏分子自组装,能够实现多种胶体结构的有效构筑。同时,通过对其超分子作用力的精准调控,也能够实现肽基胶体对光能的吸收及能量的可控转化。对于光敏分子而言,光能的主要转化途径为“荧光”(活性氧)路径及“热”路径。而如何实现对上述两条能量转化路径的有效调控,无论是对于深入理解生命进化,或是发展高效的光功能胶体都具有重要意义。
Yan课题组64利用简单的阳离子二肽分子(HPhe-Phe-NH2·HCl,CDP)及改性的氨基酸(Fmoc-LLys)调控疏水性的光敏分子二氢卟吩e6 (Ce6)进行超分子协同组装,实现了π-π堆积、静电作用及疏水作用协同下的超分子胶体的构筑(图5a)。在多重超分子作用力的协同下,此胶体颗粒在血液循环过程中,能够维持分子聚集,实现荧光淬灭,并保持高度稳定性。在特定生理环境下(如肿瘤微环境:低pH值、酶等),超分子作用减弱达到动态平衡,响应性释放出光敏分子,进一步完成光能向荧光及活性氧物种的高效转化。在另外一个工作中,Yan等65通过共价耦合实现了肽/卟啉复合分子(TPP-G-FF)的合成,在π-π作用及疏水作用力的协同下,TPP-G-FF能够自组装形成分子排布紧密的光热纳米点(图5b)。其中,强的π-π堆积导致了分子荧光的完全淬灭,进而抑制了活性氧的生成,使得胶体纳米点展现出了高效的光热转换。同时,拥有负电荷表面的胶体纳米点,在静电斥力的作用下,实现了长期的胶体储存稳定性和血液循环稳定性。上述研究结果表明,超分子作用的合理设计可以有效控制肽基胶体的光能转化模式。

图4 (a)反平行β-折叠排列的Fmoc-FF肽的模型结构61;(b) Fmoc-FF自组装形成透明的凝胶61;(c)冷冻扫描显微镜显示凝胶的微观结构为扁平的纤维束61;(d)提出了以β-折叠和α-螺旋二级结构为主的纳米纤维自组装机理62Fig.4 (a) A model structure was created of Fmoc-FF peptides arranged in an anti-parallel β-sheet pattern 61.(b) Fmoc-FF forms a self-supporting transparent hydrogel 61.(c) The microscopic structure as observed by cryo-SEM presents flat bundles of fibers 61.(d) Proposed mechanism for the self-assembly of nanofibers dominated with β-sheet and α-helix secondary structures 62.

图5 (a)基于两亲性肽或氨基酸构筑光动力肿瘤治疗纳米颗粒64;(b)纳米颗粒在细胞层次的内在化,其中红色表示光敏剂64;(c)肽-卟啉的共轭物(TPP-G-FF)自组装构筑光热纳米点65;(d)随激光强度变化,纳米点在水溶液中的升温情况65Fig.5 (a) Fabrication of photodynamic nanoparticles by amphiphilic dipeptide- or amino-acid-tuned self-assembly 64.(b) Cell internalization of the assembled NPs in vitro, the red represents photosensitizer 64.(c) Self-assembly of a peptide-porphyrin conjugate (TPP-G-FF) into photothermal peptide-porphyrin nanodots 65.(d) Temperature elevation of nanodots in water in dependence of light intensity 65.
近期的工作中,Yan等66发现氧气在含酪氨酸的肽(Z-Tyr-OH,ZY;Z-Tyr-His-Tyr-Gly-OH,Z-YHYG)的进化过程中的重要作用:在富氧的环境下,它们倾向于组装成为具有光热转化效应的胶体;在乏氧的环境下,它们倾向于组装成为具有荧光效应的胶体。这种基于对环境因素的简单调控,实现了对能量转化途径的精准调控,进而实现具有特定功能的肽基胶体的定向组装。
3.3 稳定性的影响
通过引入强的疏水作用,增强超分子胶体在多种环境下,特别是在生理环境中的稳定性,已被证实是一种有效的策略。通过引入金属离子,实现多种弱相互作用与金属配位作用的协同,构筑新型的肽自组装的超分子胶体,在引入功能(如成像等)的同时,可显著增强胶体的稳定性67-69。
Yan等70报道了一种通过多组分配位自组装设计智能肽基超分子光动力金属纳米药物的策略。作者选用了两种具有金属配位能力的肽作为组装基元,包括两亲性氨基酸Fmoc-His (Fmoc-H)及两亲性二肽Z-His-Phe (Z-HF),用于与金属锌离子(Zn2+)的配位组装(图6a,b)。所构筑的金属纳米药物表现出了独特的优势:此胶体药物是通过金属配位作用和多种弱相互作用(疏水作用、静电作用等)的协同形成的,同时实现了血液循环的高稳定性和肿瘤微环境的“爆发式”药物释放(pH和氧化还原环境下,图6c)。在另外的工作中,两亲性氨基酸(Fmoc-L、Fmoc-H、Fmoc-P、Fmoc-Y)协同自组装金属离子(Mn2+),同时包裹光敏分子Ce6,实现了多组分的胶体平台的构筑。在疏水、π-π堆积以及金属配位作用的协同下,构筑的胶体材料展现出了高的稳定性,同时,金属离子Mn2+的引入,扩展了胶体药物在磁共振成像(MRI)方面的应用(图6d)71。

图6 (a) Zn2+存在下,肽与光敏剂协同作用构建金属纳米药物70;(b)金属纳米药物的透射电镜图片70;(c)金属纳米药物对pH和GSH变化的超灵敏反应70;(d) Mn2+存在下,肽与光敏剂协同组装构筑磁共振成像/光动力诊疗一体化平台71Fig.6 (a) Construction of metallo-nanodrugs through cooperative coordination of peptides and photosensitizers in the presence of zinc ions.(b) TEM images of the metallo-nanodrugs.(c) The ultrasensitive response of metallo-nanodrugs to pH and GSH changes 70.(d) Construction of integrated MRI/PDT platform through cooperative coordination of peptides and photosensitizers in the presence of manganese ions 71.
4 肽基超分子胶体的应用
肽自组装的超分子胶体因其制备简单、生物适用性强等优势已得到了广泛的应用。基于超分子化学的理念,非共价键特有的动态性及方向性,进一步推动了胶体材料的组装可调性及智能响应性。在此部分,我们将着重于介绍“分子间相互作用”调控下的肽基超分子胶体在仿生光合成及肿瘤光治疗领域的应用。如,以氨基酸、寡肽、卟啉等生物小分子作为胶体的构筑基元,通过超分子自组装的手段构筑系列仿生光合成胶体体系,用于模拟自然界光合系统的光能催化与转化过程,实现光能的吸收、利用及物质的转化生成(如氢气/氧气的产生、二氧化碳的还原等)。再者,通过超分子化学的策略,解决光敏药物/色素分子在光动力/光热抗肿瘤领域的应用限制(如,全身光毒性、利用率低、靶向性差等),实现光敏药物的智能响应、高效递送及增强的肿瘤光治疗。
4.1 仿生光合成
肽分子能够通过分级的超分子自组织构筑具有复杂结构的生物功能体系。自然界中的光合成系统能高效的将太阳能转化为化学能,受此启发,如何基于超分子物理化学机制,模拟光合成系统中蛋白质、色素等的组织排布,实现光能捕获、能量转化及催化反应等,成为构筑仿生体系并实现光化学合成的关键难点。Yan等72-77利用结构简单的氨基酸/肽及卟啉等生物分子,通过超分子自组装机制,构筑了系列光功能超分子胶体,用于模拟光合成体系,实现仿生的分子排布及光物理化学过程。这种基于生物分子作用力协同和调控的方法,为仿生体系的设计和创建带来了新的启示78。
光合成细菌是自然界中普遍存在、具有原始光能合成功能的生物体,受到绿色硫细菌的捕光单元-绿色体中菌绿素的J-聚集多级排布的启发,他们以简单的亲水性二肽分子(KK)和卟啉(TPPS)作为超分子组装基元,基于二元组分的协同自组装,通过调控分子间的氢键、静电作用等,实现了多尺度、长程有序的纤维束胶体的制备。其中,卟啉分子的J-聚集取向排布,模拟了菌绿素的组织结构,实现了吸收可见光和能量传递;原位矿化的二氧化钛/铂纳米颗粒,实现了电荷分离及电子存储。因此,在可见光照射下,肽组装形成的光功能纤维束能够有效的耦合光能捕获、电荷分离和光催化反应,实现持续、高效的氢气产生(图7)74。
蓝细菌是有着悠久历史的产氧生物,它依靠PS II蛋白质复合物实现了光能利用。Yan等75利用了简单分子模拟复杂的PS II体系,实现了对催化产氧反应的精准调控。两亲性氨基酸(Fmoc-L-Lys)基于氢键及π-π堆积自组装形成纤维模板,进一步与左旋多巴-醌发生席夫碱反应,形成生物黏附层。在配位作用及静电作用的共同驱动下,金属卟啉分子(SnTPyP)和Co3O4纳米颗粒组装至纤维表面的黏附层。其中,金属卟啉的有序排布模拟了细菌中的捕光单元,醌模拟了产氧光合成系统中活性中心,进而用简单胶体体系仿生了复杂的产氧光合成作用(图8)。

图7 (a)卟啉(TPPS)和二肽分子(KK)自进化成原始光合系统;(b)矿化有TiO2纳米颗粒的TPPS/KK纤维束的透射电子显微镜图;(c) TPPS/KK/Pt, TPPS/KK/TiO2和TPPS/KK/TiO2/Pt纤维束时间依赖的氢气生成74Fig.7 Self-evolution of porphyrin (TPPS) and dipeptide (KK) to a model of a primitive photosystem;(b) TEM image of TPPS/KK fiber bundles mineralized with TiO2 nanoparticles; (c) Time dependence of H2 evolution on TPPS/KK/Pt, TPPS/KK/TiO2, and TPPS/KK/TiO2/Pt fiber bundles 74.
热能和光能为原始地球中最为普遍的两种能量模式,一般情况下,“水热”体系启迪了多种生命活动。因此,基于前生物分子在火山热液体系的自进化,Yan等73选择了胱氨酸(L-Lys)和金属离子作为前生物分子模型,实现了对其自进化行为的仿生探索。结构表明,L-Lys和Zn2+在分子间的配位作用、氢键作用的协同下,能够实现具有分级组织的微球的形成。此胶体微球能够同时捕获紫外光和可见光,催化原始的光合成反应,包括氢气的产生、NAD+向NADH的转化、二氧化碳的还原等。
综上,肽具有灵活可调的分子结构,以及多样的组装模态。以肽自组装的超分子胶体作为光合成的仿生体系具有如下优势:1)以简单的生物分子为组装基元,并结合了超分子组装的自发性及可控性,实现了复杂的光功能体系的构筑;2)组装基元间弱相互作用的调控,实现了对胶体多尺度、多结构的组装调控;3)基于超分子策略,实现多组分整合,增强了构筑基元的功能性。
4.2 肿瘤光治疗
基于小分子肽自组装的超分子胶体具有结构多样性及功能可调性等优势,这些光功能胶体包括了胶体颗粒、纤维、凝胶等。肽基胶体被广泛应用于组织工程、药物载体、生物模板、肿瘤治疗等生物学领域。如,Zhang等79基于离子互补肽构筑了系列水凝胶体系,并研究了细胞在凝胶体系中的增殖、分裂和迁移;Stupp等80设计了一种两亲性肽(KLAKLAK)2,经组装可形成圆柱状纳米纤维,与单纯的分子对比,表现出了高的细胞摄取。
目前,一些恶性肿瘤如胰腺癌、肺癌等五年存活率不高于20%,这主要是由于现有肿瘤治疗手段与难治性肿瘤自身特质的不匹配,无法解决肿瘤治疗药物的低靶向性、治疗过程的全身性毒副作用及治疗后的高复发率等难题81。光治疗是一种非侵袭性的、高靶向性的新型肿瘤治疗策略,主要依靠光功能胶体在肿瘤部位富集,在光的激发下实现光能向活性氧物种或热的定向转化,进而实现肿瘤光动力或光热消融的效果82。通过调控肽分子间相互作用力,可实现光能的定向转化。光功能胶体在光动力肿瘤治疗(PDT)及光热肿瘤治疗(PTT)领域,得到了广泛的研究38,83-88。
4.2.1 光动力肿瘤治疗

图8 (a)粘附性的两亲性氨基酸自组装模板构建产氧光合成细菌模型;(b) Fmoc-L-Lys/DOPA/Co3O4纳米纤维的透射电子显微镜图;(c)纳米纤维的紫外可见吸收光谱;(d)光催化产氧75Fig.8 (a) Illustration of adhering amphiphilic amino acids-templated self-assembly of a model of oxygen-evolving photosynthetic bacteria; (b) TEM image of Fmoc-L-Lys/DOPA/Co3O4 nanofibers;(c) UV-Vis absorption spectra of the nanofibers; (d) Photocatalytic oxygen evolution 75.
光动力治疗过程主要涉及到光敏药物及多级的光化学反应。在光的辐照下,光敏分子能够与氧气反应,产生有毒的活性氧物种。活性氧物种能够直接与体内的蛋白质、DNA等物质结合,达到破坏肿瘤细胞的目的89,90。用于光动力的肽自组装的超分子胶体主要在以下两个方面发挥作用:维持光敏分子在血液循环中的稳定性及聚集淬灭状态,降低全身的光敏反应,实现对光敏药物的有效递送及肿瘤富集;对肿瘤微环境作出灵敏响应,释放出光敏药物,实现特定波长激光激发下的活性氧产生,进而实现对肿瘤的消融91。
肽自组装的超分子胶体的发展在一定程度上解决了传统的光敏剂递送体系普遍存在的载药量低、组分不明确等弊端,有效的实现了一种或多种光动力药物的装载及运输。Yan等人92使用交联剂戊二醛(GA)与CDP的自组装,开发了一种尺寸及结构均可调控的可注射型纳米载体,用于实现对光敏药物Ce6的装载及肿瘤递送(图9a-c)。基于Fmoc-FF及多聚赖氨酸(PLL/PLL-SH)之间的静电作用的调控,及对Ce6的封装,他们构筑了一种具有剪切变稀、自愈特性的可注射型光动力抗肿瘤水凝胶体系(图9d-f)。此超分子胶体体系表现出了高的生物相容性、生物可降解性,以及对光动力药物的局部交付和持续递送。更是基于“一次注射、多次治疗”的策略,实现了高效的肿瘤光动力治疗93。
他们提出的“肽调控光敏剂自组装”构建超分子胶体的策略,对多种疏水性、亲水性光敏药物均适用。另一个工作中64,CDP和两亲性氨基酸(Fmoc-L-Lys)调控光动力药物Ce6的超分子组装,构建了尺寸均一、单分散的纳米胶体颗粒(CCNPs和FCNPs,图10a,b)。胶体表面呈现了较高的表面电势(约-20 mV),在颗粒间静电排斥作用下,能够维持高稳定性。在此胶体体系中,静电、疏水和π-π堆叠等多重的弱分子间作用力协同,实现了纳米尺度胶体粒子的组装及血液循环中的稳定性。其载光敏药物量高(约80%)、尺寸可调,并适用于原卟啉IX(PPIX)、维替泊芬、TPPS、磺酸基镍酞菁(NiPcS)等多种亲疏水性光敏药物。同时,由于弱相互作用的动态性,在肿瘤微环境刺激下(如酸性pH值、水解酶、疏水环境等)可控实现了胶体颗粒对光敏药物的响应性释放。上述这些特点,不仅提高了光敏药物的生物利用度,减缓全身分布引发的光毒性(图10c),在肿瘤的靶向运输及增强的光动力抗肿瘤治疗中也取得了良好的效果(图10d)。
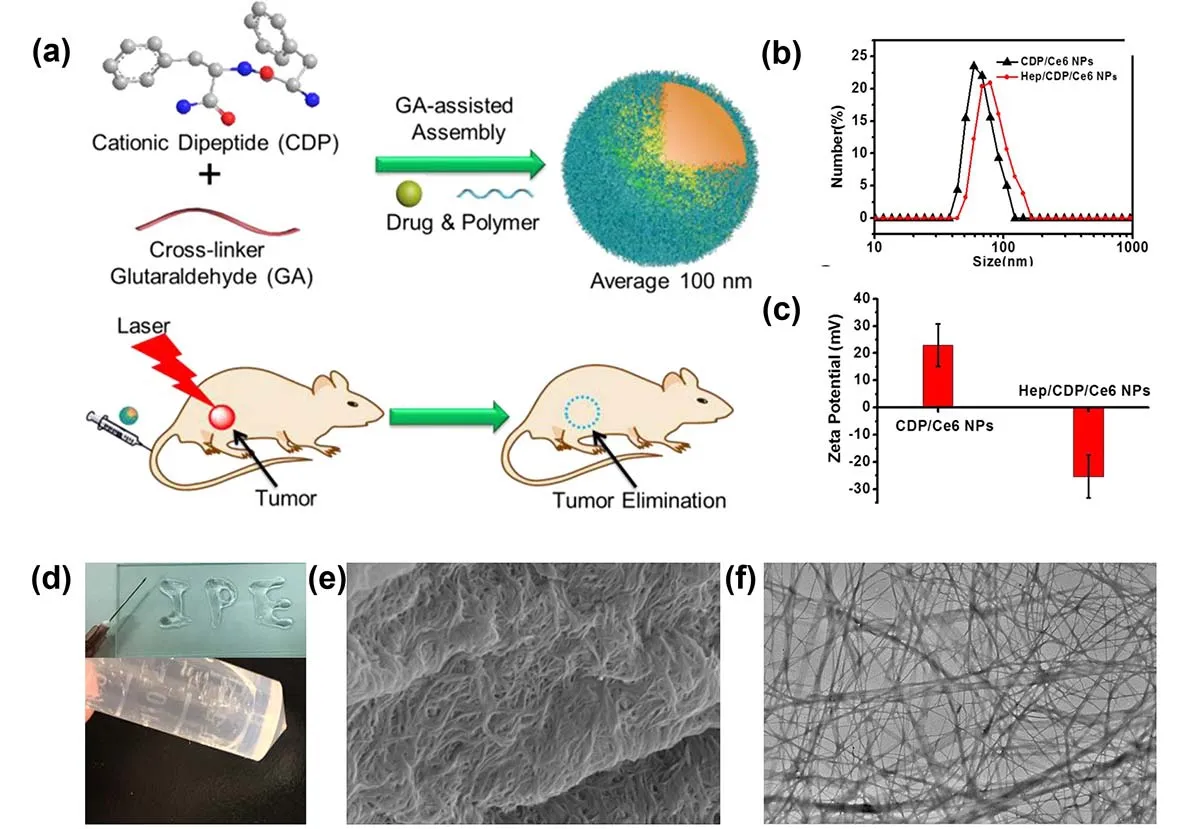
图9 (a)基于CDP的可注射型纳米载体用于递送及肿瘤高效PDT治疗92;纳米载体的(b)平均粒径及(c)电位92;(d) Fmoc-FF/PLL凝胶能够无阻碍的通过260 μm的注射器93;Fmoc-FF/PLL-SH凝胶的(e)扫描电子显微镜及(f)透射电子显微镜图片93Fig.9 (a) Injectable self-assembled CDP-based nanocarriers for tumor delivery and effective in vivo PDT 92.(b) Average hydrodynamic diameter and (c) zeta potential of various nanocarriers 92.(d) The Fmoc-FF/PLL hydrogel can pass through a 26-gauge (260 μm) needle without clogging 93.(e) SEM and (f) TEM images of Fmoc-FF/PLL-SH hydrogels 93.

图10 (a) CDP和Ce6自组装形成纳米颗粒(CCNPs)的扫描电子显微镜图、透射电子显微镜图及粒径分布;(b) Fmoc-L-Lys和Ce6自组装形成纳米颗粒(FCNPs)的扫描电子显微镜图、透射电子显微镜图及粒径分布;(c) MCF-7荷瘤小鼠静脉注射FCNPs和游离Ce6后的全身荧光分布;(d)小鼠经不同处理后不同时间点的典型图片64Fig.10 SEM image, TEM image and size distribution of assembled CCNPs using CDP and Ce6 as building blocks (a) and FCNPs using Fmoc-L-Lys and Ce6 as building blocks (b); (c) Whole body fluorescence images of MCF-7-tumor-bearing nude mice intravenously injected through a tail vein with FCNPs and free Ce6; (d) Representative photos of mice after various treatments at different time point 64.
除多重的弱相互作用下的超分子组装构筑光动力药物之外,他们进一步实现了金属配位作用协同下的胶体药物的构筑。如,他们选用两亲性氨基酸(Fmoc-L-L)调控MRI造影剂Mn2+及Ce6的共组装,实现了功能性光动力胶体药物的制备,并研究了其在MRI、荧光成像指导下的肿瘤诊疗的应用。此胶体颗粒表现出了智能的谷胱甘肽(GSH)响应,在肿瘤微环境中,Mn2+与GSH竞争协同,实现了光敏药物的迅速释放71。再者,他们基于多组分配位自组装设计了智能肽基超分子光动力金属纳米药物。具有配位氨基酸(His,H)的肽(Fmoc-H,Z-HF)、Zn2+、Ce6之间的超分子作用包括金属离子配位、疏水、静电等的协同,保证了其尺寸的均一性、结构的完整性及胶体的稳定性,有效地延长了光敏药物的血液循环时间并增强了光敏剂的肿瘤富集效果。特别是,此胶体药物在pH和氧化还原作用的刺激下,实现了光敏药物突释,明显改善了光动力治疗的效果70。
4.2.2 光热肿瘤治疗
基于光敏药物的光动力的治疗最终依赖于胶体对光敏药物的释放。而与之相对应的光热治疗,更需要于光敏药物的分子聚集引发的荧光淬灭。“肽调控协同自组装”策略不仅对超分子胶体的形貌和结构具备调控性,还对组装体的能量转换模式具备调控作用。

图11 PPP-NDs纳米点的(a)粒径分布及 (b)透射电子显微镜图;(c)伴随激光照射时间的延长,小鼠肿瘤位置的升温情况;(d)静脉注射PPP-NDs后,小鼠随时间的光声成像情况;(e)各组的小鼠肿瘤体积变化曲线65Fig.11 (a) DLS size distribution and (b) TEM image of PPP-NDs; (c) Mean temperature of the tumor sites as a function of irradiation time; (d) PA images of mice at various time points after intravenous injection of PPP-NDs;(e) Tumor volume of the mice in different groups 65.
Yan等人65基于TPP-G-FF的超分子自组装,构筑了超分子光热纳米点(图11a,b)。在其中,光敏卟啉分子处于高度聚集淬灭状态,因此,光能转化为荧光或活性氧物种的途径几乎完全被阻断,使得高效的光能-热能的转化变为可能。上述超分子纳米点在生理条件下、血液循环中及肿瘤位置均表现出了高的稳定性,并在被动靶向作用下实现了在病灶位置的富集。在激光的激发下,能够实现肿瘤原位升温(图11c),在实现光声肿瘤成像的同时(图11d),发挥对肿瘤的高效杀伤作用(图11e)。上述光热纳米点的光热转化效率达到54.2%,可以媲美于现发展的多种光热材料94,95,如硒化铜纳米晶(22%)、金纳米壳(13%)、纳米棒(21%)、黑磷量子点(28.4%)。这种将肽分子与光敏分子通过共价结合为复合分子,再通过分子间的超分子作用协同,构筑光热胶体粒子的策略,为超分子药物的设计提供了新的视角。
光热治疗所表现出的高选择性、无创性、低毒性、低耐药性等优点,促使其逐渐发展为一种有效的肿瘤治疗手段,而系列光热制剂的更迭,在推进临床应用的同时,也逐渐暴露出缺点96,97。吸光的聚合物、无机材料等的代谢机制不明导致的安全问题,常用光敏药物的近红外吸收缺乏问题等,均无法满足临床对肿瘤治疗药物的要求。兼具生物安全性、高近红外光热转化效率的新型光热制剂亟待开发。Yan等人98选用了具有金属配位能力的生物小分子肽、内源性且具有近红外吸收的色素胆绿素及Mn2+作为组装基元,构筑了光热纳米药物(图12a)。其中,胆绿素是血红蛋白的次级代谢产物,在人体内能够通过肝胆循环排出体外,具有明确的代谢机制;同时,胆绿素在近红外区具有明显的光吸收(图12b),但自身无荧光,因此更有潜力将近红外光能转化为热能。金属离子不仅与肽基元存在配位组装,与胆绿素也表现出了配位组装;肽基元与色素分子之间存在着多重的弱相互作用力,包括疏水作用、π-π堆叠、与水分子之间的氢键作用。正是因为三组分之间多重的超分子作用的协同,进一步增强了胶体药物内的分子紧密排布,从而实现了性质稳定(图12c)、光热转化效率高的胶体药物的构筑(图12d)。此胶体药物的组分均具有高的生物安全性,其在小鼠体内的半衰期约为22 h,72 h后重要器官(心、肝、脾、肺、肾)的代谢率约达到100% (图12e)。在整个光热治疗周期内,小鼠生存状态未受影响、重要器官未出现损伤。在MRI、光声成像的指导下(图12f),实现了对肿瘤的高效杀伤,并有效的抑制了肿瘤的复发(图12g,h)。基于此,Yan等99提出了“超分子光热效应”,即光敏剂超分子组装所产生的光热转换“集群效应”。他们认为,基于多种分子自组装策略在纳米尺度形成的超分子光热材料,与单分子的光敏剂相比,表现出了更高的胶体稳定性和光稳定性。同时,通过对其荧光的淬灭,提高了光热转化效率,并实现了增强的光热治疗效果。对“超分子光热效应”机制的发现,有助于促进新型光热材料和药物的发展。

图12 (a) ZBMn纳米颗粒的扫描电子显微镜图;(b) BV单分子、ZB纳米颗粒(pH = 6.82)、ZBMn纳米颗粒(pH = 7.04)的紫外吸收图谱;(c) ZBMn纳米颗粒在水及生理培养基内,37 °C孵育48 h后的粒径变化曲线;(d)激光照射下ZBMn纳米颗粒的升降温循环曲线;(e) ZBMn纳米颗粒的体内分布曲线;(f)以ZBMn纳米颗粒作为造影剂,荷瘤小鼠的光声成像(上)及磁共振成像(下)结果;(g)观察期间内的小鼠肿瘤体积变化曲线;(h)观察期间内的肿瘤图片98Fig.12 (a) SEM images of the ZBMn NPs; (b) UV-Vis absorption spectra of BV monomer, ZB NPs (pH = 6.82), and ZBMn NPs (pH = 7.04); (c) DLS size profiles of the ZBMn NPs in water and in physiological culture medium incubated at 37 °C for 48 h; (d) Continuous irradiation-cooling profiles of the ZBMn NPs under laser irradiation; (e) In vivo biodistribution of the ZBMn NPs; (f) PAI (up) and MRI (below) of tumor-bearing mice using the ZBMn NPs as contrast agents; (g) Tumor volume of the mice monitored during the observation period; (h) Images of the tumors during the observation period 98.
5 结论与展望
肽自组装的超分子胶体结合了超分子化学自组织、自修复、结构及功能可调控等优势,并整合了肽基胶体优异的生物安全性、可降解性等优点,因而在能源催化、生物医药等领域展现出了广阔的应用前景。本文综述了如何设计肽基元构筑超分子胶体,从分子层次分析了超分子组装的物理化学机制,总结了弱相互作用对胶体结构及功能的调控行为,并重点归纳了基于肽自组装的多种超分子胶体体系在仿生光合成(如光能捕获、电荷分离等)及肿瘤光治疗(光热治疗、光动力治疗等)方面的应用。目前肽基超分子胶体的研究已取得了一系列进展,然而基于胶体体系的超分子作用,实现对其智能响应性的调控的研究尚待加强,其在细胞层次及动物层次的应用研究仍需深化。
在肽基超分子胶体的后续研究中,不仅要着重于对分子基元的设计,实现对胶体结构及功能的精准调控;更要关注于基础理论与实际应用的结合,着重于解决超分子胶体应用过程中的关键性问题。如,实现一些具有特殊结构(片层、异面体、多层膜等)的功能胶体体系的构筑,研究其多维尺度上的分子堆积及聚集模式,从分子层次揭示结构与能量的层级递送的内在关系,发展系列新型光功能材料,用于仿生复杂的酶联反应、光化学作用、生命活动等;结合多种分子动力学模拟手段,从超分子化学的角度深入探究超分子胶体在生物媒介中的分子识别、递送、内在化及动态降解过程,改善胶体体系的靶向性、穿透性及响应性;合理利用肽基超分子胶体的动态性及方向性,研究其结构和功能在活体层次中的适应性,探究其在肿瘤免疫逃逸中的关键作用,启发肿瘤治疗新思路。同时,在后续的研究中,还应拓展肽基超分子胶体的应用范围,如基于活性肽构筑系列抗菌材料、抗肿瘤药物,开发植入型肽基器件(止血材料、纳微机器人)等。总之,肽基超分子胶体的有序性(多层级、多尺度)、灵活性(结构可控、性能可调)及动态性(稳定性、响应性)等优势,将为超分子胶体在绿色能源、医药健康等多个应用领域拓展全新的空间。

