广叶绣球菌液体菌种培养条件优化
马 璐 杨 驰 肖冬来 应正河 江晓凌 刘晓瑜 林衍铨
广叶绣球菌液体菌种培养条件优化
马 璐 杨 驰 肖冬来 应正河 江晓凌 刘晓瑜 林衍铨*
(福建省农业科学院食用菌研究所,特色食用菌繁育与栽培国家地方联合工程研究中心,福州 350014)
为获得菌球密度高、直径小和活力强的广叶绣球菌液体菌种,经优化试验,得到适宜培养条件为培养基初始pH 5.0,装液量140~170 mL,接种量9%,摇床转速120~150 r/min;并确定液体菌种的适宜培养终点为9~10天,此时菌球直径1.07±0.03 mm,菌球密度111±11.53 个/mL,接种后菌丝生长速度2.34±0.18 mm/d。
液体培养;培养条件;培养终点;菌丝活力
广叶绣球菌()又名绣球菌,是一种“药食同源”的大型真菌,营养丰富且富含活性多糖(β-葡聚糖)[1]。现代医学研究证实,绣球菌具有抗肿瘤[2]、免疫调节[3]、促进伤口愈合[4]及提高造血功能[5]等多种保健功效。
目前,绣球菌工厂化栽培均采用瓶装木屑菌种,原种培养时间50~55天。液体菌种菌龄一致、制备周期短,便于机械化接种,更适合食用菌工厂化生产。目前绣球菌液体培养研究多以提高次生代谢产物[6, 7]或菌丝生物量[8-10]为主,菌丝生物量最大时的菌球活力情况却少有关注。
绣球菌液体培养初期,菌球表面有呈绒毛状的毛刺,此时菌丝活力最强,但生物量较小;随着培养时间延长,菌球表面逐渐光滑,菌丝生物量增大,但菌丝活力下降。因此,菌丝生物量在一定程度上不应作为判断液体菌种优劣的首要指标。理想的液体菌种应在保证一定菌丝生物量前提下,减小菌球直径、增大菌球密度、提高菌球活力。
前期研究已获得绣球菌液体培养的适宜培养基配方[11],但获得的菌球直径较大而密度较小。本实验在此基础上,优化液体菌种培养条件,匀浆处理后进行扩繁,并确定液体菌种培养终点,为绣球菌工厂化栽培中液体菌种制备提供参考。
1 材料与方法
1.1 供试菌株
广叶绣球菌()(闽认菌2013005)菌种由福建省农业科学院食用菌研究所提供。
1.2 培养基
①母种培养基(PDA):马铃薯200 g/L,葡萄糖20 g/L,琼脂粉16 g/L。②PDPK液体培养基:马铃薯200 g/L,葡萄糖20 g/L,鱼粉蛋白胨3 g/L,KH2PO43 g/L。③液体菌种培养基:葡萄糖40 g/L,玉米粉30 g/L,鱼粉蛋白胨3 g/L。④液体菌种培养基:葡萄糖20 g/L,面粉4 g/L,鱼粉蛋白胨3 g/L。
1.3 实验方法
(1)菌种活化及培养。母种接种于PDA培养皿中24~25 ℃避光倒置培养25天后,从活化菌落边缘挑取菌块(=6 mm)接种至PDPK液体培养基中(250 mL三角瓶,装液量100 mL),24~25 ℃、150 r/min避光培养10天,得活化菌种。
(2)液体菌种培养采用250 mL三角瓶,装液量100 mL,对液体菌种培养条件,包括培养基初始pH、温度、转速、接种量,进行单因素试验,避光培养20天后测定菌球密度、菌丝体生物量。具体实验水平如下。
培养基初始pH:4.0、4.5、5.0、5.5、6.0(灭菌后用1 mol/L HCl或1 mol/L NaOH调节),接种量8%(/),培养温度24~25 ℃,转速150 r/min。
接种量(/):3%、6%、9%、12%、15%,初始pH自然,培养温度24~25 ℃,转速150 r/min。
培养温度:22、23、24、25、26 ℃,初始pH自然,接种量8%(/),转速150 r/min。
设置摇床转速:120、150、180、210 r/min,初始pH自然,接种量8%(/),培养温度24~25 ℃。
(3)液体菌种制备。根据上述实验结果,对绣球菌液体菌种进行培养(250 mL三角瓶,装液量100 mL),培养结束后用匀浆机打碎(5 000 r/min,10 s),以接种量8%(/)接种至液体菌种培养基,转速180 r/min,24~25 ℃培养。接种4天后,每隔2天测定培养液pH、菌球直径、菌球密度、菌球体积、菌丝体生物量、培养液还原糖含量和菌丝生长速度,分析菌种活力,确定培养终点。
1.4 测定指标
(1)培养液pH。培养结束后,采用pH计(奥豪斯,ST3100)测定培养液pH。
(2)菌球直径与菌球密度。采用移液枪,随机吸取一定体积培养液,将培养液中菌球排列成直线,测总长度,取平均值,得菌球直径(mm/个);对培养液中的菌球计数,得菌球密度(个/mL)。
(3)菌球体积及菌丝体生物量。用清水充分冲洗经纱布过滤的菌球,倒入量筒静置3 min后,测定菌球体积,随后将菌球于50 ℃烘干至恒重,电子天平称重。
(4)培养液还原糖含量。培养液经8 000 r/min离心10 min后,采用3,5-二硝基水杨酸法测定培养液还原糖含量。
(5)菌丝生长速度与菌落白度。将采用绣球菌工厂化栽培配方[12]的培养料装入培养皿中,每培养皿15 g,高压灭菌,冷却后备用。从液体菌种内
随机挑取不同培养时间的菌球,接种至培养皿中,24~25 ℃恒温避光培养,待菌丝长满培养皿时,测定菌落直径,计算菌丝生长速度(mm/d)。同时采用色差仪(Konica Minolta CR410)测定菌落颜色,以白色色卡(X=84.99,Y=87.00,Z=96.70)为对照,测定结果(ΔE*ab)越小,说明菌落颜色与白色色卡相差越小,菌落越白。
2 结果与分析
2.1 液体菌种培养条件优化
(1)初始pH。培养结束时,培养基pH降低至3.37~3.88。当初始pH为5.5时,菌球密度最大,为55.5±5.0个/mL,但与其他处理无显著性差异。当培养基初始pH为5.0时,菌丝体生物量最大,为8.5±0.78 g/L,差异显著(图1)。

图1 培养基初始pH对绣球菌液体培养效果的影响
(2)装液量。装液量80 mL时,菌球密度最大,为91.5±5.0 个/mL,但此时的菌丝体生物量最低,仅为6.5±0.4 g/L;继续增加装液量,菌球密度显著降低,菌丝体生物量与菌球直径均显著增大。装液量为170 mL时,菌丝体生物量最大,为9.5±0.6 g/L(图2)。综合考虑菌球直径、菌球密度及菌丝体生物量,适宜的装液量应为140~170 mL。
(3)接种量。随着接种量增大,菌球密度先升高、后降低,差异不显著。接种量在3%~9%之间,菌丝体生物量显著提高,9%时达最高,为4.2±0.4 g/L;继续增大接种量,菌丝体生物量基本维持不变,无显著性差异(图3)。

图2 装液量对绣球菌液体培养效果的影响
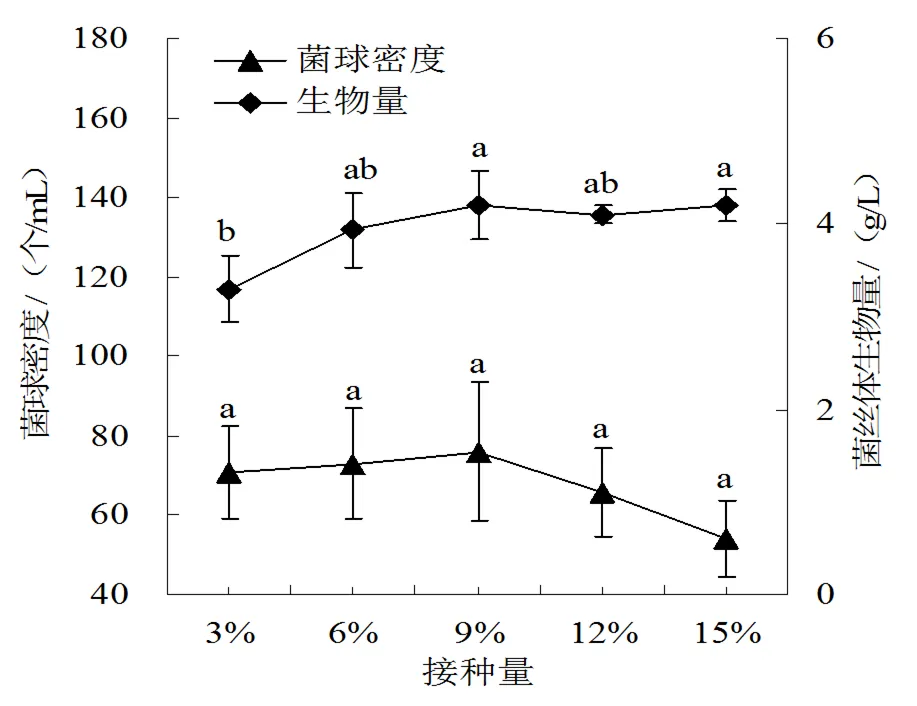
图3 接种量对绣球菌液体培养效果的影响
(4)摇床转速。在摇床转速120~210 r/min范围内,随转速增大,菌球密度逐渐升高,菌丝体生物量逐渐降低,差异不显著(图4)。

图4 摇床转速对液体培养效果的影响
经综合分析,得出液体菌种适宜培养条件为:培养基初始pH 5.0,装液量140~170 mL,接种量9%,转速120~150 r/min。
2.2 液体菌种培养终点的确定
(1)培养基pH及菌球直径。随培养时间延长,培养基pH呈下降趋势。培养前期(0~6天),pH基本保持稳定,随后迅速下降至3.88,此后降幅放缓,说明从第6天开始,菌丝已逐渐适应新的培养基,酸性代谢物质开始逐渐积累。接种第0~8天,匀浆后的菌丝逐渐恢复生长,个别生长较快的菌丝已成小菌球;从第8天至培养结束,菌球直径基本维持在1.1 mm左右(图5)。

图5 不同培养时间的培养基pH及菌球直径
(2)不同培养时间的菌球密度及菌球体积。菌球密度可在一定程度上反映接种后菌丝萌发点。从第8天开始,菌球密度逐渐增大,至第16天达到最大,随后基本维持稳定(图6)。
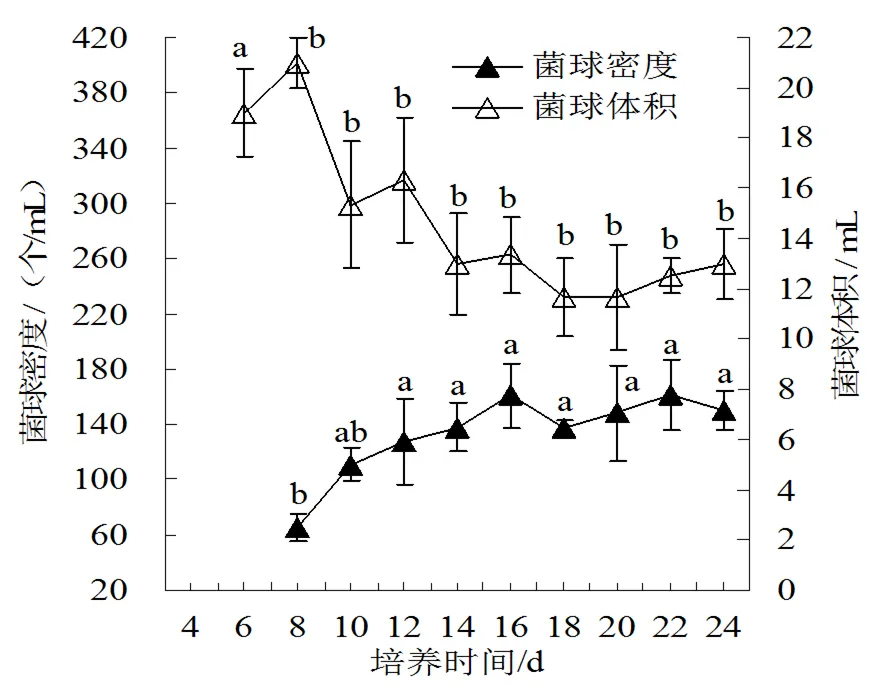
图6 不同培养时间的菌球密度及体积
菌球体积在培养过程中整体呈下降趋势,其中第6~14天下降明显,之后基本保持稳定。培养初期,由于菌球表面蓬松呈绒毛状,单位时间内沉降速度慢,因此在培养基中所占体积较大,随着培养时间延长,菌球表面绒毛逐渐消失,体积减小。采用体视显微镜对不同培养时间的菌球进行观察,结果也证实了这一点(图7)。

图7 液体菌种培养过程中菌球形态变化
(3)菌丝体生物量及培养基还原糖含量。在绣球菌液体菌种培养过程中,菌丝体生物量呈上升趋势(图8):第0~8天,变化不明显;8~16天期间,迅速增加,差异显著(<0.05);16天以后,增长趋势减缓;第20天时达到最大(3.9±0.26 g/L)。
绣球菌液体菌种培养初期,菌球处于迟滞期,还原糖含量下降不明显,从第10天开始,逐渐降低;随菌球生长加快,16天后显著下降(<0.05)(图8)。

图8 不同菌龄的菌丝体生物量及培养液还原糖含量
(4)菌丝生长速度及菌落白度。绣球菌液体菌种培养至第8天接种,菌丝生长速度最快;随后
逐渐减慢,但无显著性差异(>0.05);12天之后接种,生长速度显著下降(<0.05)(图9)。
菌落白度以液体菌种培养6~12天接种的较高,结合菌丝生长速度,说明该菌龄菌种菌球活力强(图9,图10)。菌龄12天以上的,随培养时间延长,菌球活力下降,接种后的菌落白度显著降低。
3 结论与问题讨论
液体菌种具有生产成本低、培养周期短、品质好等优点,是食用菌产业发展的必然趋势[13]。前期研究结果[11]表明:采用常规液体培养方法,培养第6天时菌球直径最小(1.20 mm),但此时菌球密度较低(9.56 个/mL);随培养时间延长,菌球密度最高也仅52.3个/mL,作为菌种使用,接种后菌丝萌发点仍然偏少。对菌种进行匀浆可有效增加菌球密度,且接种后菌丝生长速度快、产量高且稳定,这在金针菇、杏鲍菇、真姬菇中已有报道[14, 15]。为使匀浆前获得较高的菌丝生物量,本试验对绣球菌液体菌种培养条件予以优化。

图9 不同菌龄液体菌种接种后菌丝生长速度及菌落白度

图10 不同菌龄液体菌种接种后的菌丝生长情况
刁文涛等研究认为,绣球菌液体菌种发酵培养基最佳pH为3.5[16],杨丽莉[17]与陈博文等[10]则认为最适pH在4~5。本试验结果与以上结果类似:当液体培养基初始pH为5.5时,菌球密度最高,但pH为4.0时菌丝体生物量最大(5.45±0.07 g/L)。
以250 mL三角瓶进行液体培养,刘成荣等[18]认为适宜的装液量为150 mL,杨丽莉[17]则认为装液量为110 mL时,菌丝生物量最大(5 g/L)。本试验得出的适宜装液量为170 mL,与已有研究结果有较大差异。原因可能是培养基配方不同使培养基渗透压存在差异,进而影响培养基溶解氧含量和菌丝生长速度。
摇床转速主要影响培养基剪切力和溶解氧含量,高转速有利于菌球增多。本试验结果验证了这一点,当摇床转速为210 r/min时,菌球密度可达78.0±8.5个/mL。已有研究结果显示,摇床转速在110~200 r/min之间时,菌丝生物量呈现先增加后降低的变化趋势[17, 18]。但本试验在120~210 r/min范围内,菌丝生物量随转速增大呈降低趋势。
绣球菌适宜在偏酸性条件下生长,液体培养条件与金针菇[19, 20]、杏鲍菇[21]、真姬菇[22, 23]、灵芝[24],江西虫草[25]等类似。绣球菌液体菌种培养6天后,培养液pH显著下降,至第10天降至3.89,此后下降趋势变缓。说明第6~10天,菌丝生长旺盛,酸性代谢物开始积累,这从菌球直径和菌球密度的变化上也能看出。
食用菌菌丝生物量可在一定程度上作为培养终点的判断指标,如真姬菇[23]、金针菇[26]、杏鲍菇[27]、草菇[28]等液体菌种培养。本试验结果显示,绣球菌液体菌种培养当菌丝体生物量达到最大时,菌丝的生长速度和菌落白度却显著(<0.05)降低,说明此时菌球活力已经下降。因此,要获得活力强的液体菌种,就须将培养终点提前。
综合考虑菌丝体生物量与菌球活力,宜选择接种后9~10天作为液体菌种培养终点,此时菌球直径1.07±0.03 mm/个,菌球密度111±11.53 个/mL,接种后菌丝生长速度2.34±0.18 mm/d。
本研究结果获得的绣球菌液体菌种菌球密度大、直径小、活力强,可为液体菌种应用于绣球菌工厂化栽培提供重要参考,并可为绣球菌液体菌种的质量控制提供借鉴。
[1] 廉添添, 杨涛, 孙军德, 等. 人工栽培绣球菌的鉴定及其子实体β-葡聚糖含量的酶法测定[J]. 菌物学报, 2014, 33(2): 254-261.
[2] Ohno N, Miura NN, Nakajima M, et al. Antitumor 1,3--Glucan from Cultured Fruit Body of[J]. Biological & Pharmaceutical Bulletin, 2000, 23(7): 866-872.
[3] Harada T, Miura NN, Adachi Y, et al. Ifn-Γ Induction by Scg, 1,3--D-Glucan from, in Dba/2 Mice[J]. Journal of Interferon & Cytokine Research, 2002, 22(12): 1227-1239.
[4] Kwon M.D. A-H, Qiu M.D. Z, Hashimoto M, et al. Effects of Medicinal Mushroom () on Wound Healing in Streptozotocin-Induced Diabetic Rats[J]. The American Journal of Surgery, 2009, 197(4): 503-509.
[5] Harada T, Miura N, Adachi Y, et al. Effect of Scg, 1,3--D-Glucan fromon the Hematopoietic Response in Cyclophosphamide Induced Leukopenic Mice[J]. Biological & Pharmaceutical Bulletin, 2002, 25(7): 931-939.
[6] 游雄, 钱秀萍, 吴丽燕, 等. 绣球菌的诱变育种和深层发酵工艺的初步研究[J]. 中国食用菌, 2006, 25(3): 41-45.
[7] Kurosumi A, Kobayasi F, Mtui G, et al. Development of Optimal Culture Method ofMycelia and a New Extraction Method of Antineoplastic Constituent[J]. Biochemical Engineering Journal, 2006, 30(1): 109-113.
[8] 刘成荣, 冯旭平. 绣球菌深层发酵工艺条件的研究[J]. 莆田学院学报, 2008, 15(5): 50-53.
[9] 贾培培, 卢伟东, 郭立忠, 等. 绣球菌驯化栽培[J]. 食用菌学报, 2010, 17(3): 33-36.
[10] 陈博文, 常明昌, 孟俊龙, 等. 珍稀食用菌绣球菌液体发酵工艺条件优化[J]. 核农学报, 2017, 31(10): 1979-1985.
[11] Ma L, Lin YQ, Ying ZH, et al. Production of Liquid Spawn of an Edible Mushroom,by Submerged Fermentation and Mycelial Growth on Pine Wood Sawdust[J]. Scientia Horticulturae, 2016, 209: 22-30.
[12] 林衍铨, 马璐, 江晓凌, 等. 绣球菌栽培条件优化[J]. 食用菌学报, 2012, 19(4): 35-37.
[13] 刘启燕, 戚俊, 周洪英, 等. 食用菌液体菌种工厂化生产应用现状及发展浅析[J]. 食用菌, 2018, 40(6): 8-10, 22.
[14] 谭雅娴. 金针菇、杏鲍菇、真姬菇液化菌种的研究与应用[D]. 福建农林大学, 2012.
[15] 徐兵, 吴轲轩, 郑丽雪, 等. 杏鲍菇还原型液体菌种应用技术研究[J]. 食品研究与开发, 2016, 37(1): 195-197.
[16] 刁文涛, 王雪妍, 陈晓飞, 等. 绣球菌液体菌种制备及栽培初探[J]. 食用菌, 2017, 39(5): 28-30.
[17] 杨丽莉. 绣球菌液体菌种培养及栽培基质配方研究[D]. 杨凌: 西北农林科技大学, 2019.
[18] 刘成荣. 绣球菌突变菌株液体发酵条件的研究[J]. 江西农业大学学报, 2008, 30(5): 898-902.
[19] 刘苹, 李刚, 温少红. 金针菇液体发酵产漆酶培养条件的研究[J]. 食品科学, 2012, 33(21): 226-230.
[20] 黄竹青, 郑剑玲, 邓铁宏, 等. 白色金针菇液体菌种制备及工厂化生产应用初探[J]. 微生物学杂志, 2013, 33(2): 75-79.
[21] 张杰, 侯潞丹, 贺志斌. 响应面试验优化杏鲍菇液体发酵菌种培养条件[J]. 食品科学, 2018, 38(6): 147-152.
[22] 许占伍, 张引芳, 朱爱莲, 等. 真姬菇工厂化生产液体菌种制备工艺研究[J]. 食用菌, 2011, 33(6): 22-24.
[23] 王丽娟, 刘林德, 卜庆梅, 等. 真姬菇液体菌种培养基筛选和摇瓶发酵条件的研究[J]. 食品科学, 2010, 31(17): 323-326.
[24] Fang QH, Zhong JJ. Effect of Initial Ph on Production of Ganoderic Acid and Polysaccharide by Submerged Fermentation of[J]. Process Biochemistry, 2002, 37(7): 769-774.
[25] Xiao JH, Chen DX, Wan WH, et al. Enhanced Simultaneous Production of Mycelia and Intracellular Polysaccharide in Submerged Cultivation ofUsing Desirability Functions[J]. Process Biochemistry, 2006, 41(8): 1887-1893.
[26] 王稳. 食用菌液体菌种的工艺研究及应用[D]. 镇江:江苏大学, 2005.
[27] 杨丽维, 王玉, 陈颖, 等. 杏鲍菇液体菌种制备条件的研究[J]. 食品研究与开发, 2015, 36(7): 106-109.
[28] 余昌霞, 陈明杰, 李正鹏, 等. 草菇9715液体菌种培养过程的生理变化及培养终点[J]. 微生物学通报, 2020, 47(2): 665-672.
Optimization of culture conditions of liquid spawn of
Ma Lu Yang Chi Xiao Donglai Ying Zhenghe Jiang Xiaoling Liu Xiaoyu Lin Yanquan*
(Institute of Edible Fungi, Fujian Academy of Agricultural Sciences, National and Local Joint Engineering Research Center for Breeding & Cultivation of Featured Edible Fungi, Fuzhou, Fujian 350014, China)
Liquid spawn could reduce the spawn running time and allows the antomation of inoculaton, which is crucial for industrial large scale production. In order to obtain liquid spawn ofwith high density, small diameter and more vigorous mycelium pellet, the culture conditions and its terminal points were optimized. The optimal culture conditions for maximum biomass production were listed as follows: initial medium pH 4.0, liquid volume 140~170 mL, inoculation volume 9% and rotation speed 120~150 r/min. The terminal point of liquid spawn culture is 9~10 days after inoculation, under this conditon, pellet diameter is 1.07±0.03 mm, pellet density is 111±11.53 pellets/mL and mycelial growth rate is 2.34±0.18 mm/d. the results obtained in this work will be beneficial for commercial cultivation of.
liquid culture; culture conditions; terminal point of cultivation; mycelial activity
S646
B
2095-0934(2020)06-428-06
福建省属公益类科研院所基本科研专项(2018R1020-4、2018R1020-3);福建省农业科学院科技创新团队项目(STIT2017-1-6);福建省科技特派员后补助项目绣球菌工厂化栽培技术及产业化平台建设
马璐(1984—),男,硕士,主要研究方向为食药用菌工厂化栽培。E-mail:malujj@163.com。
林衍铨(1963—),男,研究员,主要从事食用菌育种与工厂化栽培的研究与开发,E-mail:lyq-406@163.com。

