IVF-ET周期中雌激素浓度的变化与妊娠结局的关联性研究
孙玉琴,黄培,张睿,邹淑花
(1.山东省淄博市妇幼保健院生殖医学中心,淄博 255029;2. 上海国际和平妇幼保健院生殖中心,上海 200030)
在正常妇女的自然月经周期中,血清雌二醇(E2)的浓度随着卵泡的生长逐渐增加,排卵前达到第1个峰值,在黄体生成素(LH)峰后血中的E2浓度迅速下降,排卵后形成黄体,同时分泌雌激素使E2浓度再次上升,到黄体中期形成第2个峰值,雌、孕激素按照一定的规律和比例合成分泌,共同作用于子宫内膜,为胚胎植入做准备。在IVF-ET过程中,应用外源性激素来促进多个卵泡发育,使血清E2浓度急剧升高,但在取卵过程中随着颗粒细胞的丢失,血清E2的浓度又骤降,所以血清E2浓度是控制性促排卵(COH)过程中重要的监测指标,它不仅反映卵泡的生长发育状态,指导临床用药,而且影响子宫内膜的容受性与胚胎着床[1]。因此探究IVF-ET过程中血清E2浓度的变化至关重要,目前国内外关于E2浓度的变化对临床结局的影响无统一观点,而且尚无HCG日至胚胎移植日连续6 d血清E2浓度的监测。因此本研究监测自HCG日起连续6 d血清E2浓度的变化曲线及其预测妊娠结局的价值。
资料与方法
一、研究对象
回顾性分析自2017年1月至2020年1月在淄博市妇幼保健院生殖医学中心接受IVF-ET治疗的正常卵巢功能的不孕症患者41例(41个周期)。纳入标准:(1)选取同一临床医师的患者;(2)药物使用剂量按照科室制定的SOP手册实施;(3)对促排卵药物正常反应者。(4)黄体期长方案鲜胚移植者;(5)年龄<40岁,主要不育因素为输卵管因素、排卵障碍、男方因素;(6)夫妇染色体正常,免疫学检查正常,孕期无感染史;(7)自愿接受自HCG日起连续6 d测定E2浓度者。排除标准:自HCG日起至移植日服用雌激素相关药物者。本研究已通过淄博市妇幼保健院医学伦理审查批准。
二、研究方法
1.辅助生殖(ART)方案:所有研究对象均采用黄体期长方案,在黄体中期(子宫内膜为C型,E2>183.5 pmol/L,孕酮>15.9 nmol/L)时使用0.1 mg促性腺激素释放激素激动剂(GnRH-a,达菲林,Ferring,德国)降调节,14~21 d达到降调节标准(内膜厚度<4~5 mm、LH<5 U/L、E2<183.5 pmol/L,无功能性囊肿),依据个体化使用合适剂量的促性腺激素(Gn)启动,根据卵泡数量、卵泡生长速度及激素水平来调整Gn用量。当B超显示3个优势卵泡直径≥18 mm,平均每个优势卵泡的E2浓度在734~1 101 pmol/L时停用Gn,并在当晚肌肉注射HCG注射液(HCG,注射用绒促性素,珠海丽珠制药)8 000~10 000 U,自HCG日起连续6 d测定血清E2浓度并分别记为d0E2、d1E2、d2E2(取卵日)、d3E2、d4E2和d5E2(胚胎移植日)。于HCG注射后36~38 h取卵(OPU),OPU后给予黄体支持,将取出的卵子置于培养箱中培养,卵子进一步成熟后加入精液继续培养,OPU后第3天移植Ⅱ级7细胞以上胚胎1~2个。
2.胚胎形态学评级及优质胚胎评定:根据胚胎的卵裂球数目、形态、胞质颗粒及胞质形态等按胚胎的形态学评级法将胚胎分为I~IV级[2]。根据本中心的SOP手册评定优质胚胎:取卵后第1天观察原核为正常受精,第3天评级为I级、II级,卵裂球7~8个且碎片率<20%的胚胎。
3.激素的实验室检测及基础窦卵泡数(AFC)的监测:每位患者在月经期第3~5天清晨8:00~9:00抽静脉血3~5 ml测定基础性激素六项及经阴道超声监测基础AFC数目;自HCG日起连续6 d于每日清晨8:00~9:00抽静脉血3~5 ml测定血清E2浓度。均使用西门子原厂试剂盒及化学发光法进行检测,均严格按照试剂盒及仪器的说明书进行操作。批内变异系数<5%,批间变异系数<10%。
4.妊娠结果判断标准:移植胚胎后28~30 d经阴道B超可见孕囊者为临床妊娠(宫内妊娠)。
5.观察指标计算方法:dnE2增幅=(dn-d0)E2/d0E2×100%;获卵率=所获卵母细胞数/HCG注射日直径≥14 mm的卵泡数×100%;正常受精率=正常受精数/成熟卵母细胞数×100%;优胚率=2PN优胚数/2PN数×100%。种植率=B超下见到的孕囊数/移植胚胎数×100%。
6.分组方法:根据取卵日相对于HCG日E2比值(d2E2/d0E2)的四分位数(P25,P75)分为A组(
三、统计学分析
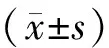
结 果
一、妊娠组与非妊娠组基本特征及促排卵情况
收集的41份病例中,临床妊娠20例(48.8%),非妊娠21例(51.2%)。两组间年龄、体重指数(BMI)、基础AFC数、基础激素水平、移植胚胎数、获卵数、正常受精数、优胚数,差异均无统计学意义(P>0.05)(表1)。
表1 妊娠组与非妊娠组基本特征及促排卵情况比较[(-±s),M(P25,P75)]
二、妊娠组与非妊娠组自HCG日起连续6 d血清 E2浓度变化及变化幅度比较
妊娠组和非妊娠组HCG日的血清E2浓度分别为(13 688.95±4 851.43)pmol/L和(11 625.81±4 755.09)pmol/L;HCG日后1 d血清E2浓度上升至高峰,妊娠组达到(17 211.85±5 283.07)pmol/L,非妊娠组达到(14 848.29±5 799.09)pmol/L;OPU后1 d血清E2浓度降至最低,妊娠组和非妊娠组分别为(2 482.75±1 080.95)pmol/L 和(2 251.38±952.28)pmol/L;自OPU后第2天开始上升,至ET日妊娠组(6 626.60±2 401.13)pmol/L和非妊娠组(6 047.71±2 587.54)pmol/L,均低于HCG日。虽然各时点血清E2浓度妊娠组均比非妊娠组高,但差异均无统计学意义(P>0.05)(图1)。

图1 两组自HCG日起连续6 d血清E2浓度变化趋势
两组各时点血清E2变化幅度差异均无统计学意义(P>0.05)(表2)。妊娠组在移植前1 d的E2水平下降幅度(66.73%)较非妊娠组(68.26%)少,提示移植前1 d血清E2较HCG日下降较少时可能会有较高的妊娠率。
三、按取卵日相对于HCG日E2比值四分位数分组分析
根据取卵日相对于HCG日E2比值(d2E2/d0E2)四分位数(P25,P75)分成A组(<0.44,n=10)、B组(0.44~0.68,n=21)和C组(>0.68,n=10)。三组间基本特征(年龄、BMI、不孕年限、AFC及基础激素水平)均无统计学差异(P>0.05)。与A组和C组相比,B组的正常受精数显著增高(P<0.05),可用胚胎数略高但差异无统计学意义(P>0.05);与A组相比,B组的获卵数显著增高(P<0.05);3组间正常受精率、优胚率、胚胎种植率、妊娠率均无统计学差异(P>0.05)。提示当0.44≤d2E2/d0E2≤0.68时,获卵数及正常受精数较高,但不能提升临床妊娠率(表3)。
表2 妊娠组与非妊娠组自HCG日至ET日血清E2浓度变化幅度比较[(-±s),M(P25,P75),%]

表3 按取卵日相对于HCG日E2比值四分位数分组分析[(-±s),M(P25,P75),%]
四、按ET日相对于HCG日E2比值四分位数分组分析
根据ET日相对于HCG日E2比值(d5E2/d0E2)四分位数(P25,P75)分成D组(<0.41,n=10)、E组(0.41~0.52,n=21)和F组(>0.52,n=10)。三组间基本特征(年龄、BMI、不孕年限、AFC及基础激素水平)均无统计学差异(P>0.05);E组较其他两组的正常受精率更高(69.68%)、优胚率更低(25.27%),差异有统计学意义(P<0.05);E组的妊娠率略高于D组和F组,但差异无统计学意义(P>0.05)。提示当0.41≤d5E2/d0E2≤0.52时,正常受精率较高,但不能显著提高临床妊娠率(表4)。
表4 按ET日相对于HCG日E2比值四分位数分组分析[(-±s),M(P25,P75),%]
讨 论
雌激素在卵泡发育及内膜容受性方面发挥着重要作用,在COH过程中不可避免的会产生超生理量的血清E2浓度。血清E2浓度自HCG日至胚胎移植(ET)日如何变化及与妊娠结局的关系,目前国内外尚无统一观点。本研究提示HCG日妊娠组和非妊娠组的血清E2浓度分别为(13 688.95±4 851.43)pmol/L和(11 625.81±4 755.09)pmol/L,自HCG日起连续6 d血清E2浓度均成曲线变化,在HCG日后1 d血清E2浓度上升至高峰,取卵(OPU)日后1 d血清E2浓度降至最低后又复升,各时点妊娠组的血清E2浓度均比非妊娠组高,但两组间的血清E2浓度,血清E2浓度变化幅度、获卵数、正常受精数、优胚数差异均无统计学意义(P>0.05)。
2019年,Li等[1]的研究认为在鲜胚移植周期中,最佳的HCG日血清E2浓度范围为3 670 pmol/L~11 553.16 pmol/L,而在本研究中,妊娠组HCG日血清E2浓度的均值高于此范围。另有研究认为HCG日血清E2浓度并不能预测活产率[3]。注射HCG后34~36 h为OPU日,此时血清E2浓度为卵细胞成熟时体内所处的内环境,其变化水平间接反映体内卵细胞的发育情况。本研究发现妊娠组与非妊娠组在OPU日的血清E2浓度(d2E2)均值分别为(6 998.15±3 094.74)pmol/L和(6 781.90±2 754.92)pmol/L,分别较HCG日下降46.54%和38.91%,两组间差异无统计学意义(P>0.05)。2016年,卢娜等[4]研究发现鲜胚移植周期中,OPU日较HCG日血清E2浓度升高的组别的临床妊娠率、种植率及出生率均高于下降组及持平组,差异有统计学意义(P<0.05),在子代安全方面三组间无统计学差异(P>0.05)。本研究的41例患者中,只有1例患者的血清E2浓度在OPU日较HCG日上升约32.88%,其余均下降;将OPU日与HCG日血清E2浓度的比值(d2E2/d0E2)按四分位数分为3组后比较了组间妊娠率及促排卵后各个指标的差异,发现当0.44≤d2E2/d0E2≤0.68时,有较高的获卵数与正常受精数,但不能提升妊娠率与种植率。OPU后随着颗粒细胞的丢失,血清E2浓度降低,本研究发现d3(OPU后1 d)E2浓度降至最低点,然后逐渐上升,但妊娠组血清E2浓度在OPU后2 d较HCG日下降约66.73%,非妊娠组下降约68.26%。这与2015年张雅洁等[5]的研究相似,该研究认为在OPU后2 d血清E2较HCG日下降,随着下降幅度的增加,卵裂期胚胎移植周期早期流产及异位妊娠的风险增加。在OPU后第3天即为ET日,在本研究中妊娠组与非妊娠组在ET日的血清E2浓度分别为(6 626.60±2 401.13)pmol/L和(6 047.71±2 587.54)pmol/L,这与2017年Rehmanm等[6]的研究结果相似,提示ET日较高的血清E2浓度可预示较好的妊娠结局。同时本研究将ET日血清E2浓度与HCG日血清E2浓度比值(d5E2/d0E2)按四分位数分为3组后,发现当0.41≤d5E2/d0E2≤0.52时,正常受精率较高,但并不能显著提高临床妊娠率(P>0.05),而孙莹璞等[7]研究认为当d5E2/d0E2<0.25时,临床妊娠率显著降低(P<0.01),建议适当补充雌孕激素,提高临床妊娠率。
正常育龄妇女在排卵后黄体中期会形成第2个E2高峰,有研究认为黄体期E2可刺激孕激素受体,促进子宫内膜腺体和子宫内膜上皮细胞肥大和增生,为胚胎植入做准备[8]。本研究的不足在于未对移植后黄体中期血清E2浓度与妊娠结局进行研究。2015年韦静等[9]对ET后血清E2浓度进行了相关研究,分析了274个长方案IVF-ET周期,在HCG注射日、ET日、ET后4 d及ET后8 d监测血清E2浓度,结果显示,血清E2浓度在妊娠组与未妊娠组均呈下降趋势,但妊娠组在各时点的血清E2浓度均高于未妊娠组,差异有统计学意义(P<0.05),ET后4 d较ET日血清E2浓度的下降幅度在两组间比较差异无统计学意义(P>0.05),但妊娠组在ET后8天血清E2浓度为(2 201.27±2 343.30)pmol/L,非妊娠组为(549.40±403.33)pmol/L,妊娠组的E2浓度下降幅度显著小于非妊娠组(P<0.01)。2018年Florêncio等[10]评估了在黄体中期(ET后7 d)血清E2浓度与妊娠结局的关系,结果发现血清E2浓度在<367 pmol/L、367~1 835 pmol/L和>1 835 pmol/L三个不同浓度区间的妊娠率分别为13.3%、26.8%和36.3%,妊娠组的血清E2浓度在3 049.77~3 086.47 pmol/L之间,非妊娠组在1 445.98~1 592.78 pmol/L之间,两组间差异有统计学意义(P<0.001)。然而,在黄体期添加雌激素后是否会改善妊娠结局,国内外相关研究的结论尚未统一。
理论上,黄体可以产生雌、孕激素,雌激素可能具有促进黄体血管形成、维持黄体形成因子与溶解因子之间的平衡、调节内膜孕激素受体表达影响孕激素发挥作用等功能[11]。在COH过程中,不同浓度的雌激素可不同程度地影响与子宫内膜容受性相关的部分蛋白质的表达,合适的雌激素浓度可能是保证高妊娠率的条件[12]。鲜胚移植周期促排卵时超生理量的E2水平,在取卵后又快速下降,低雌激素水平可延迟内膜成熟。因此,有学者提出添加雌激素进行黄体支持可进一步提高妊娠率[13]。针对不同卵巢反应的人群,有研究认为对于卵巢高反应[14]及正常反应的人群[15]添加雌激素后不能改善妊娠结局,对卵巢低反应的人群添加雌激素后是否有利于妊娠结局尚有争议[13,16]。在运用不同方案的人群中,有研究认为黄体期加用雌激素的治疗并不能改善妊娠结局,甚至有降低妊娠率的可能,而对于运用长方案治疗的患者,由于其易导致血清E2浓度显著降低,外源性雌激素的使用可能有一定效果[17]。2017年Pinheiro等[18]对2000~2016年的文献进行了筛选,评估在拮抗剂方案的黄体期添加雌激素后是否会影响妊娠率,发现仅有一项研究认为补充雌激素后有利于胚胎着床,但不能提升妊娠率。近期的两项荟萃分析也认为添加雌激素后并不能改善妊娠结局[19-20]。当对人黄体细胞进行体外培养时,加入不同浓度的雌激素后将不同程度地影响孕激素的产生,因此如果雌/孕激素的比例不合适,过量的雌激素可抑制孕激素的产生,影响子宫内膜的容受性,有研究者推测适量的雌激素是保证正常妊娠的必要条件之一[21]。2019年Çakar等[15]研究认为在采取拮抗剂方案的ICSI周期中,补充4 mg的雌激素并不能改善妊娠结局;Ismail等[22]也得出了相似的结论。2015年Zhang等[23]研究发现添加6 mg/d的雌二醇者具有较高的妊娠率,但是Kutlusoy等[13]发现黄体酮+6 mg雌二醇组与单纯黄体酮组的临床妊娠率无显著差异。因此目前国内外对黄体期是否添加雌激素,以及添加不同剂量的雌激素对妊娠结局的影响仍未达成一致,但是关于雌激素的剂型不会影响妊娠结局已在2019年Scheffer等[24]的研究中得到了证实。
综上所述,在IVF-ET周期中自HCG日起至卵裂期胚胎移植日血清E2浓度成曲线变化,在HCG日后1天上升至高峰,取卵后1天下降至最低后又复升,各时点妊娠组E2浓度均比非妊娠组高;当0.44≤d2E2/d0E2≤0.68时有更多的获卵数及正常受精数,但不能改善临床妊娠率;当0.41≤d5E2/d0E2≤0.52时会有较高的正常受精率,但优胚率低,也不能显著提高临床妊娠率。由于本研究样本量偏少,因此今后将扩大样本量,继续连续测定血清E2浓度至黄体中期以综合评估血清E2浓度的变化与妊娠结局的关联性,为今后黄体支持中是否需要添加雌激素提供理论支持。

