基于JAK-STAT信号通路研究保肺定喘汤干预COPD肺血管重构的分子机制
浙江省中西医结合医院 杭州 310003
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一组以持续气流受限为特征的疾病,发病率、致残率均较高[1-2],随着患者年龄增加、抵抗力下降,COPD并发症增多、死亡风险增加,严重影响患者生活质量,并增加社会经济负担。尽管支气管扩张剂、抗炎药物能一定程度地改善患者临床症状,但无法完全治愈疾病,目前也尚未找到更为理想的治疗手段。COPD的发生机制未完全清晰,因此研究COPD的分子机制对于探寻新的治疗手段,提高临床疗效有着重要意义。研究发现,肺血管重构是COPD的发生、发展中的重要环节,而与此相关的细胞外信号调节激酶(extracellular signal regulated kinase,ERK)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、两面神激酶/信号转导与转录激活因子(Janus kinase/signal transducer and activator of transcriptions,JAK/STAT)等信号通路也是当前的研究热点[3-5]。保肺定喘汤是由国家级名老中医王会仁教授所提出的经验方,治疗COPD临床效果良好[6]。为进一步探索保肺定喘汤治疗COPD的相关机制,本研究以肺动脉平滑肌细胞(pulmonary arterial smooth muscle ceu,PASMC)作为研究对象,探讨其对PASMC增殖、凋亡以及相关信号通路的影响,以期帮助临床认识肺血管重构的分子机制。
1 材料和方法
1.1 实验动物 清洁级雄性SD大鼠8只购于浙江省实验动物中心[实验动物生产许可证号:SCXK(浙)2008-0033],6~8周龄,体质量170~210g,平均体质量(195.00±35.50)g,均饲养于浙江中医药大学动物实验中心[实验动物使用许可证号:SYXK(浙)2013-0184]。
1.2 细胞 PASMC购自于美国Cell Signaling Technology公司(批号:13110S)。
1.3 药品与试剂 保肺定喘汤组成:甘草6g,桔梗、麦冬各9g,当归、仙灵脾各10g,党参、黄芪、丹参、熟地、广地龙各15g。以上药材均购自同仁堂(亳州)饮片公司,在实验室制成生药含量3.1g·mL-1的流浸膏,4℃保存备用。3R4F香烟来自于美国肯塔基大学;胰酶购于舜冉(上海)生物科技有限公司(批号:25200-056);高糖完全达尔伯克改良伊格尔培养基(Dulbecco's modified eagle medium,DMEM)购于上海雅吉生物科技有限公司(批号:PM150210B);Annexin-V/碘化丙啶(propidium iodide,PI)液购于上海邦景公司(批号:BJ-15163);信号转导和转录激活因子1(signal transducer and activator of transcription 1,STAT1) 单抗、STAT3单抗、两面神激酶2(Janus kinase 2,JAK2)单抗均购于上海群己生物科技有限公司 (批号:单抗-MAB19093、单抗-MAB19127、单抗-MAB22312);酪氨酸蛋白激酶抑制剂AG490购于艾美捷科技有限公司(批号:SIH-428-25MG-E)。
1.4 主要仪器 酶标仪为美国Molecular Devices公司产品;荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪购于广州永诺生物科技有限公司。
1.5 方法
1.5.1 细胞周期检测 PASMC以含10%胎牛血清的DMEM高糖完全培养基培养,在37℃、5% CO2条件下生长,选择指数生长期的细胞用于后续实验。将SD大鼠随机分成2组,适应性喂养7d后,分别予12.4g/(kg·d)保肺定喘汤、等量0.9%氯化钠溶液灌胃,2次/d,连续3d。末次灌胃1h后心脏采血,3 000r/min离心10min,分离血清,过滤、灭活后,分别获得空白血清和含药血清,均于-70℃保存备用。取5~10代生长良好的PASMC,DMEM培养基培养24h至细胞处于G0期,分为空白对照组(培养基中加入0.9%氯化钠溶液)、空白血清组(培养基中加入空白血清)、药物血清组(培养基中加入10%含药血清),细胞继续培养12h,胰酶处理后弃去上清液,固定、冲洗、孵育,流式细胞仪检测,488nm波长下检测细胞周期。
1.5.2 制取香烟提取物(cigarette smoke extract,CSE)液 采用CSE造模,烟雾存于50mL注射器内,取10支注入含10%胎牛血清(fetal bovine serum,FBS)的DMEM高糖培养基25mL的玻璃瓶中,获得100%CSE原液,取CSE原液10mL加90mL DMEM高糖完全培养基得10%的CSE液。
1.5.3 给药 取对数生长期PASMC,以1×104/孔的细胞数量接种于96孔板中,并分为对照组(培养基中加入0.9%氯化钠溶液+空白血清)、模型组(培养基中加入10%CSE+空白血清)、药物组(培养基中加入10%CSE+10%含药血清),各组细胞均在37℃、5%CO2的培养箱中培养。
1.5.4 细胞凋亡检测 对照组、模型组、药物组培养24h后,收集细胞,每组设6个复孔,离心、磷酸盐缓冲液(phosphate buffer solution,PBS) 洗涤后加入2μL Annexin-V+2μLPI行联合标记,流式细胞仪检测细胞凋亡率。
1.5.5 Western blot检测增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)蛋白的表达 将细胞分为对照组(培养基中加入0.9%氯化钠溶液+空白血清)、AG490组(培养基中加入终浓度为30nmol·mL-1的AG490)、模型组 (培养基中加入10%CSE+空白血清)、CSE+AG490组 (培养基中加入10%CSE+终浓度为30nmol·mL-1的AG490)、药物组(培养基中加入10%CSE+10%含药血清)。各组培养48h后收集细胞,裂解后离心,取上清液移入离心管,蛋白定量后电泳、转膜,脱脂奶粉封闭后加入一抗,4℃孵育过夜,Tris-Tween缓冲盐溶液(Tris buffered saline Tween,TBST)洗涤后加入二抗,室温孵育2h,TBST脱色洗膜3次,以化学成像分析仪扫膜,以目标蛋白与内参蛋白条带灰度比值表示蛋白相对表达量,以三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphata dehydrogenase,GAPDH)为内参。
1.5.6 Western blot检测JAK/STAT信号通路相关蛋白的表达 将细胞分为分对照组(培养基中加入0.9%氯化钠溶液+空白血清)、模型组(培养基中加入10%CSE+空白血清)、药物组(培养基中加入10%CSE+10%含药血清),各组培养48h后收集细胞,以Western blot检测JAK/STAT信号通路相关蛋白的表达,操作步骤同1.5.5。
1.6 统计学分析 采用SPSS 22.0统计软件进行统计学分析,计量资料以±s表示,多组间比较采用方差分析,两两比较采用独立t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组PASMC的细胞周期比较 空白对照组、空白血清组及药物血清组PASMC的细胞周期分布差异无统计学意义(P>0.05)。见表1。
2.2 各组PASMC凋亡率比较 流式细胞仪检测提示,模型组和药物组PASMC凋亡率显著高于对照组(P<0.05),药物组PASMC凋亡率显著低于模型组(P<0.05)。见表2。
表1 各组PASMC细胞周期比较(±s,%)Tab.1 Comparison of PASMC cell cycle in each group(±s,%)
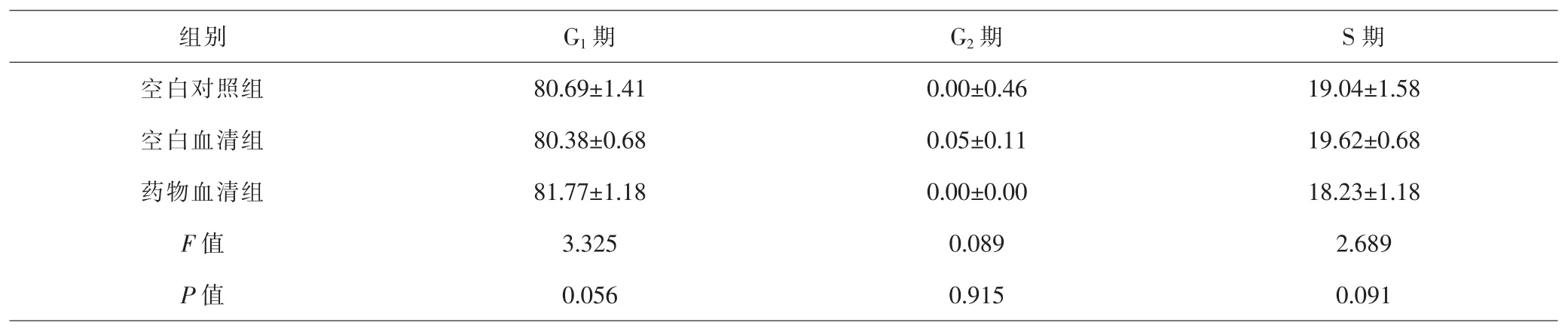
表1 各组PASMC细胞周期比较(±s,%)Tab.1 Comparison of PASMC cell cycle in each group(±s,%)
组别 G1期 G2期 S期空白对照组 80.69±1.41 0.00±0.46 19.04±1.58空白血清组 80.38±0.68 0.05±0.11 19.62±0.68药物血清组 81.77±1.18 0.00±0.00 18.23±1.18 F值 3.325 0.089 2.689 P值 0.056 0.915 0.091
表2 各组PASMC凋亡率比较(±s,%)Tab.2 Comparison of apoptosis rate of PASMC in each group(±s,%)

表2 各组PASMC凋亡率比较(±s,%)Tab.2 Comparison of apoptosis rate of PASMC in each group(±s,%)
注:与对照组比较,#P<0.05;与模型组比较,*P<0.05Note:Compared with control group,#P<0.05;compared with model group,*P<0.05
细胞凋亡率对照组 4.38±0.37模型组 20.38±1.35#药物组 11.10±1.14#*F值 475.332 P值 <0.05组别
2.3 各组PCNA表达水平比较 与对照组比较,模型组、药物组、CSE+AG490组PCNA相对表达量均有所上升,模型组PCNA相对表达量显著高于对照组(P<0.05);而CSE+AG490组及药物组PCNA相对表达量均显著低于模型组(P<0.05),CSE+AG490组与药物组比较差异无统计学意义(P>0.05)。见图1。
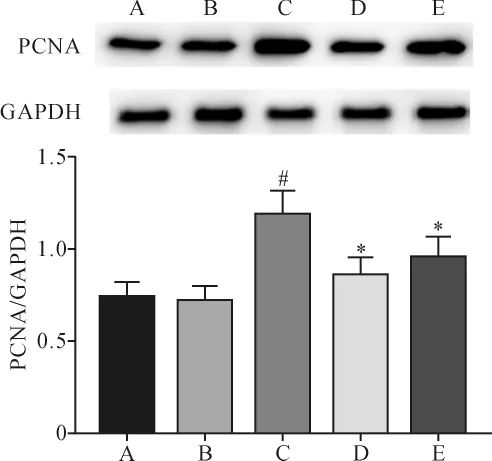
图1 各组PCNA表达比较Fig.1 Comparison of PCNA expression in each group
2.4 各组JAK/STAT信号通路相关蛋白表达水平比较模型组p-JAK/JAK、p-STAT1/STAT1、p-STAT3/STAT3比值均显著高于对照组p-JAK/JAK、p-STAT1/STAT1、p-STAT3/STAT3比值(P<0.05);药物组p-JAK/JAK、p-STAT1/STAT1、p-STAT3/STAT3比值均显著低于模型组(P<0.05)。见表3、图2。
3 讨论
诱发COPD的因素众多,α1-抗胰蛋白酶缺乏、吸烟(最主要的环境因素)、接触职业粉尘、感染等都可引发该病[7-8],但临床上仍有相当一部分患者的病因未明,且目前尚不能彻底治愈,因此积极探讨有效防治COPD的手段具有重要的临床意义。肺血管重构在COPD的病情进展中处于关键地位[9-11],也是引发COPD患者肺源性心脏病的主因,但目前对于肺血管重构的具体机制尚未完全清晰。目前认为,肺血管周围基质沉积、平滑肌异常增殖、血管内皮受损及炎性浸润都可刺激肺血管重构,且近年来学者们越来越关注炎性因子、炎性趋化因子的多信号传导通路在COPD发生、发展进程的作用机制。保肺定喘汤是由国家级名老中医王会仁教授所提出的经验方,研究报道其治疗COPD临床效果良好[6]。杨宏宽等[12]研究指出,保肺定喘汤同舒尼替尼一样有助于抑制肺血管重构,但其具体机制未明。
PASMC是肺血管重构的主要效应细胞之一,因此本研究选择PASMC作为研究肺血管重构相关分子机制的靶细胞。细胞凋亡也称为程序性死亡,是细胞的一种基本生物学现象。研究证实PASMC增殖与凋亡失衡是肺血管重构的诱因[9]。前期研究发现,保肺定喘汤含药血清能抑制CSE诱导的细胞增殖[13]。本研究结果提示,与空白血清组比较,药物血清干预并不影响PASMC的细胞周期,但药物组细胞凋亡率明显低于模型组,以此推测保肺定喘汤会抑制CSE诱导的PASMC凋亡,但该作用与细胞周期阻滞无关。结合既往研究结果,提示保肺定喘汤可能通过调整CSE诱导的PASMC增殖与凋亡失衡,从而改善肺血管重构。
表3 各组PASMC中JAK/STAT信号通路相关蛋白表达比较(±s)Tab.3 Comparison of JAK/STAT signaling pathway related proteing in each group(±s)
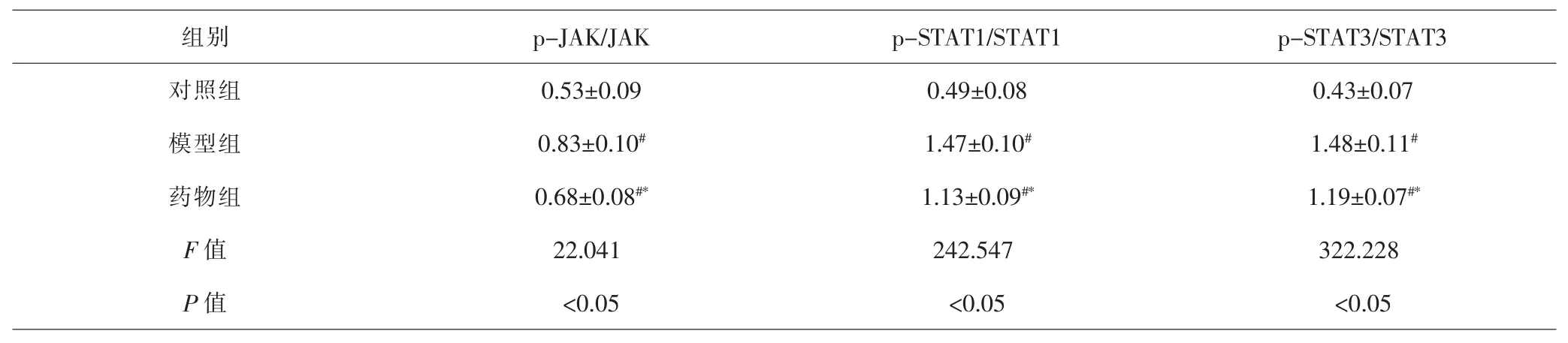
表3 各组PASMC中JAK/STAT信号通路相关蛋白表达比较(±s)Tab.3 Comparison of JAK/STAT signaling pathway related proteing in each group(±s)
注:与对照组比较,#P<0.05;与模型组比较,*P<0.05Note:Compared with control group,#P<0.05;compared with model group,*P<0.05
组别 p-JAK/JAK p-STAT1/STAT1 p-STAT3/STAT3对照组 0.53±0.09 0.49±0.08 0.43±0.07模型组 0.83±0.10# 1.47±0.10# 1.48±0.11#药物组 0.68±0.08#* 1.13±0.09#* 1.19±0.07#*F值 22.041 242.547 322.228 P 值 <0.05 <0.05 <0.05

图2 各组JAK/STAT信号通路相关蛋白表达比较Fig.2 Comparison of JAK/STAT signaling pathway related proteins expression in each group
目前已有较多研究显示,JAK、STAT磷酸化下调与PCNA表达以及细胞凋亡密切相关[14-15]。JAK/STAT信号通路在细胞增殖、凋亡过程中具有重要作用。JAK包括JAK1、JAK2、JAK3和酪氨酸激酶2(tyrosine kinase 2,Tyk2)共4个非受体蛋白酪氨酸激酶家族成员,广泛参与多种细胞的增殖分化进程,与消化道肿瘤、类风湿关节炎、免疫功能缺陷等疾病密切相关[16-17],白细胞介素、白血病抑制因子等细胞因子均可激活JAK蛋白磷酸化。STAT包括STAT1、STAT2、STAT3等7种成员,作为JAK下游的蛋白,STAT在细胞质中以单体形式存在,可将细胞信号传导至细胞核内。JAK激活后可催化受体上的酪氨酸残基磷酸化,并形成相应的STAT结合位点,STAT与该位点结合后发生磷酸化而被激活,活化的STAT进入细胞核内与目的基因的启动子相结合,从而激活相应的基因转录和翻译,最终引发炎症反应,促进肺血管重构[14]。而本研究显示,与JAK/STAT通路阻断剂AG490组比较,模型组的PCNA显著升高,而药物组的PCNA含量与AG490组相当,这提示保肺定喘汤可抑制肺血管重构,而且作用与AG490相似。进一步研究显示,药物组的p-JAK/JAK、p-STAT1/STAT1、p-STAT3/STAT3均显著低于模型组,笔者推测保肺定喘汤抑制肺血管重构的机制可能与下调JAK、STAT1、STAT3的磷酸化有关,该结果与何飞等[18]既往研究发现保肺定喘汤能够抑制p-JAK2、p-STAT3表达,并抑制IL-6的分泌一致。本研究中药物组的p-STAT1/STAT1低于模型组,而且其细胞凋亡率也低于模型组,提示保肺定喘汤还可作用于STAT1的表达从而影响细胞凋亡。
综上所述,保肺定喘汤通过干预COPD的JAK/STAT信号通路而抑制肺血管重构,其作用机制可能与抑制JKA、STAT1、STAT3等磷酸化有关。本试验尝试阐述保肺定喘汤对肺血管重构的JAK/STAT通路的影响,但COPD分子机制复杂,且本研究未设立STAT的特异性阻断剂组,仍有待于后续更为严谨的多中心研究深入探讨。

