高孔隙率海藻酸钠-聚乙烯醇复合海绵的制备及性能1)
马荣秀 张雅伟 戚后娟 石彩 黄占华
(东北林业大学,哈尔滨,150040)
皮肤是人体最大的器官,是维持人体内环境稳态的重要保障,在生活中,皮肤不可避免地会受到创伤,造成体液内水分、蛋白等的流失,细菌很容易在伤口处繁殖引起感染,因此,保护皮肤的健康完整是十分必要的。伤口处理的基本原则是清洁与保护创面,减少组织渗出液,防止细菌感染。为达到以上治疗效果,伤口敷料应运而生[1-3]。理想的伤口敷料应具有如下功能:①避免水分和体液的过分散失;②一定的抗菌性能;③透湿、透气,为创面提供湿润的环境;④生物相容性好及可降解的特点;⑤减少换药次数,减轻环保压力[4-5]。传统敷料如医用绷带和纱布等,都能不同程度地吸收渗出液,对创面愈合有一定保护作用。但是,这类敷料不能为伤口提供湿润环境,被浸透后会失去保护功能,易引起细菌感染[6-7]。海绵类敷料是一种新型的医用敷料,具有连通的微孔结构,透气性能优异,能够吸收大量渗出液,为伤口提供潮湿环境[8]。聚乙烯醇是一种水溶性高分子聚合物,可生物降解,具有良好的生物相容性,在药物缓释及伤口敷料等医学领域有广泛的应用,而单纯的聚乙烯醇吸水性差,限制了聚乙烯醇在医用敷料方面的应用[9-10]。海藻酸钠是一种天然可降解多糖,具有促进伤口愈合、保湿和吸湿等功能[11-12]。本研究以聚乙烯醇和海藻酸钠为原料,利用简单的溶液共混和冻干成型相结合的方法,制备具有高孔隙度的海藻酸钠-聚乙烯醇复合海绵,同时,载入抗菌药物,研制新型兼有创造微湿环境、抑制细菌生长、促进伤口愈合的理想伤口敷料。
1 材料与方法
1.1 仪器与试剂
傅里叶红外分光光度计(iS10,美国Nicolet公司);扫描电子显微镜(QUANTA200,荷兰FEI公司);X射线衍射仪(D/MAX2200型,日本理学株式会社);冷冻干燥机(FD-1A-50,北京博医康实验仪器有限公司);酶标仪(分子设备公司,型号:SpectraMax i3x)。
聚乙烯醇(PVA),分析纯(醇解度98%~99%,1799型),上海阿拉丁工业公司;海藻酸钠(SA),分析纯,上海麦克林生化公司;磷酸二氢钾(KH2PO4),磷酸氢二钠(Na2HPO4),分析纯,天津基准化学试剂有限公司;10%中性福尔马林,AR,南昌雨露实验器材有限公司;实验小鼠:健康SPF级昆明小鼠,年龄为8周,雄性,体质量为200 g左右,由辽宁省动物资源中心提供。
1.2 SA-PVA复合海绵的制备
SA-PVA复合海绵的制备流程如图1所示。首先制备质量分数10%的PVA溶液和2%的SA溶液。然后,将两种溶液按比例混合,在40 ℃下搅拌3 h,得到SA-PVA混合液(SA的质量分别为总固体质量的0、10%、20%、40%)。将得到的SA-PVA混合溶液静置2~3 h,以除去气泡。最后,倒入模具中,在-20 ℃下冷冻20 h,室温下解冻4 h,连续3个循环并冷冻干燥制备SA-PVA复合海绵。根据SA的质量分数,将复合海绵分别命名为PS0、PS1、PS2和PS4。通过浸渍的方式载入NFX,得到载药型海绵敷料用于小鼠伤口愈合实验。
1.3 SA-PVA复合海绵的结构表征
样品的红外光谱采用傅里叶红外分光光度计(FT-IR)进行表征,ATR附件,扫描范围为500~4 000 cm-1。样品的形貌采用扫描电子显微镜(SEM)进行表征,在观察之前把样品粘在导电胶上,喷金处理。样品的结晶度采用X-射线衍射仪(XRD)进行测试,扫描范围5°<2θ<50°,扫描速度4°/min。
1.4 SA-PVA复合海绵的性能测试
溶胀性:将干燥的样品制成直径为2 cm的圆柱形,称质量记为M0,浸入37 ℃的去离子水中。每间隔一定时间取出,用滤纸吸去残留水,称质量记为Mt。得到海绵的溶胀率[13]:
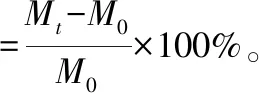
(1)
保水性:将干燥的样品制成直径为2 cm的圆柱形,称质量记为W0,浸入37 ℃的去离子水中,待样品完全溶胀后,放入37 ℃环境中。每间隔一定时间,取出称质量记为Wt,采用以下公式计算样品的保水性[13]:
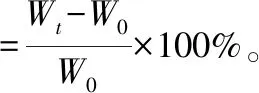
(2)
降解性:将干燥的样品称质量记为M1,浸入磷酸盐缓冲溶液(PBS)中,置于37 ℃恒温振荡器中振荡,速度为200 r/min。第3天、第7天和第14天取出,将样品冷冻干燥,称质量记为M2。由以下公式计算样品的降解性能[14]:
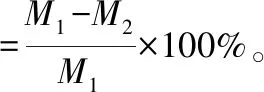
(3)
孔隙率:将样品制成大小相近的圆柱形,称质量,记为m1,测量直径和厚度,计算体积(v)。之后,将样品浸入无水乙醇中(ρ=0.789 3 g/cm3)至饱和,取出后,擦拭样品表面的无水乙醇,称质量,记为m2。孔隙率按以下公式计算[15]:
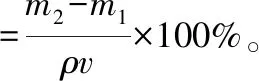
(4)
1.5 SA-PVA复合海绵的生物相容性
溶血性测试:首先,取新西兰大白兔耳缘静脉血,与柠檬酸钠溶液按照V(大白兔耳缘静脉血)∶V(柠檬酸钠溶液)=9∶1混合,得到新鲜抗凝血。将待测样品浸泡在10 mL 0.9%的生理盐水中1 h后,向试管中加入7 mL生理盐水和0.2 mL稀释抗凝血,V(新鲜抗凝血)∶V(生理盐水)=4∶5,实验组中加入0.1 g海绵,以只加入生理盐水和去离子水的试管分别作为阴性和阳性对照。将试管于37 ℃条件下放置1 h后,于2 500 r/min条件下离心5 min,取上清液,利用酶标仪测量其在545 nm处的吸光度值,计算样品的溶血率[16]:
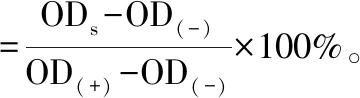
(5)
式中:ODs、OD(-)和OD(+)分别代表样品、阴性对照和阳性对照组的吸光度值。
细胞毒性测试:利用CCK-8方法测定复合海绵对NIH 3T3细胞生长活性的影响。首先,制备海绵浸提液,将海绵通过紫外照射灭菌4 h,按照0.1 g加1 mL液体的比例向海绵中加入DMEM培养基,在37 ℃条件下放置48 h,取上层浸提液备用。以添加海绵浸提液的组别为实验组,以添加完全培养基的组别为阴性对照组,对NIH 3T3细胞进行培养。于24、48和72 h取出对应的细胞培养板,利用酶标仪测定其在480 nm处的吸光度值。细胞存活率按以下公式计算[17]:
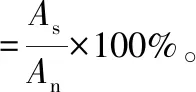
(6)
式中:As和An分别代表阴性对照和样品的吸光度值。
1.6 动物实验
在这项实验中,使用体质量200 g左右的昆明小鼠模拟伤口愈合过程。取若干只小鼠,随机分成3组,分别设为纱布对照组、PS2组和PS2-NFX组。术前将小鼠放置在麻醉罐中通过浸有乙醚的棉花麻醉,进行剃毛及消毒处理,使用手术剪使小鼠背部形成直径约为7 mm的伤口。将相应的样品附着在伤口上,并进行固定。在小鼠术后,定期进行换药处理,并拍照、测量伤口面积,按以下公式计算伤口愈合率[18]:
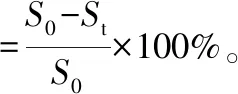
(7)
式中:S0为手术后小鼠的伤口面积;St为拍照当天的伤口面积。
2 结果与分析
2.1 SA-PVA复合海绵的结构表征
SA、NFX、PS0、PS2和PS2-NFX的红外光谱如图2a所示。可知,SA在1 593、1 408、1 026 cm-1处的吸收峰分别对应CC、C—OH、C—O的伸缩振动[19]。NFX在1 720 cm-1处的吸收峰对应—COOH的伸缩振动,1 610 cm-1的吸收峰对应羟基吡啶酮[20]。PS0的红外光谱在2 927 cm-1处的吸收峰分别对应C—H的伸缩振动;在3 293和1 087 cm-1处的吸收峰分别对应O—H伸缩振动和C—O的伸缩振动[21]。与PS0相比,PS2的特征峰的位置基本无变化,只是羟基峰略微变宽,这可能归因于SA与PVA之间的氢键作用。在PS2-NFX的红外光谱中,可以观察到1 610 cm-1处的特征峰,证明复合海绵已经成功负载诺氟沙星。SA、PS0和PS4的XRD结果如图2b所示。可以看出,SA的特征衍射峰出现在2θ=13.5°,2θ=22.0°[22],PS0在2θ=19.6°、2θ=22.5°具有两个特征衍射峰[9]。在SA-PVA的XRD图谱中可以观察到衍射峰2θ=19.6°、22.5°,且没有其他衍射峰,表明SA与PVA已完全混合均匀,随着SA质量分数的增加,在2θ=19.6°、22.5°处的衍射峰的强度降低且变得稍宽,这可能是由SA与PVA之间的氢键作用导致的。图3为不同SA质量分数复合海绵的SEM图。可知,复合海绵呈三维多孔结构,PS0、PS1、PS2和PS4的孔径分别为62.45±19.8、66.8±19.7、68.15±21.0和71.9±17.2 μm。随着SA质量分数的增加,复合海绵的孔径增大,这可能是由于SA与PVA之间的氢键作用,使海绵网络的交联密度降低。该复合海绵的孔径利于成纤维细胞的生长和迁移,有助于伤口愈合。
2.2 溶胀性、保湿性、降解性和孔隙率
不同SA质量分数复合海绵的溶胀性能如表1所示,可知,随着复合海绵中SA质量分数的增加,其吸水性能增加,PS0的吸水率为500%,而PS4的吸水率能达到1 400%。一方面,由于SA与PVA之间的氢键作用,破坏了PVA本身的作用力,使海绵的网络结构变得疏松,增加了对水分的吸收;另一方面,SA含有大量的羧基和羟基,提高了海绵的吸水性能。作为医用敷料而言,良好的吸水性可以使敷料迅速吸收渗出液,所制备的复合海绵有良好的溶胀性能,能够短时间内吸收大量液体,在促进高渗出性伤口的愈合方面有一定应用潜能[23]。表2为样品的保水性变化曲线,可知,随着复合海绵中SA质量分数的增加,海绵的保水性增加,原因可能是SA中含有大量的亲水基团,增加了海绵的润湿性和亲水性,容易与水分结合,从而防止水分的蒸发。湿润的环境可以提高伤口处细胞的迁移,从而加速伤口痊愈的过程。
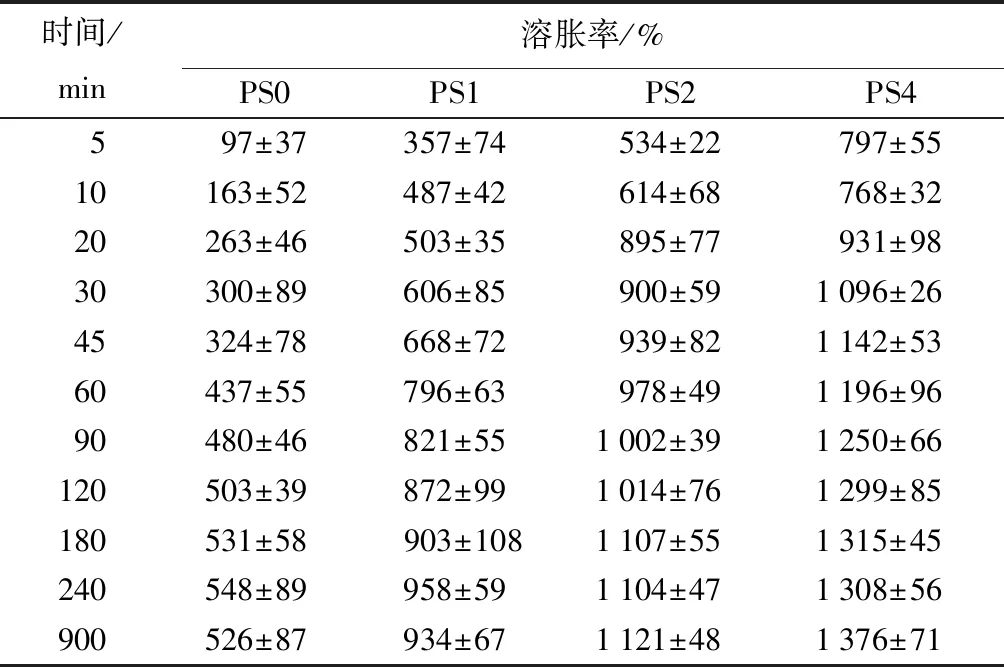
表1 样品的溶胀率
不同SA质量分数复合海绵的降解性能如表3所示,可知,随着SA质量分数的增加,复合海绵的降解率呈递增趋势。第14天,PS0、PS1、PS2和PS4的降解率分别为31.7%、34.5%、37.8%和41.5%。其原因可能是PVA本身存在分子内作用力,SA的加入降低了复合海绵内部的氢键作用力,使得海绵的降解率增加。同时,海绵的降解速度缓慢,能够保证海绵敷料在使用过程中的稳定性。不同SA质量分数复合海绵的孔隙率如表4所示,可知,随着SA质量分数的增加,复合海绵的孔隙率呈递增趋势。PS0、PS1、PS2及PS4的孔隙率分别为82.6%、87.4%、92%和95.1%。高孔隙率的敷料具有疏松多孔的结构,有助于吸收伤口处的渗出液。此外,表面多孔的结构利于营养物质的分散,使细胞更好的附着生长,从而加速伤口的愈合[24]。
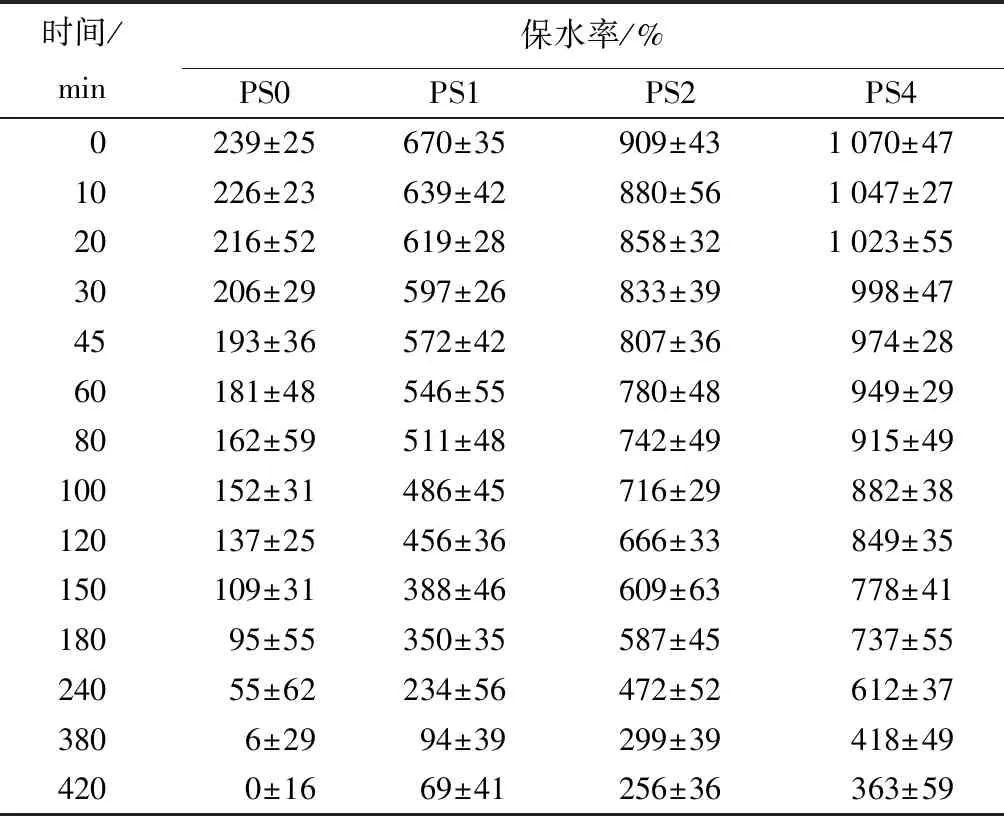
表2 样品的保水率
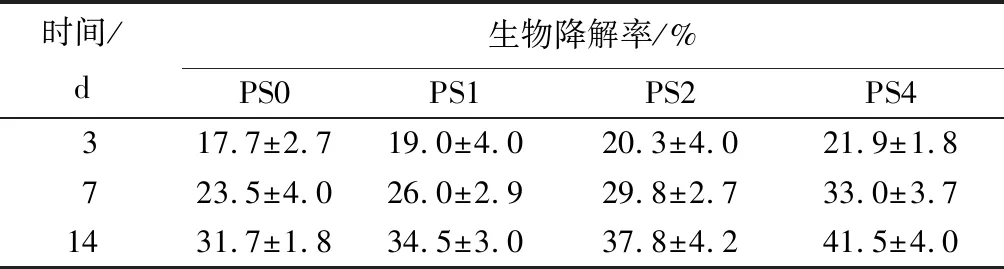
表3 样品的生物降解率
2.3 SA-PVA复合海绵的生物相容性
复合海绵的溶血率结果如表5所示,可知,PS0、PS1、PS2、PS4的溶血率分别为1.49%、1.42%、1.17%和0.63%,溶血指数均低于极限值5%[25]。这可能归因于海绵的制备过程中没有使用任何有毒的化学试剂,PVA和SA都具有良好的亲水性和生物相容性,说明制备的复合海绵属于非溶血性材料,可用作伤口敷料。
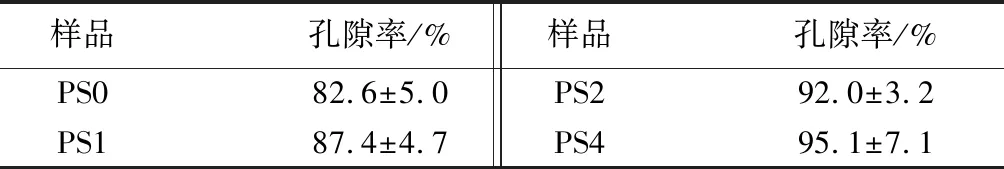
表4 样品的孔隙率
表6反应了3个时间点的CCK-8测试结果。可知,不同SA质量分数的复合海绵的细胞存活率均在90%以上。结果表明,该复合海绵无毒性。图4是NIH 3T3细胞在与PS0和PS2的浸提液共培养后细胞的生长情况。24 h时,样品与空白组中均有少量的贴壁细胞,随着时间的延长,细胞开始迅速增殖;48 h时,细胞大量增殖;72 h时,可见大量细胞密集生长,且生长趋势良好。结果表明,该复合海绵具有良好的生物相容性,可用作促进伤口愈合的敷料。

表5 样品的溶血率
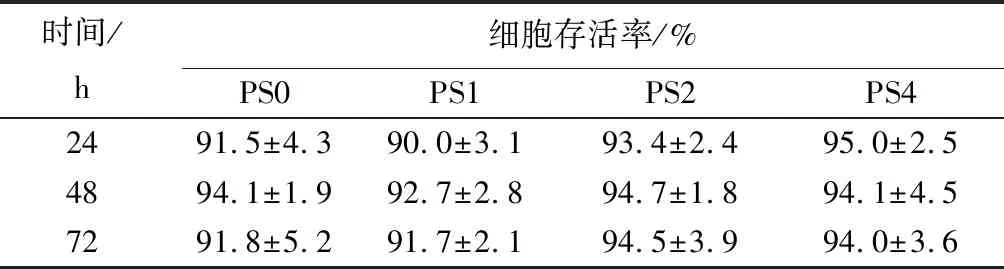
表6 NIH 3T3细胞在样品中培养不同时间时的细胞存活率
2.4 动物实验结果
小鼠在手术当天及术后第5天、第15天、第20天的伤口愈合照片及伤口愈合率分别如图5和表7所示。可知,与纱布对照组相比,PS2和PS2-NFX均能对伤口愈合起到促进作用,而经纱布组处理的伤口处的再生皮肤有明显的疤痕。这可能归因于纱布不能为伤口提供潮湿的环境,干燥结痂阻碍了细胞迁移。而海绵敷料在湿润时,与人体皮肤有相近的柔软性,利于细胞的生长迁移,从而加速伤口愈合。而与PS2相比,PS2-NFX组在创伤愈合方面的治疗效果更优。原因可能是湿润的环境下细菌易生长,使伤口感染,而PS2-NFX可以有效地阻止细菌滋生,避免伤口细菌感染,促进伤口愈合[26]。由表7可知,在第20天时,用PS2-NFX组处理的伤口显示84%的愈合率,高于其他两组,原因可能是NFX具有良好的抗菌性,可有效降低伤口感染的机率,加速伤口愈合。综上所述,制备的PS2-NFX伤口敷料可有效促进伤口愈合并减少疤痕形成。
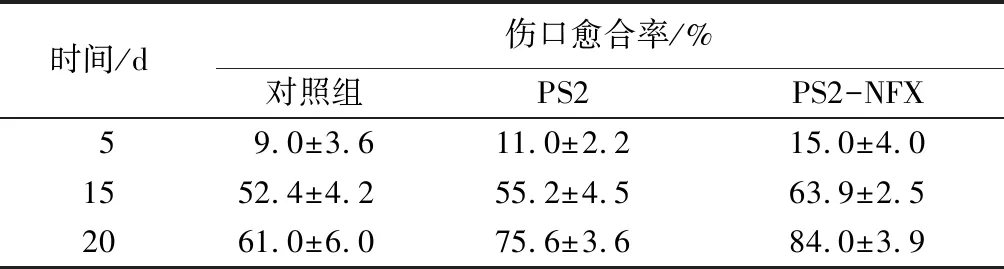
表7 小鼠皮肤经样品治疗后的伤口愈合率
3 结论
本研究成功制备了SA-PVA复合海绵,并对其形态学、吸水性、保水性及降解性等进行了测试。结果显示,所制备的复合海绵呈三维网络结构,且适宜的孔径有利于成纤维细胞的生长,具有促进细胞生长的孔隙率,具有维持创面水分平衡的吸水性和保水性。同时,SA-PVA复合海绵的降解速度缓慢,能够保证海绵敷料在使用过程中的稳定性,从而利于受伤部位的皮肤组织愈合,为其作为伤口敷料创造了条件。SA-PVA复合海绵的生物相容性测试结果显示该敷料是一种无溶血性材料,具有良好的生物相容性。体内伤口愈合实验表明,PS2-NFX可以加速伤口愈合过程。结果显示,制备的伤口敷料在伤口愈合方面具有一定的潜能应用价值。

