应用阿米卡星时不同剂量溶媒对老年患者血药浓度及肾功能的影响▲
崔玉娟 屠春林 楚亚萍 余艳芳
(上海健康医学院附属嘉定区中心医院呼吸科,上海市 201800,电子邮箱:1713229257@qq.com;2 山东省临沂市肿瘤医院内科,临沂市 276000)
氨基糖苷类抗生素是一种土壤放线菌产生的抗菌药物,是最早使用的抗生素之一,其具有较广的抗菌谱,主要用于革兰阴性菌及对青霉素耐药的金黄色葡萄球菌感染的治疗。目前革兰阴性菌耐药性问题日趋严重,历年中国细菌耐药监测网的细菌耐药性监测结果显示,肺炎克雷伯菌对亚胺培南和美罗培南的耐药率分别从2005年的3.0%和2.9%上升到了2017年的20.9%和24.0%,耐药率上升近8倍,而2017年其对阿米卡星的耐药率仅为14.1%;2017年铜绿假单胞菌对亚胺培南和美罗培南的耐药率分别为23.6%和20.9%,而对阿米卡星的耐药率仅为6.1%[1]。因此,氨基糖苷类抗生素可作为治疗耐药革兰阴性菌感染的初始抗生素选择。但这类药物较容易出现肾毒性,在应用过程中,应该尽量避免或减少引起肾功能损害的危险因素,如每日给药频次>1次、合并使用非甾体抗炎药、利尿剂、环孢素、顺铂等均为肾毒性的独立危险因素[2]。目前研究证实,每天1次的给药方式比每日多次的给药方式具有更好的临床疗效以及更低的不良反应发生率[3]。在药物溶质及溶媒剂量方面,法国传染病学会最新公布的氨基糖苷类使用指南指出,阿米卡星推荐使用剂量为15~30 mg/(kg·d),采用每天1次的给药方式,且必须在30 min内输注完成[4]。智利、波兰等国家目前常采用的溶媒剂量为100 mL生理盐水,30 min内静脉输注[5-6]。我国阿米卡星注射液说明书中成人药物用量为每12 h给药1次,7.5 mg/(kg·次),或每24 h给药1次,15 mg/(kg·次),每500 mg加入氯化钠注射液或5%葡萄糖注射液或其他灭菌稀释液100~200 mL,在30~60 min内缓慢滴注。目前,国内临床上存在一个误区,认为阿米卡星稀释后应用会降低肾功能损害的风险。国内数个地区,包括我院及本地区其他四家医院,临床常用剂量为400 mg或600 mg阿米卡星稀释于250 mL或500 mL生理盐水,1次/d,静滴时间通常>1 h[7-8]。因此,本研究探讨在相同静点速度下,不同剂量溶媒中阿米卡星的峰谷浓度变化及引起的肾功能损害情况,为促进临床合理应用阿米卡星提供参考。
1 资料与方法
1.1 临床资料 纳入2017年1月至2019年6月在呼吸内科住院的140例老年患者作为研究对象。入组标准:(1)确诊或推测为肠杆菌科、鲍曼不动杆菌、铜绿假单胞菌等革兰阴性菌感染,需要联用阿米卡星(联用药物包括但不仅限于喹诺酮类、碳青霉烯类或β-内酰胺类等抗菌药物)治疗的患者;(2)性别不限,年龄≥65岁。排除标准:(1)对氨基糖苷类抗生素过敏者;(2)应用时间小于4 d;(3)治疗前已存在肾功能损害的患者(肌酐值高于正常值上线);(4)有癫痫发作病史和中枢神经系统急性病变史者,或可能影响到方案依从性的精神病患者,或有自杀危险者,或有酒精或违禁药物滥用史者;(5)患者依从性差,无法及时采血;(6)结合症状、体征及既往病史,判断其培养出或怀疑感染的革兰阴性菌为定植菌;(7)研究者认为可能存在伤害受试者或干扰临床试验结果的任何情况;(8)应用具有肾毒性的药物者,如非甾体类抗炎药及解热镇痛药(包括布洛芬、对乙酰氨基酚、阿司匹林等)、袢利尿剂(如呋塞米、螺内酯等)、血管紧张素受体拮抗剂(包括缬沙坦、厄贝沙坦等)、血管紧张素转换酶抑制剂(以卡托普利多见)等。本研究经医院医学伦理委员会批准,在试验开始之前,患者或其法定代理人自愿签署经医学伦理委员会批准的知情同意书。
1.2 研究方法
1.2.1 收集资料:记录患者基线资料,包括性别、年龄、体重、疾病诊断。
1.2.2 制定给药方案:根据患者的血肌酐清除率制定阿米卡星给药方案,即血肌酐清除率≥80 mL/min、血肌酐清除率为40~79 mL/min时分别给予0.4 g/d、0.6 g/d的阿米卡星。共80例患者使用0.4 g阿米卡星,60例使用0.6 g阿米卡星。采用区组随机化分组分法进行分组,其中“生理盐水100 mL+阿米卡星0.4 g”方案组(A组)40例,“生理盐水250 mL+阿米卡星0.4 g”方案组(B组)40例;“生理盐水150 mL+阿米卡星0.6 g”方案组(C组)30例,“生理盐水250 mL+阿米卡星0.6 g”方案组(D组)30例。均静脉滴注,静滴速度为60滴/min,1次/d。
1.2.3 阿米卡星血药浓度检测:分别于第3天用药结束后0.5 h以及第4天用药前0.5 h(两次用药间隔时间为12 h)采血检测阿米卡星血药峰浓度(Cmax)、血药谷浓度(Cmin)。于静脉滴注对侧上肢,使用一次性采血针及一次性负压采血管抽取血液2~3 mL,使用17R高速可控温离心机离心(3 500 r/min,10 min)后取上层血清并放置于超低温冰箱(-80℃)保存,及时采用高效液相色谱串联质谱法进行检测。
1.2.4 肾功能监测:于治疗前、治疗第4天用药前0.5 h,检测血清肌酐、胱抑素C水平。采血部位及器械同1.2.3,采血管抽取血液2~3 mL,使用17R高速可控温离心机离心(3 000 r/min,15 min)后取上层血清待检,采用雅培C16000生化仪器进行检测。本研究中,将患者治疗第4天用药前0.5 h的血清肌酐值较用药前增加≥50%和(或)肌酐值高于正常值上限(106 μmol/L),且无法用其他原因解释者判定为肾功能损害。
1.3 统计学分析 用SPSS 24.0软件进行统计分析。计量资料以(x±s)表示,方差齐时两组间比较采用两样本独立t检验,方差不齐时则采用t′检验,组内比较采用配对t检验;计数资料以例数(百分比)表示,组间比较采用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结 果
2.1 患者基线资料的比较 A组与B组患者之间、C组与D组患者之间的年龄、性别、原发疾病、疗程等基线资料比较,差异均无统计学意义(均P>0.05), 具有可比性,见表1和表2。
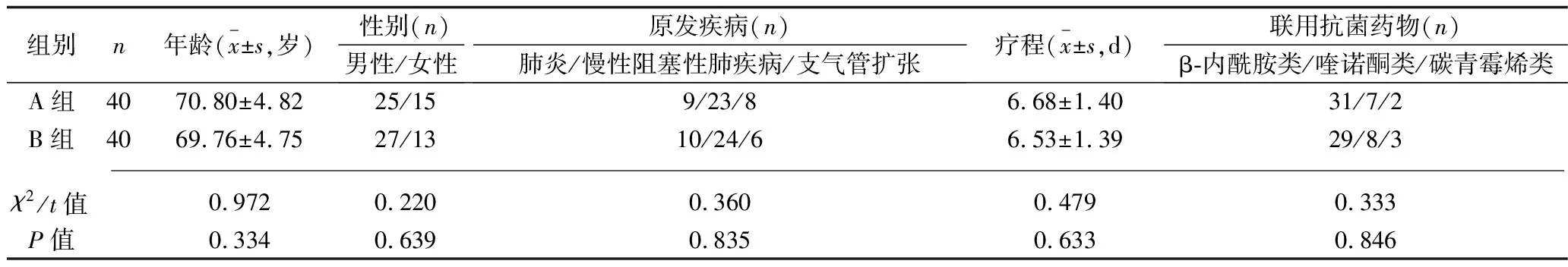
表1 A组与B组基线资料的比较
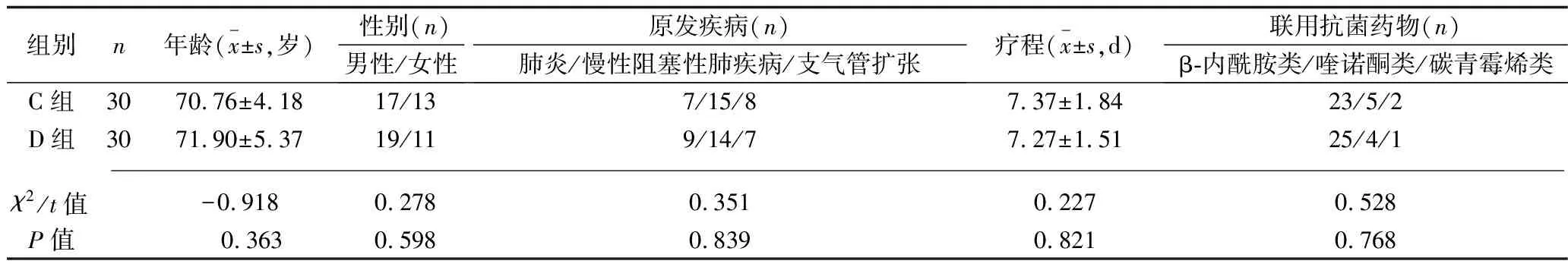
表2 C组与D组基线资料的比较
2.2 A组与B组治疗前后肾功能指标及阿米卡星血药浓度的比较 A组治疗前后的血清肌酐水平差异无统计学意义(P>0.05);治疗后,两组的胱抑素C水平、B组的血清肌酐水平均较治疗前升高,且B组的胱抑素C水平高于A组,而两组的血清肌酐水平、肾功能损害发生率差异均无统计学意义(均P>0.05), 见表3。 两组的阿米卡星Cmin均低于5 mg/L,但两组间的阿米卡星Cmax和Cmin差异均无统计学意义(均P>0.05),见表4。
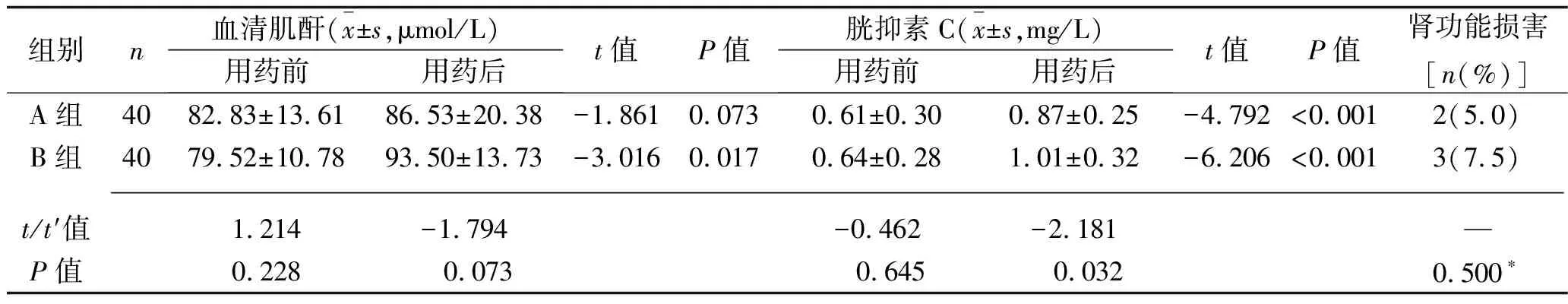
表3 A组与B组治疗前后肾功能指标及肾功能损害发生情况的比较
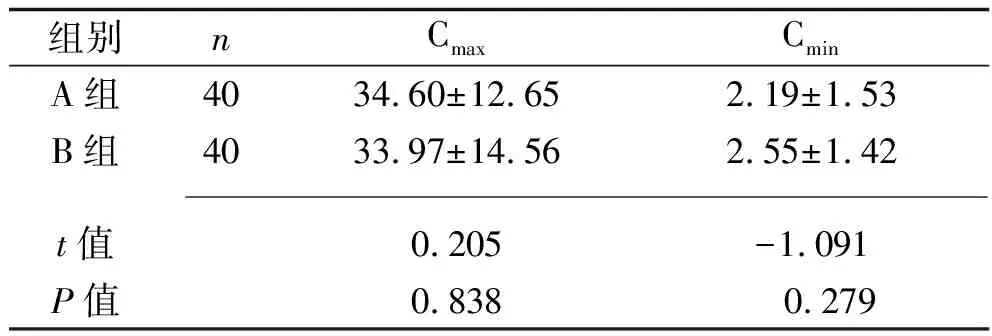
表4 A组和B组阿米卡星血药浓度的比较(x±s,mg/L)
2.3 C组与D组治疗前后肾功能指标及阿米卡星血药浓度的比较 C组治疗前后的血清肌酐水平差异无统计学意义(P>0.05);治疗后,两组的胱抑素C水平、D组的血清肌酐水平均较治疗前升高,且D组的血清肌酐和胱抑素C水平均高于C组(均P<0.05),而两组的肾功能损害发生率差异均无统计学意义(均P>0.05),见表5。C组有1例阿米卡星Cmin高于5 mg/L,D组有2例阿米卡星Cmin高于5 mg/L,但两组间的阿米卡星Cmax和Cmin差异均无统计学意义(均P>0.05),见表6。
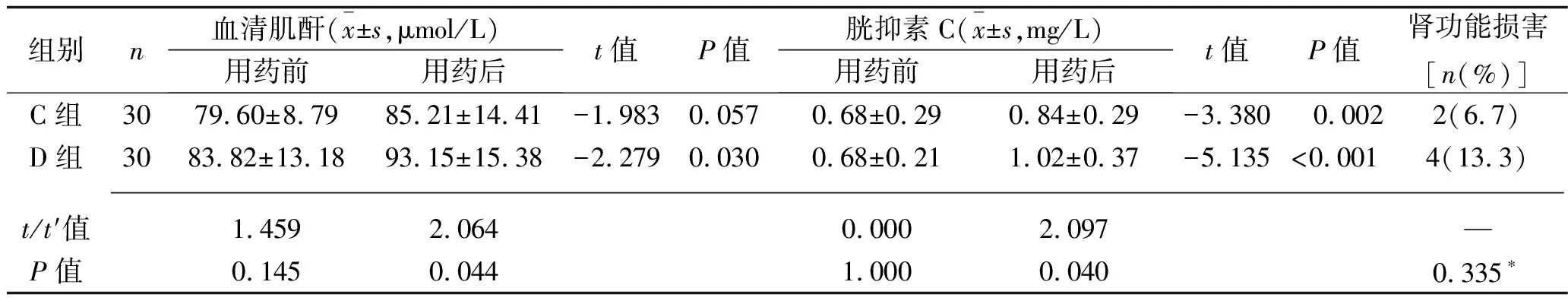
表5 C组与D组治疗前后肾功能指标及肾功能损害发生情况的比较
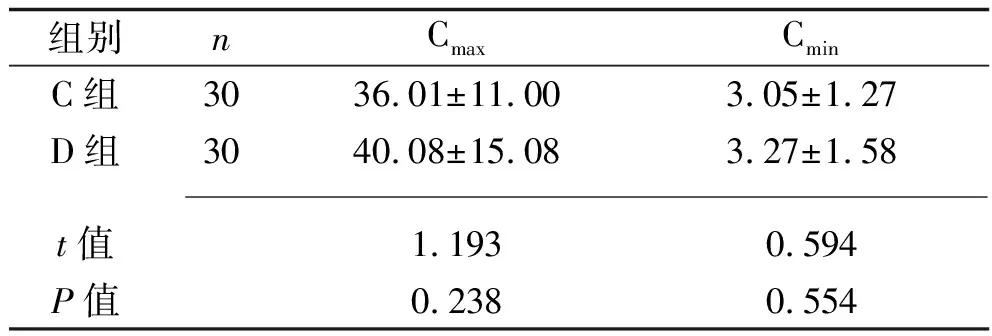
表6 C组和D组阿米卡星血药浓度的比较(x±s,mg/L)
3 讨 论
氨基糖苷类抗生素作为一类浓度依赖性杀菌剂,抗生素后效应明显[9],国外荟萃分析表明氨基糖苷类药物每日1次的给药方案临床疗效要高于每日多次给药,但肾毒性风险无明显差异[10]。因此,目前国内外临床上多选择每日1次的给药方案。 本研究采用国内最常用的“0.4 g”和“0.6 g”方案,即使用0.4 g阿米卡星+100 mL(250 mL)生理盐水以及0.6 g阿米卡星+150 mL(250 mL)生理盐水,1次/d,即按照60 kg体重计算,分别相当于采用10 mg/(kg·d)和6.6 mg/(kg·d)的剂量,这与国外的给药方案[15~30 mg/(kg·d)]有所不同。前期研究表明,在应用氨基糖苷类抗生素时,年龄≥80岁、疗程>5 d、合并使用呋塞米、合并使用血管紧张素转化酶抑制剂/血管紧张素受体拮抗剂、给药频次增多均为患者发生肾功能损害的危险因素[11]。尤其是老年人,随着年龄增长,其肾脏血管硬化,肾小球血流量、滤过能力逐渐降低,导致肾脏清除功能降低[12]。此外,老年人合并心功能不全的比例较高,因此本次研究排除合并使用呋塞米、血管紧张素转化酶抑制剂/血管紧张素受体拮抗剂的老年患者,采用每天1次的给药方式。
阿米卡星的Cmax与抗菌活性直接相关,作为一类浓度依赖性抗生素,快速静脉滴注使血药浓度迅速上升,所能达到的峰浓度较匀速缓慢给药更高,因而抗菌作用更强,且能够减少药物在肾脏中潴留,降低肾毒性发生的可能[13]。快速静滴降低肾毒性的理论依据为:氨基糖苷类抗生素的肾毒性主要集中在近端肾小管上皮细胞,当药物迅速达到峰浓度后,上皮细胞摄取药物的能力达到饱和,大量药物通过上皮细胞被分泌出来,24 h作用于细胞的药物总量就非常小,故而肾脏毒性下降[14]。本研究中,各组均采用60滴/min的滴速,A组与B组之间、C组与D组之间阿米卡星的Cmax比较,差异均无统计学意义(均P>0.05)。
阿米卡星的Cmin是导致肾毒性的主要指标,其高低可能与药物在体内的积蓄程度有关,随着Cmin升高,药物在体内的消除减慢,对肾、耳损伤增大[15]。其发生机制为:肾小管上皮细胞通过胞饮作用将阿米卡星主动转运到细胞中,导致细胞坏死和凋亡;与此同时,阿米卡星可导致肾脏血流量下降并引起肾小球滤过率降低[16]。在研究每日一次的给药方案时,谷浓度目标范围通常设置为小于5 mg/mL。在本研究中A组与B组的阿米卡星Cmin均低于5 mg/L,而C组、D组各有1例、2例阿米卡星Cmin高于5 mg/L,但A组与B组之间、C组与D组之间的阿米卡星Cmin差异均无统计学意义(均P>0.05)。
在临床应用过程中,尽早发现肾功能损害,有利于避免不良反应的发生。本次研究选用胱抑素C、肌酐值作为肾功能的评价指标。其中胱抑素C是由机体有核细胞产生,产生率恒定,不受炎性反应、胆红素、溶血、血脂等因素的影响,而且与性别、年龄、体重、饮食无关。此外,肾脏是胱抑素C唯一的滤过和代谢器官,因此其可作为反映肾小球滤过率的一种理想的内源性标志物,当肾小球出现轻微损伤时血中胱抑素C浓度即可出现升高,并随着病情的加重而逐渐升高,所以胱抑素C被公认为是反映早期肾损害的敏感标志物之一[17]。有研究证明,在阿米卡星应用过程中,胱抑素C是一个比肌酐值更准确的评估肾毒性的指标[18]。本研究结果显示,A组、C组治疗前后的血清肌酐水平虽较治疗前有升高,但差异并无统计学意义,且以治疗前后肌酐水平改变情况评估肾功能损害时,A组与B组之间、C组与D组之间的肾功能损害发生率差异亦无统计学意义(P>0.05)。而以胱抑素C进行评价时发现,治疗后4组的胱抑素C水平均较治疗前升高,且B组、D组的胱抑素C水平分别高于A组、C组(均P<0.05)。因此,临床应用氨基糖苷类药物时,应减少溶媒剂量,快速静滴,并监测肾功能损害的早期敏感指标胱抑素C,以减少肾功能损害的不良反应。
综上所述,对于老年患者,在应用阿米卡星时扩大溶媒剂量稀释用药,不能减轻肾功能损害,而且这有可能增加因入液量增多所导致的心衰的发生率。本研究虽然对阿米卡星血药浓度进行监测,但有一定的不足之处,如未根据血药浓度监测结果进一步调整阿米卡星药物剂量。下一步研究将依据结果调整给药剂量,制定个性化的给药方案。

