狼疮肾炎小鼠肾组织高迁移率族蛋白B1、Toll样受体、水通道蛋白的表达以及三七注射液的干预机制▲
唐 宇 黄志敏 吴金玉
(广西中医药大学第一附属医院风湿科,南宁市 530023,电子邮箱:521101154@qq.com)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种累及多器官、多系统并会产生自身抗体的自身免疫疾病,全球总发病率在1.4%~21.9%之间[1]。SLE对系统的损害中肾脏受累最为常见,狼疮肾炎是SLE最严重的并发症,也是患者死亡的主要原因,大约50%的SLE患者并发狼疮肾炎[2],其中超过25%的狼疮肾炎患者最终将发展至慢性肾衰竭[3]。免疫复合物介导的肾小球肾炎是狼疮肾炎的主要发病机制之一,因此,阻断免疫复合物在肾小球沉积,抑制肾小球肾炎的进展是治疗狼疮肾炎的关键。目前,西医治疗狼疮肾炎以激素、免疫抑制剂为主,必要时行肾脏替代治疗,尚缺乏理想的有效治疗手段。中医药防治狼疮肾炎成为医学领域的研究热点之一。研究表明,高迁移率族蛋白B1(high mobility group box protein 1,HMGB1)/Toll样受体(Toll-like receptor,TLR)信号通路在狼疮肾炎中发挥重要作用;水通道蛋白(aquaporin,AQP)在慢性肾衰竭发生发展中有重要作用[4]。尽管已经明确肾脏组织中存在TLR及AQP的表达,但目前国内外鲜见相关文献报告HMGB1/TLR信号调控AQP相互交叉对话在狼疮肾炎发病机制中的作用。本研究利用理想的狼疮肾炎模型-MRL-Faslpr小鼠,基于“瘀水互生”理论,探讨HMGB1/TLR信号调控AQP对狼疮肾炎发生的影响,并分析三七注射液干预狼疮肾炎的可能机制,现报告如下。
1 材料与方法
1.1 实验动物 11周龄雌性MRL-Faslpr小鼠15只,体重(192±32)g,购自南京大学模型动物研究所,动物合格证号:SCXK(苏)2017-0005。11周龄健康雄性清洁级小鼠5只,体重(200±36)g,购自湖南斯莱克景达实验动物有限公司,动物合格证号:SCXK(湘)2011-0003。 小鼠在广西中医药大学第一附属医院医学分子生物学实验室,室温18℃~25℃、 相对湿度50%~60%、人工12 h昼/夜循环照明环境中饲养,用全价营养饲料、分笼饲养, 每日定时清洗笼舍,小鼠能自由摄食及饮水。
1.2 主要的仪器、试剂和药物 兔抗TLR4抗体(货号:BA1717),兔抗TLR7抗体(货号:PB0473),兔抗HMGB1 抗体(货号:A00066-1),兔抗AQP1抗体(货号:PB0498),兔抗AQP2抗体(货号:bs-0261R),兔抗AQP3抗体(货号:BA1559),兔抗β-肌动蛋白(内参)抗体(货号:bs-0061R),均购自博士德生物工程有限公司;兔抗TLR9 抗体(Abcam公司,货号:ab52967),山羊抗兔的二抗(北京博奥森,货号:ZB2301),RIPA细胞裂解液、苯甲基磺酰氟(北京索莱宝公司,货号:R0020,P0100),蛋白浓度测定试剂盒(碧云天公司,货号:P0012S),TRIzol试剂(Invitrogen公司,目录编号:15596-026),TIANScript RT Kit(天根生物科技有限公司,目录编号: KR104-02),SuperReal PreMix Plus(SYBR Green)(天根生物科技有限公司,目录编号: FP205),氯仿、异丙醇、无水乙醇购自天津市永大化学试剂有限公司。荧光定量PCR仪(Applied Biosystems,型号ABI7500),DYCZ-24DN型电泳仪(北京六一公司),WSE-400型半干转膜仪(日本ATTO公司)。电泳系统(Mini-protien Tetra System,Bio-Rad公司),SNJ-1型凝胶成像仪(ChemiDoc XRS+ System,Bio-Rad公司)。
1.3 分组与给药 采用随机数字表法将15只MRL-Faslpr小鼠分为模型组、三七组、 HMGB1抗体组,每组5只。另取5只相同周龄清洁级小鼠为正常对照组。模型组、正常对照组分别予生理盐水10 mL/(kg·d)腹腔注射;三七组给予三七注射液(广西中医药大学第一附属医院制剂室生产,100 mL/瓶,含生药20 g/100 mL)2 g/(kg·d)腹腔注射; HMGB1抗体组给予HMG1/HMGB1单克隆抗体(艾美捷Abnova,货号:MAB8971)1 mg/(kg·d)腹腔注射。均1次/d,4组小鼠在连续给药6周后处死,摘除左肾,放入液氮保存以检测相关指标。
1.4 指标检测
1.4.1 肾组织HMGB1、TLR、AQP蛋白的检测:采用免疫印迹试验检测各组小鼠肾组织HMGB1、TLR4、TLR7、TLR9以及AQP1、AQP2、AQP3蛋白的表达水平。取30 mg肾组织,加入1 000 μL RIPA蛋白裂解液,充分混匀,裂解2~3 h,12 000 r/min离心20 min,将上清转移到新的离心管中。用考马斯亮蓝法蛋白浓度测定试剂盒测定样本蛋白浓度。将样品加入相应4×上样缓冲液,100℃煮沸10 min,12 000 r/min离心1 min,根据目的蛋白分子量大小配制不同浓度的十二烷基硫酸钠-聚丙烯酰胺凝胶,胶凝固后,上样蛋白以恒压80 V,30 min之后恒压120 V,1 h进行电泳。电泳结束后,将凝胶从玻板上取下,装配转膜三明治,以300 mA恒流转60 min,将蛋白转移到聚偏氟乙烯膜上。用封闭液(含5%脱脂奶粉的PBST溶液)室温封闭膜2 h;用新配制的封闭液稀释一抗,兔抗AQP1抗体、兔抗AQP2抗体、兔抗AQP3抗体、TLR4抗体、兔抗TLR7抗体、兔抗TLR9 抗体、兔抗HMGB1抗体、兔抗β-肌动蛋白抗体稀释比分别为1 ∶400、1 ∶500、1 ∶200、1 ∶200、1 ∶400、1 ∶1 000、1 ∶200、1 ∶1 000。4℃,一抗孵育过夜;用TBST洗膜3次,5 min/次;用封闭液稀释各蛋白一抗对应的二抗(兔二抗1 ∶1 000),室温下孵育二抗1 h。用TBST洗膜3次,5 min/次;在暗室中将膜置于平铺好的保鲜膜上,按1 ∶1比例混合A液和B液(ECL发光液,SC2048),将混合液均匀滴加于膜上,反应60 s。将膜放在吸水纸上沥干多余的ECL底物反应液,置于平板上,铺上保鲜膜,用保鲜膜包裹聚偏氟乙烯膜(避免产生气泡),放入暗盒,再放上适当大小的X光片,关闭暗盒,曝光。取出X光片,放入显影液中,待条带显好后取出,在清水中漂洗,放入定影液中定影。取出X光片,晾干、拍照。以β-肌动蛋白作为内参蛋白,计算目的蛋白的相对表达量。
1.4.2 肾组织HMGB1、TLR、AQP mRNA的检测:采用实时荧光PCR检测各组小鼠肾组织HMGB1、TLR4、TLR7、TLR9、AQP1、AQP2、AQP3 mRNA的表达。取30~100 mg肾组织,利用TRIzol试剂提取组织样本中总RNA,严格按照试剂盒步骤进行操作,取1 μL RNA用Denovix超微量紫外可见分光光度计(美国丹诺尔公司)检测RNA浓度和质量,取5 μL RNA 1%琼脂糖凝胶上进行电泳,以检测RNA的完整性。用TIANScript RT Kit 进行反转录,严格按照试剂盒步骤进行操作。获得cDNA后进行实时荧光PCR,以β-肌动蛋白为内参。PCR反应体系为20 μL,包括2×SuperReal PreMix Plus 10 μL、上游引物(10 μM)0.6 μL、下游引物(10 μM)0.6 μL、cDNA 100 ng、50×ROX Reference Dye△ 0.4 μL,加RNase-Free ddH2O至20 μL。PCR反应条件为95℃ 15 min,1个循环,95℃ 10 s、58℃ 30 s、72℃ 30 s,40个循环。整个反应在荧光定量PCR仪上进行,同时在60℃~95℃进行溶解曲线分析。 根据RT-PCR原始检测结果,按照2-ΔΔCt相对定量计算公式,计算出各样品的目的基因相对表达量结果。目的基因和内参基因引物见表1。

表1 基因引物
1.5 统计学分析 采用SPSS 17.0软件进行统计分析。计量资料以(x±s)表示,多组间比较采用单因素方差分析,两两比较采用Tukey HSD检验,方差不齐时采用非参数(Kruskal-Wallis)检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 4组肾组织HMGB1/TLR蛋白及mRNA表达量的比较 与正常对照组比较,模型组及两个给药组HMGB1、TLR4、TLR7、TLR9的蛋白及mRNA相对表达水平均升高(均P<0.05);与模型组比较,三七组与 HMGB1抗体组的HMGB1、TLR4、TLR7、TLR9的蛋白及mRNA表达量均降低(均P<0.05)。见表2、表3及图1。
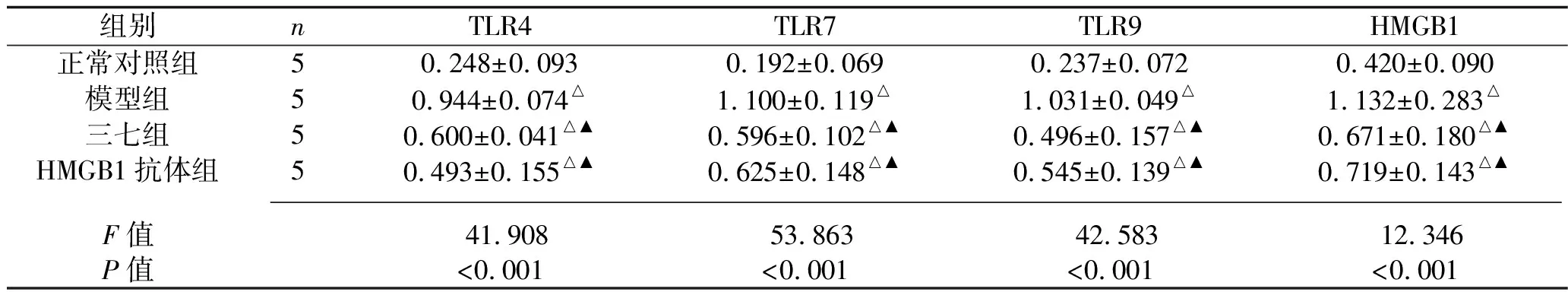
表2 4组小鼠肾组织HMGB1及TLR蛋白相对表达量的比较(x±s)

表3 4组小鼠肾组织HMGB1及TLRmRNA相对表达量的比较(x±s)

图1 各组肾组织TLR、HMGB1、AQP蛋白表达
2.2 4组肾组织AQP蛋白及mRNA表达量的比较 与正常对照组比较,模型组及两个给药组的AQP1、AQP2、AQP3的蛋白和mRNA表达量均升高(均P<0.05);与模型组比较,三七组与 HMGB1抗体组的AQP蛋白、mRNA水平均降低(均P<0.05)。见表4、表5及图1。

表4 4组小鼠肾组织AQP蛋白相对表达量的比较(x±s,n=5)

表5 4组小鼠肾组织AQPmRNA表达量的比较(x±s)
3 讨 论
狼疮肾炎属于中医学“水肿”“阴阳毒”“蝴蝶斑”“关格”“血症”等范畴。“肾虚”“湿阻”和“血瘀”为狼疮肾炎的主要病机[5],其中以“肾虚”为根本,内生水湿及瘀血加速了病情的进展,瘀血阻滞是其病理改变的关键环节[6],也是直接损害肾脏组织并促进病情发展的关键因素,水液代谢障碍是疾病最终结局。研究表明,AQP1、AQP2、AQP3与肾脏调节水重吸收功能密切相关,而中医理论的肾脏在水液代谢中的作用与AQP的生理特性极为相似,其中这可能是中医“肾主水”的物质基础[7]。因此,基于“瘀水互生”中医理论基础,我们分析狼疮肾炎小鼠肾组织HMGB1、TLR、AQP的表达,探讨狼疮肾炎的可能病理机制及三七注射液对HMGB1、TLR、AQP表达的影响。
HMGB1是一种参与细胞核内多种生物学功能的核内蛋白,通过与DNA结合以稳定核小体,参加 DNA 转录、复制、基因表达与调控等多种生命活动。HMGB1与TLR结合能诱导树突状细胞的成熟,产生细胞因子和趋化因子,而且成熟的树突状细胞表面共同刺激分子能提供“第二信号”给T淋巴细胞,诱导免疫反应,并通过激活多种信号转导途径而参与SLE所致的肾脏损害[8-11]。其中TLR4、TLR7、TLR9与SLE的疾病进展密切相关,TLR的活化导致前炎性因子表达增加,其可能可以反映狼疮肾炎疾病的严重程度[12-13]。Patole等[14]发现狼疮肾炎小鼠浸润巨噬细胞的肾组织TLR9表达明显增加,TLR9的活化与狼疮肾炎进展相关;Ehlers等[15]研究发现TLR9的活化能促进IgG2a和IgG2b抗体识别宿主产生的DNA,从而进一步加重SLE的发展;而Pacheco等[16]发现,TLR7基因拷贝数变异和TLR7 mRNA水平增加是女性SLE进展的危险因素。TLR7与其配体之间的相互作用可以直接激活树突状细胞和B细胞,从而扩大T细胞和B细胞识别自身特异性抗原效应,进一步加重SLE免疫反应[15]。有研究显示,TLR4过度表达可以导致自身免疫性肾小球肾炎和狼疮肾炎[16-17]。本研究研究结果提示,狼疮肾炎小鼠肾组织中TLR4、TLR7、TLR9、HMGB1蛋白表达水平均升高(P<0.05),与上述研究结果相似,提示HMGB1/TLR通路与狼疮肾炎的发生密切相关。
AQP是近年来发现的一类与体液代谢关系密切的蛋白,是一族位于细胞膜上的特异性水转运结构,与水通透性(吸收、分泌、转运)密切相关,能维持细胞内外水平衡。现已明确在肾组织中存在8种AQP,即AQP1~4、AQP6~8和AQP11,其中AQP1~3与肾脏调节水重吸收功能密切相关[17-19]。AQP1特异性表达于肾近曲小管和髓袢降支细段[20],参与水的跨膜转运及水平衡调节,对水的转运具有高度选择性,AQP1缺乏会导致肾小管重吸收功能障碍[21];AQP2主要分布于集合管主细胞管腔膜及细胞内囊泡,其表达水平及穿梭调节与集合管处水重吸收量的调节密切相关[22]。AQP3在肾间质和肾小球周围的表达疑似沉积的AQP3免疫复合物,AQP3是否 作为自身抗原参与了免疫发病机制,还有待进一步研究[23]。本研究结果显示,狼疮肾炎小鼠AQP1、AQP2、AQP3蛋白表达升高,即狼疮肾炎状态下AQP表达活跃,提示AQP表达上调可能与狼疮肾炎相关。
HMGB1/TLR信号通路是调控各种炎症反应和免疫反应的重要通路,能够参与SLE的肾脏损害,抑制该通路的表达能延缓狼疮肾炎的疾病进展。本研究建立了HMGB1抗体组,给予狼疮肾炎小鼠注射HMG1/HMGB1单克隆抗体,抑制了狼疮肾炎小鼠肾组织HMGB1的表达,结果显示其肾组织TLR4、TLR7、TLR9、AQP1、AQP2、AQP3 的蛋白及mRNA表达也随之下调。因此,我们推测HMGB1/TLR信号调控AQP表达可能是狼疮肾炎小鼠发病的机制之一。
目前,研究表明,三七注射液能下调整合素连接激酶、基质金属蛋白酶-7、转化生长因子-β1、P38丝裂原活化蛋白激酶水平,同时可下调Smad3蛋白、TLR1、TLR2蛋白表达的水平,上调Smad7蛋白的表达水平,抑制肾小管上皮细胞转分化及转化生长因子-β1/P38丝裂原活化蛋白激酶信号通路活化,干预Smad蛋白介导的细胞内信号转导,调节补体-炎症受体系统,实现抗肾纤维化,从而达到缓解慢性肾炎发展到肾衰竭的进程[24-27],但三七注射液能否通过HMGB1/TLR信号通路降低AQP蛋白表达,达到延缓狼疮肾炎进展的目的目前还尚未清楚。因此,本研究使用三七注射液干预狼疮肾炎小鼠,观察三七注射液对HMGB1/TLR信号通路中的关键蛋白和AQP蛋白表达水平的影响,进一步分析三七注射液在治疗狼疮肾炎中的作用机制。结果显示三七组小鼠肾组织中HMGB1、TLR4、TLR7、TLR9、AQP1、AQP2、AQP3 的蛋白及mRNA表达水平均较模型组降低。因此,我们推测三七注射液可能是通过下调HMGB1/TLR信号通路表达水平,降低AQP蛋白的表达水平,来实现治疗狼疮肾炎和延缓狼疮肾炎疾病进展的目的。
综上所述,狼疮肾炎小鼠肾组织的TLR4、TLR7、TLR9、HMGB1、AQP表达水平均升高,HMGB1/TLR信号调控AQP表达可能是狼疮肾炎的发生机制之一;三七注射液可能通过干预HMGB1/TLR信号调控AQP表达发挥治疗狼疮肾炎的作用。

