新品种紫辣椒和紫豇豆果皮花色苷含量测定
谢 倩,阳晓婷,杨 薇,李佳楠
(江汉大学 生命科学学院生物技术系,湖北 武汉 430056)
植物体内的色素使其呈现出绚丽缤纷的色彩,植物色素在植物中分布极为广泛,花色苷是一种天然的水溶性色素,主要存在于植物的花、叶和果实中,属于黄酮类的化合物[1−2]。花色苷是一种配糖体,其以花青素作为配基,以糖苷键的方式与各种不同的糖类结合[3],属于花青素的衍生物。花青素极不稳定,因此在植物中的主要存在形式是配糖体形式的花色苷,花色苷不仅可以使植物呈现出红色、紫色和蓝色等鲜艳的色彩,而且花色苷还具有抗氧化[4]、抗炎症[5]和抗突变抗肿瘤[6]等生理功能,因此近年来市场上花色苷类的保健品也备受大众青睐。
辣椒和豇豆是日常烹饪中不可缺少的蔬菜,在人们的饮食中占据极大的比重,随着人们生活水平的不断提高,人们对饮食的要求也不再仅仅是裹腹,而是开始进一步追求食物的营养和保健功能,而花色苷作为具有生物功能的天然植物色素开始受到人们的青睐。相关研究[7]表明,紫色植物的花色苷含量远远大于绿色植物的花色苷含量,因此培育深色蔬菜或有助于选育出富含大量花色苷的蔬菜品种。本文通过测定新品种紫色辣椒皮和紫色豇豆皮的花色苷含量,为今后选育出高花色苷含量的优良品种提供实验依据。
1 材料与方法
1.1 材料与仪器
紫辣椒、紫豇豆;氯化钾、醋酸钠、盐酸、95%乙醇等均为国产分析纯;实验用水均为纯水;pH计,恒温水浴锅,分析天平,离心机,全波长酶标仪。
1.2 方法
1.2.1 紫色蔬菜样品的选取 2019 年6 月在湖北省豆类(蔬菜)植物工程技术研究中心选取了3 株果实形态良好的紫辣椒株系,分别为紫辣椒11−2−1、江大紫辣椒1 号、江大紫辣椒2 号,见图1,其中紫辣椒11−2−1 为亲本,江大紫辣椒1 号与江大紫辣椒2 号为培育的子代新品种;同时选取了 10 株果实形态良好的紫豇豆株系,分别为 JD0152、JD0140、JD0115、JD0312、JD0567、JD0169、JD0821、JD0170、JD0827、JD0138,见图 2;以上材料均采其成熟期的果实。

图1 3 种新品种紫辣椒Fig.1 3 new varieties of purple pepper

图2 10 种新品种紫豇豆Fig.2 10 new varieties of purple cowpea
1.2.2 紫色蔬菜花色苷的提取 取紫色辣椒和紫色豇豆的成熟果实,洗净,小心刮去果肉,取皮备用;称取2 g 紫色果实皮于研钵中,研磨,按1∶20 g/mL 料液比加入40 mL 0.1%HCl 酸化的70%乙醇,水浴锅40 ℃浸提1 h,8 000 r/min 离心10 min,残渣再另加提取溶剂,重复操作2 次,洗提残渣至无色,合并 3 次上清液,得总花色苷提取液V(mL)[8]。
1.2.3 缓冲液的制备[9]pH 1.0 缓冲液的配制:称取1.86 g KCl 于烧杯中,加入适量纯水溶解稀释,用 12 mol/L 盐酸调整 pH 至(1.0 ± 0.05),转移至 1 000 mL 容量瓶中,用纯水定容至刻度,混匀储存备用。
pH 4.5 缓冲液的配制:称取54.43 g 三水合醋酸钠于烧杯中,加入适量纯水溶解稀释,用12 mol/L 盐酸调整 pH 至(4.5 ± 0.05),转移至 1 000 mL 容量瓶中,用纯水定容至刻度,混匀储存备用。
1.2.4 经验公式的选取 花色苷的分子结构会随pH 值的不同而发生变化,与此同时其吸光值也会随之改变,而具有干扰作用的物质不随pH 值而变。当pH = 1.0 时,花色苷以红色的2−苯基苯并吡喃阳离子(即氧鎓离子)的形式存在,当pH = 4.5 时,花色苷的存在形式转变为无色的查尔酮[10];pH 1.0 和pH 4.5 之间有着最大的吸光度差值,能较准确地反映出花色苷的含量,因此果蔬提取物中花色苷的含量可以采用pH 示差法来进行测定,再根据Fuleki T 公式即可计算出花色苷含量(C),即
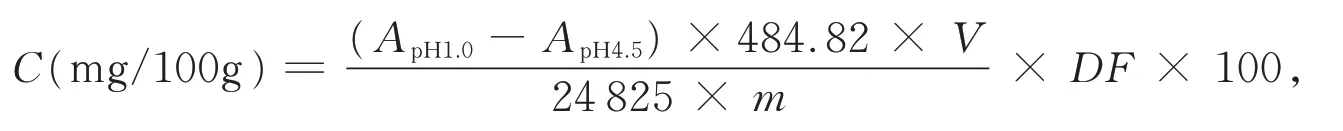
式中,ApH1.0、ApH4.5:pH 为 1.0 和 4.5 时最大吸收波长下的吸光值;484.82:矢车菊素−3−葡萄糖苷的分子量;24 825:矢车菊素−3−葡萄糖苷的摩尔吸光系数;DF:稀释倍数;V:花色苷提取液体积(mL);m:称取的紫色蔬菜果皮质量(g)。
2 结果与分析
2.1 紫色蔬菜最大吸收波长的测定
取1 mL 的澄清总花色苷提取液用pH 1.0 的溶液稀释DF倍,另取1 mL 提取液用pH 4.5 的溶剂稀释DF倍,充分混匀,用移液枪精密量取13 组供试溶液,以每孔200 μL 的体积分别加于酶标板中,每种样品各设3 个平行孔,使用酶标仪在300 ~800 nm 的波长范围内进行光谱扫描,扫描结果见图3与图4。结果显示紫辣椒的最大吸收波长为533 nm,紫豇豆的最大吸收波长为517 nm。

图3 紫辣椒花色苷最大吸收波长Fig.3 Maximum absorption wavelength of anthocyanin in purple peppers

图4 紫豇豆花色苷最大吸收波长Fig.4 Maximum absorption wavelength of anthocyanin in purple cowpeas
2.2 紫色蔬菜平衡时间的测定
样品提取液在缓冲液中的平衡状态会因时间而发生变化,为了确定最佳平衡时间,在最大吸收波长下,将样品用pH 1.0 和pH 4.5 的缓冲液稀释,用酶标仪每隔10 min 检测一次吸光值[11],参照吸光值的变化趋势,确定样品提取液在缓冲液最佳的平衡时间,结果见表1 和表2。由表1和表2 可知,在缓冲液的pH 为1.0 时,随着时间的延长花色苷的吸光值逐渐增加,在缓冲液的pH 为4.5 时,随着时间的延长花色苷吸光值逐步减小,综合花色苷在两种缓冲体系中的平衡时间,确定紫辣椒花色苷的平衡时间为100 min,紫豇豆花色苷的平衡时间为80 min。
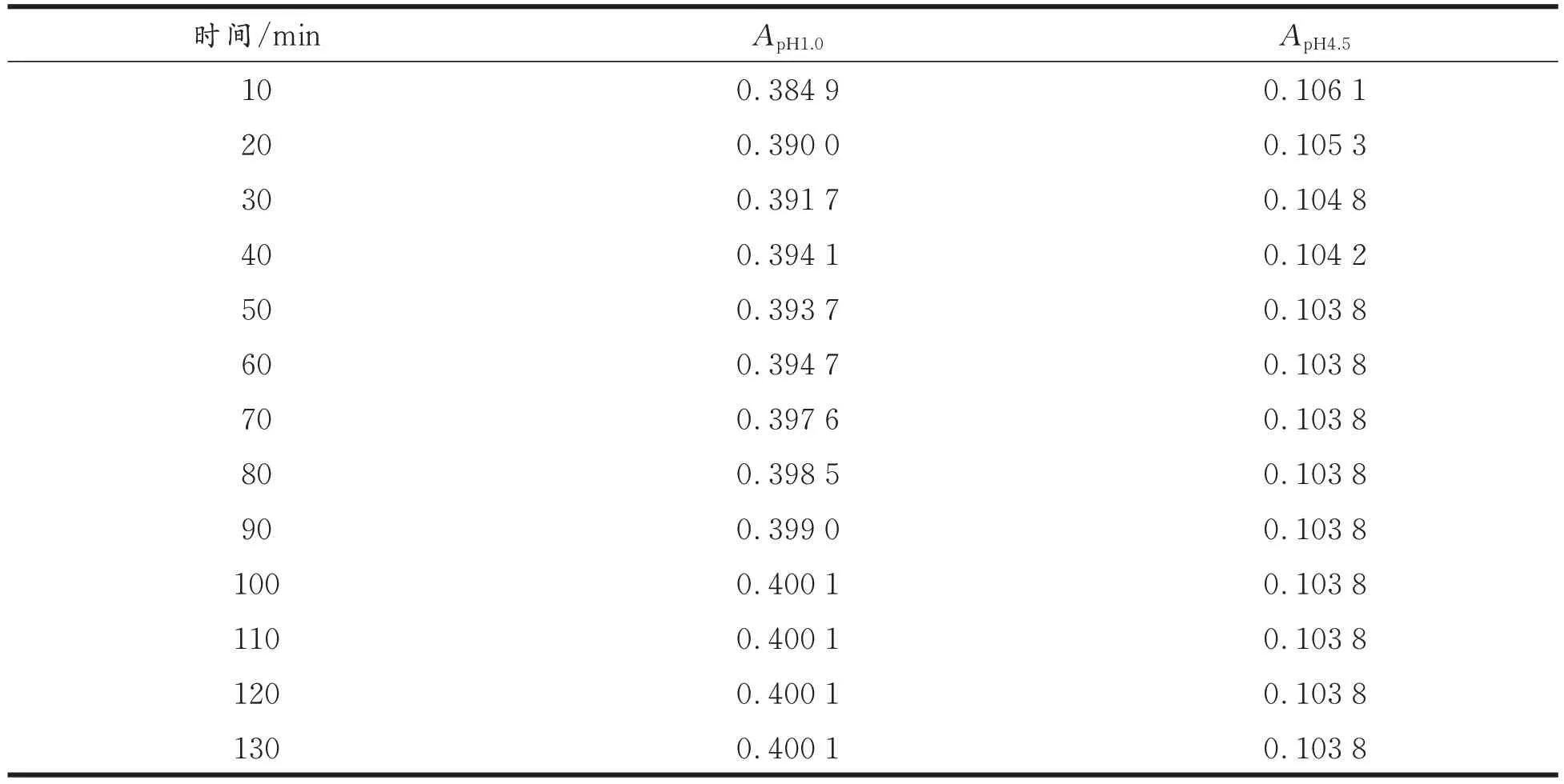
表1 紫辣椒花色苷吸光值Tab.1 Absorption value of anthocyanin in purple peppers
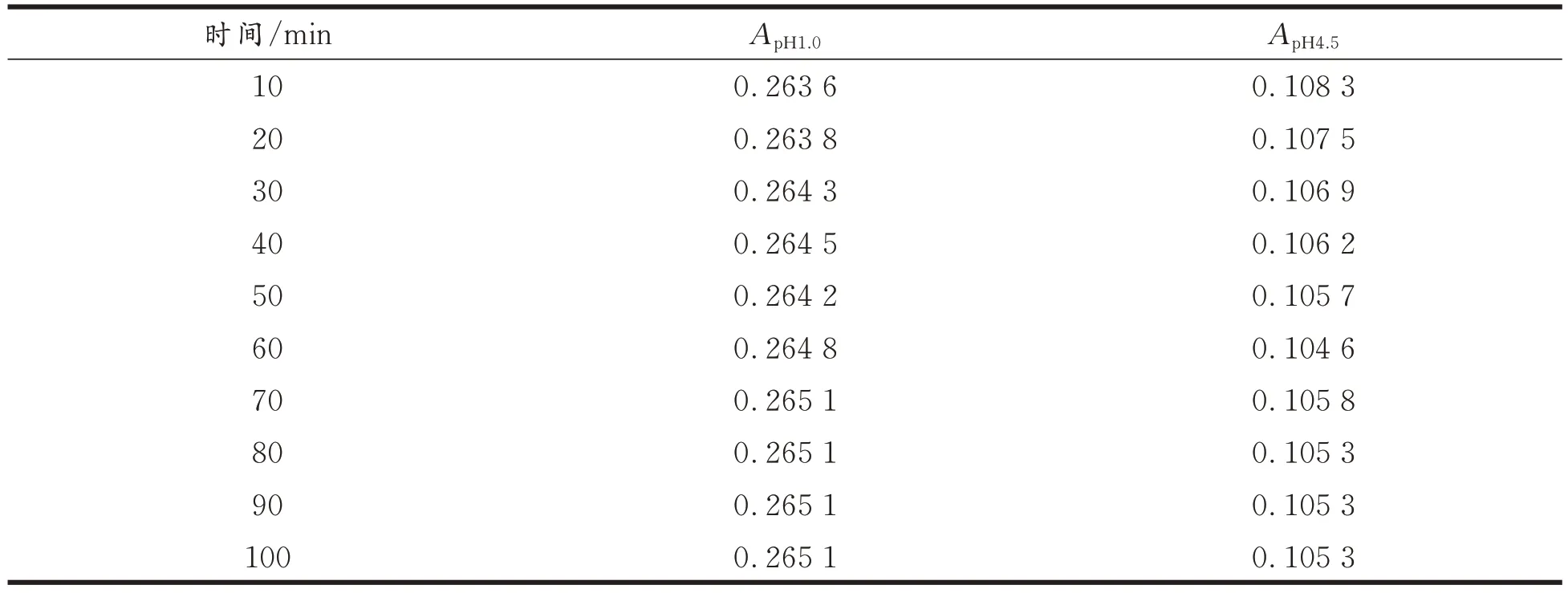
表2 紫豇豆花色苷吸光值Tab.2 Absorption value of anthocyanin in purple cowpeas
2.3 紫色蔬菜总花色苷含量的测定
取花色苷提取液,分别用pH 1.0 和pH 4.5 的缓冲液稀释,待达到平衡时间后,在最大吸收波长下测定吸光值,根据Fuleki T 公式计算得到花色苷含量,见图5。
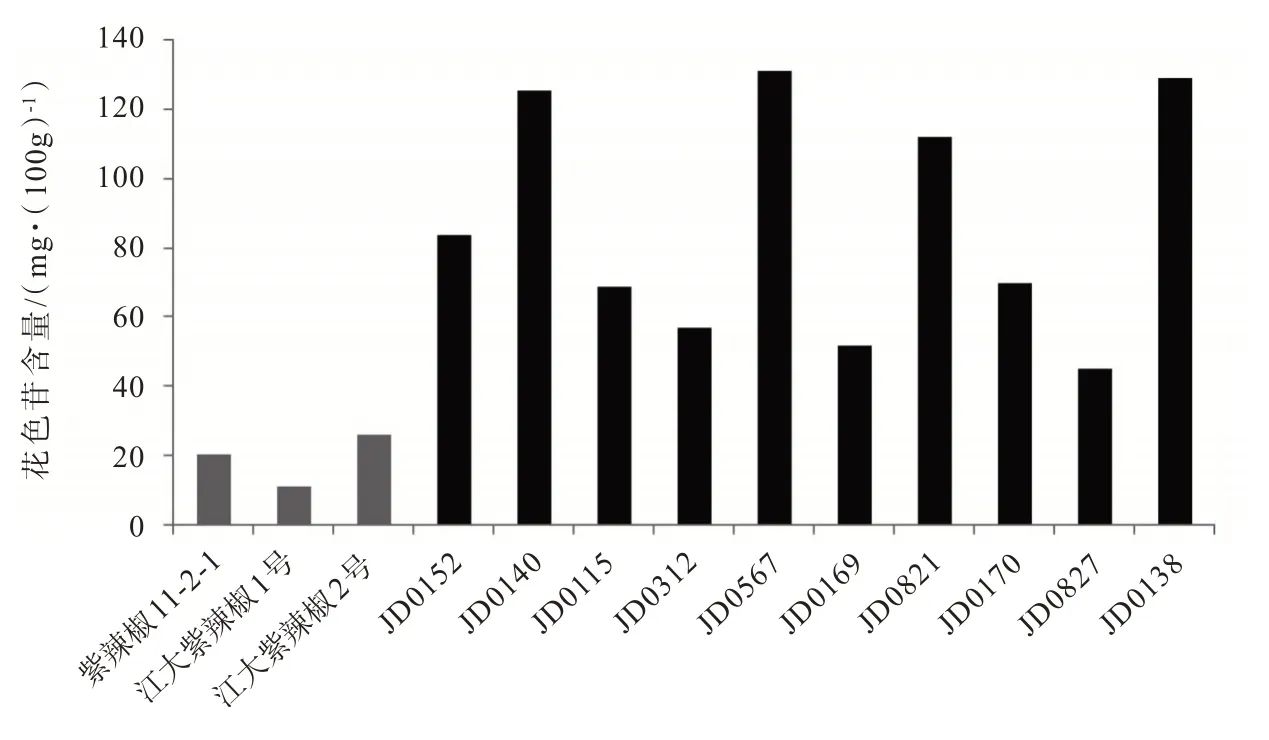
图5 紫色蔬菜花色苷含量Fig.5 The anthocyanin content of purple vegetables
由图5 可知,紫辣椒中花色苷含量最高的是江大紫辣椒2 号,为25.936 3 mg/100g,含量最低是江大紫辣椒1 号,为11.094 9 mg/100g,3 种紫辣椒花色苷含量的平均值为19.011 5 mg/100g,紫辣椒11−2−1、江大紫辣椒2 号花色苷含量均超过平均值;在紫豇豆中,花色苷含量最高的是JD0567,为 131.203 6 mg/100g,含量最低的是 JD0827,为 44.787 7 mg/100g,10 种紫豇豆花色苷含量的平均值为 87.355 mg/100g,其中 JD0140、JD0567、JD00821、JD0138 的花色苷含量均超过平均值。
3 讨论与小结
目前已知的花色苷有17 种,常见的有天竺葵色素(pelargonidin)、矢车菊色素(cyanidin)、飞燕草色素(delphinidin)以及甲基化的芍药色素(peonidin)、牵牛花色素(petunidin)、锦葵色素(malvi⁃din)[12−13]等,由于花色苷会结合不同种类和数量的糖和有机酸,不同的植物含有的花色苷种类也不尽相同,在此实验中,紫辣椒和紫豇豆花色苷的最大吸收波长和平衡时间不同,可能是这两种蔬菜含有的花色苷种类不同所致。
辣椒和豇豆是人们餐桌上不可缺少的蔬菜,对居民的日常饮食有着巨大的影响力。目前,我国辣椒品种果皮颜色多为绿色和淡绿色,紫色辣椒尚未推广种植,市场上偶见紫色豇豆品种,但人们日常食用的多为绿色豇豆;对普通绿色辣椒和绿色豇豆皮的花色苷进行提取测定,结果并没有出现花色苷的最大吸收波长,而花色苷的特征最大吸收波长应在可见光区的500 ~540 nm 附近,由此可推测绿色蔬菜的花色苷含量极低或者基本不含花色苷;同时取紫色辣椒和紫色豇豆的果实(紫色果皮带绿色果皮)进行测定发现同样没有出现花色苷的最大吸收波长,对提取液进行旋蒸浓缩后的测定结果显示果实的花色苷含量约为果皮的1/3,目前培育的紫辣椒和紫豇豆都是紫色果皮和绿色果肉,而以上实验显示紫色蔬菜的花色苷含量明显高于绿色的,因此后期的育种目标是培育出果肉和果皮都为紫色的高花色苷含量的辣椒和豇豆。紫豇豆果皮的花色苷含量均高于紫辣椒果皮的花色苷含量,由此可知,在日常膳食中,紫豇豆比紫辣椒更适合用来补充花色苷。花色苷具有抗氧化和增强人体免疫力等功效,人们从日常蔬菜中补充花色苷对身体大有裨益。本文通过测定湖北省豆类(蔬菜)植物工程技术研究中心培育的新品种紫辣椒和紫豇豆皮的花色苷,为今后合理进行高花色苷品种的选育工作提供了理论依据和方向,也可促进紫色蔬菜的推广种植。

