外源激素对甜叶菊新品种‘惠农5 号’试管苗增殖及生根的影响
陈志英,李文阳,崔广荣
(安徽科技学院 农学院,安徽 凤阳 233100)
甜叶菊(Stevia rebaudian)是菊科,属多年生草本植物,原产于南美巴拉圭的原始森林,1977年我国引进栽培才获得成功,喜温暖潮湿的环境,对光照敏感,它的叶片中含有甜叶菊糖苷,是一种高甜度、低热量的天然甜味剂,甙甜度是蔗糖的250 ~300 倍,但所含热量仅是蔗糖的1/300,是食品及药品工业的原料之一[1−5]。近几年来,随着甜叶菊在药品、食品以及在工业上的应用越来越广泛,市场对甜叶菊的需求量也在逐步增加,栽培面积也在不断扩大,需要更多的优质种苗,育苗是甜叶菊生产的一个重要环节。甜叶菊繁殖方式可分为种子繁殖和组培快繁或扦插育种,组培快繁能够获得大量高质幼苗。国内外有众多专家通过茎尖培养、叶片培养等离体培养途径实现甜叶菊快速繁殖[5−9],研究发现外源激素对多种作物增殖和生根产生重要影响[10−14]。本研究以‘惠农5 号’为材料,探讨了不同外源激素的浓度配比及组合对甜叶菊试管苗增殖的影响,为工厂化育苗、提高繁殖效率提供依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 由蚌埠永生农业科技有限公司提供的新品种‘惠农5 号’。
1.1.2 主要仪器 组织培养专用容器、电子分析天平、高压灭菌锅、无菌操作台、刀剪镊灭菌器、无菌纸、称量纸、玻璃棒。
1.1.3 主要试剂 6−BA(6−苄氨基嘌呤)、KT(激动素)、Ad(腺嘌呤硫酸盐)、NAA(萘乙酸)、KOH(氢氧化钾)、70%酒精、蒸馏水、无菌水、pH 试纸。
1.1.4 基本培养基配方 继代培养基配方:MS+6−BA 1.0 mg/L+NAA 0.1 mg/L+糖30 g/L+琼脂粉5.5 g/L;增殖培养基配方:MS + NAA 0.1 mg/L + 糖30 g/L;生根培养基配方:1/2 MS +糖20 g/L+琼脂粉5.5 g/L,糖为白砂糖,pH 控制在5.8。
1.2 方法
1.2.1 不同外源激素组合的浓度 在增殖培养基中分别添加:①6−BA,其浓度分别为0、0.25、0.5、1.0、2.0、4.0 mg/L。② KT,其浓度分别为 0、0.25、0.5、1.0、2.0、4.0 mg/L。③ Ad,其浓度分别为 0、0.25、0.5、1.0、2.0、4.0 mg/L。
1.2.2 试管苗接种与培养 镊子剪刀高温灭菌,取试管苗在无菌盘上剪成1 cm 长的茎段,插入已配好的培养基中轻按固定,切勿倒插,每瓶接4 个茎段,每个组合要接种10 瓶,贴好标签,写上日期和激素浓度,置于组织培养室每天12 h 光照培养,光照强度为1 600 ~ 2 000 Lux,在(25 ± 1)℃下进行培养。在继代培养期记录接种时间、外植体茎段的生长发育成为无菌苗的情况,及时处理污染的培养基,防止培养基间进行污染。在试管苗增殖试验一个月后要测量株高,记录无菌苗增殖数,观察无菌苗生长状况,计算平均增殖率(增殖苗形成数与接种茎段数之比),生根实验25 d后,记录甜叶菊试管苗每株平均根数、平均根长,计算生根率(所有生根株数占总株数之比),观察其根系发生和生长状况。
2 结果与分析
2.1 外源激素6-BA 和NAA 的组合对甜叶菊试管苗增殖的影响
结果见表1。表1 数据结果表明外源激素6−BA 和NAA 对甜叶菊试管苗增殖都起着重要作用。从平均株高上来看,各处理与对照间差异均达到了显著水平;从增殖系数来看,2.0 mg/L 6−BA 与 0.1 mg/L NAA 处理的增殖系数最高,4.0 mg/L 6−BA 与 0.1 mg/L NAA 处理的增殖系数最低;从增殖系数显著差异分析来看,除了处理A−5 与处理A−1、处理A−6 有显著性差异外,其余处理间没有显著性差异,其中2.0 mg/L 6−BA 与0.1 mg/L NAA 处理增殖系数明显高于A−1(CK)处理。以上结果表明2.0 mg/L 6−BA 与0.1 mg/L NAA 处理对甜叶菊试管苗增殖影响最大(见图1),该培养基下甜叶菊试管苗增殖系数最高,是形成健壮试管苗最合适的培养基。

表1 外源激素6-BA 和NAA 组合对甜叶菊试管苗增殖的影响及显著性差异Tab.1 Effects of the combination of exogenous hormones 6-BA and NAA on the proliferation of stevia in vitro seedlings and its significant difference

图1 6-BA 和NAA 组合对甜叶菊试管苗增殖的影响Fig.1 Effects of the combination of exogenous hormones 6-BA and NAA on the proliferation of stevia in vitro seedlings
2.2 外源激素KT 和NAA 组合对甜叶菊试管苗增殖的影响
结果见表2。表2 的结果清晰地反映了细胞分列素KT 和生长素NAA 及其组合对甜叶菊试管苗增殖有影响。单独使用生长素NAA 或不使用任何生长调节剂的情况下,显然是不利于试管苗的增殖的。从平均株高上来看,各处理与对照间差异是明显的,达到了显著水平;从增殖系数角度看,2.0 mg/L KT 与0.1 mg/L NAA 处理的增殖系数最高,可达3.19;除了处理X−5 与处理X−1(CK)有显著差异外,其余处理间没有显著差异。本试验中2.0 mg/L KT 与0.1 mg/L NAA组合使用,有利于试管苗的增殖(见图2)。

表2 外源激素KT 和NAA 组合对甜叶菊试管苗增殖的影响及显著性差异Tab.2 Effects of the combination of exogenous hormones KT and NAA on the proliferation of stevia in vitro seedlings and its significant difference

图2 KT 和NAA 组合对甜叶菊试管苗增殖的影响Fig.2 Effects of the combination of exogenous hormones KT and NAA on the proliferation of stevia in vitro seedlings
2.3 外源激素Ad 和NAA 的组合对甜叶菊试管苗增殖的影响
结果见表3。表3 结果表明,Ad 能在一定程度上促进甜叶菊试管苗的增殖,而且试管苗的增殖系数随着浓度的增加而逐渐增大,到达一定限度后增殖系数逐渐降低(如I−5 处理)。从平均株高上来看,各处理与对照间差异均达到了显著水平;从增殖系数来分析,增殖系数最高的为1.0 mg/L Ad 与 0.1 mg/L NAA 处理组合(图 3),增殖系数最低的为 0 mg/L Ad 与 0.1 mg/L NAA 处理组合;从增殖系数显著差异角度来看除了I−1(CK)与I−4 组合有明显差异外,其余组合间无显著性差异,其中1.0 mg/L Ad 与0.1 mg/L NAA 处理增殖系数明显高于I−1(CK)处理,高1.15,以上结果表明1.0 mg/L Ad与0.1 mg/L NAA 处理对甜叶菊试管苗生长及增殖的影响最大。
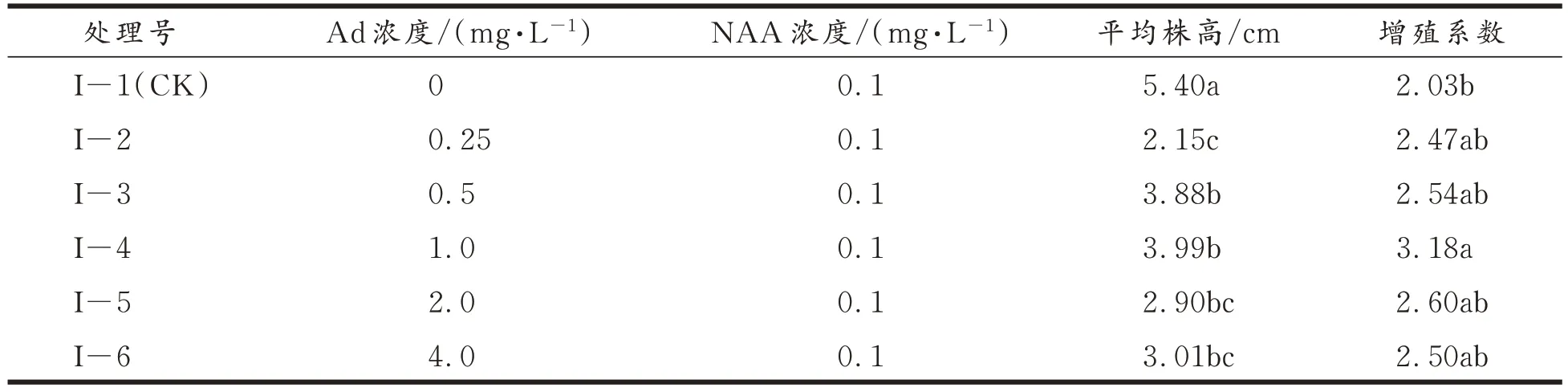
表3 外源激素Ad 和NAA 组合对甜叶菊试管苗增殖的影响及显著性差异Tab.3 Effects of the combination of exogenous hormones Ad and NAA on the proliferation of stevia in vitro seedlings and its significant difference

图3 Ad 和NAA 组合对甜叶菊试管苗增殖的影响Fig.3 Effects of the combination of exogenous hormones Ad and NAA on the proliferation of stevia in vitro seedlings
2.4 外源激素6-BA 和NAA 其组合对甜叶菊试管苗生根的影响
不同外源激素6−BA 和NAA 组合对甜叶菊试管苗生根的影响结果见表4。与对照(不加6−BA)相比,添加外源激素6−BA 会显著降低根长,且随着6−BA 浓度的增加,根长降低幅度增加,特别是A−6 处理。与对照处理相比,增加低浓度的6−BA 浓度,试管苗平均根长变化不显著,而6−BA 浓度过量会显著降低平均根长。
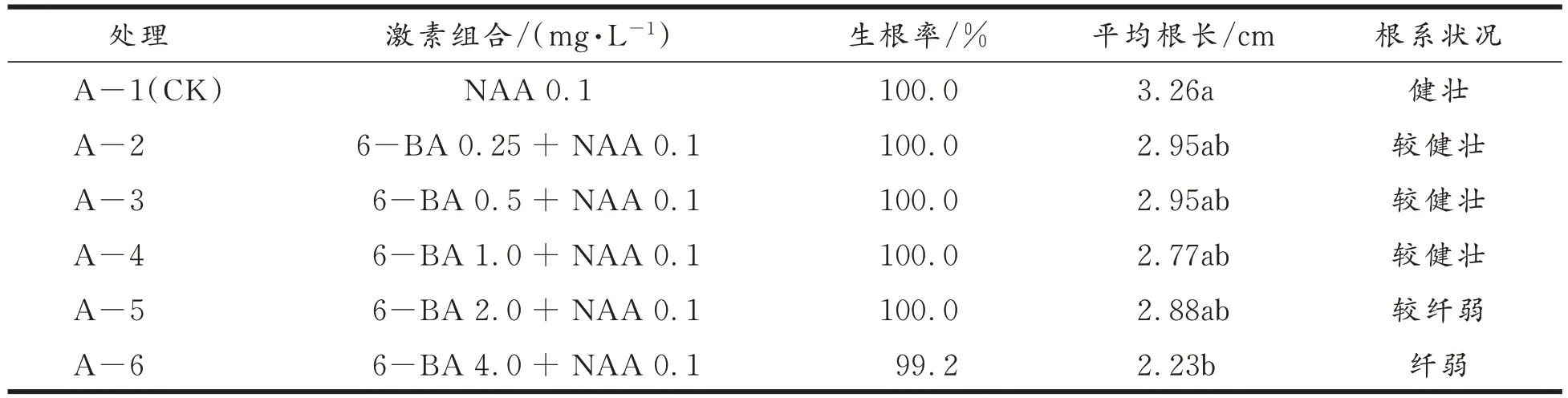
表4 外源激素6-BA 和NAA 组合对甜叶菊试管苗生根的影响及显著性差异Tab.4 Effects of the combination of exogenous hormones 6-BA and NAA on the rooting of stevia in vitro seedlings and its significant difference
2.5 外源激素KT 和NAA 其组合对甜叶菊试管苗生根的影响
结果见表5。由表5 可以看出,对于甜叶菊的生根培养,KT 和NAA 其组合激素均能诱导试管苗的生根,其中诱导甜叶菊生根的X−2、X−3、X−5 诱导生根率达到100%,随着KT 浓度的升高,甜叶菊的生根率也明显降低,根系较纤弱。与对照(不加KT)相比添加外源激素KT 会显著降低根长,特别是X−4 处理。

表5 外源激素KT 和NAA 组合对甜叶菊试管苗生根的影响及显著性差异Tab.5 Effects of the combination of exogenous hormones KT and NAA on the rooting of stevia in vitro seedlings and its significant difference
2.6 外源激素Ad 和NAA 其组合对甜叶菊试管苗生根的影响
结果见表6。从表6 可知,I−2 至I−6 为外源激素Ad 处理组合,从平均根长来看,最大的为CK,最小的为处理I−6。CK 与处理I−6 有显著性差异,与其他处理组合间无明显差异。与对照相比,随着Ad 浓度的增加,根系较纤弱,不添加Ad 激素,其根系越健壮。

表6 外源激素Ad 和NAA 组合对甜叶菊试管苗生根的影响及显著性差异Tab.6 Effects of the combination of exogenous hormones Ad and NAA on the rooting of stevia in vitro seedlings and its significant difference
3 讨论与小结
3.1 讨论
外源激素是指非机体本身产生的,而从外界摄入体内的激素,也可以是人工合成的,也有可能是从其他植物体内提取的,能对植物体的生长发育有很大影响的一类激素,其中6−BA 能促进茎叶的伸长生长,芽的生长;KT 能够促进细胞分裂和器官分化,抑制顶端优势,延缓组织衰老;Ad 能够促进分化、生根。
植物组织培养中,植物生长调节剂的使用浓度、种类及其组合方式的都是一个关键性问题。在不同培养阶段不同植物所需的植物生长调节剂可能不一样,同一植物不同品种间的培养方法不同。所以培养基中植物生长调节剂的种类、浓度配比及其组合值得深入研究。谈静等[11]研究表明6−BA 4.0 mg/L与0.2 mg/L NAA 组合能提高蝴蝶兰增殖系数,6−BA 5.0 mg/L与0.2 mg/L NAA的组合平均根长是最长的,其生根效果也是极显著的;朱宏等[12]研究证明不同的外源激素处理对增殖及生根的确有影响,其中6−BA 1.5 mg/L 与IBA 0.1 mg/L 的组合相对于其他外源激素对桑树无菌苗的增殖具有良好的促进作用。在增殖试验中,6−BA、KT 和Ad 作为细胞分裂素,能提高其达到一定增殖系数的速率。本研究结果表明,甜叶菊新品种‘惠农5 号’的6−BA 最适浓度为2.0 mg/L,大于最适值时有抑制效果;KT 最适浓度为2.0 mg/L,大于最适值时增殖系数反而降低;Ad最适浓度为1.0 mg/L。本试验筛选出适宜的生根培养基为1/2 MS+ NAA 0.1 mg/L +糖 20 g/L + 琼脂粉 5.5 g/L,但是苏彩霞等[13]研究表明 1/2 MS + NAA 0.2 mg/L + 糖 20 g/L +琼脂粉5.5 g/L 为最佳培养基,而孙涛等[14]的研究表明最佳生根培养基为MS + 1.25 mg/L IBA +0.05 mg/L NAA + 30.0 g/L 蔗糖 + 7.0 g/L 琼脂。这与本试验结果不同,可能与甜叶菊的品种、基因型不同或激素有关。本试验研究结果表明,与其他植物相比较,本品种的甜叶菊试管苗增殖率的提高有很大进步空间,其中一个重要原因是试管苗在试管苗增殖过程中形成丛芽较困难,易形成簇状苗,具体原因有待进一步研究探索。
3.2 小结
甜叶菊试管苗的增殖和生根受激素浓度组合的影响,其作用也是显著的。本试验研究发现,6−BA 浓度为 2.0 mg/L 和 NAA 浓度为 0.1 mg/L 时,KT 浓度为 2.0 mg/L 和 NAA 浓度为 0.1 mg/L时,Ad 浓度为2.0 mg/L 和NAA 浓度为0.1 mg/L 时,都能使甜叶菊试管苗进行增殖,其中6−BA 2.0 mg/L 与NAA 0.1 mg/L 组合使用增殖系数最高且植株生长情况最佳。对于生根来说,添加外源激素对试管苗生根几乎是没有影响的,但是除了Ad 外,其他外源激素对甜叶菊试管苗的根生长有一定的促进作用,根长度都有不同程度的增长。最适合甜叶菊试管苗增殖的培养基为:MS + NAA 0.1 mg/L + 6−BA 2.0 mg/L + 琼脂粉5.5 g/L + 糖30 g/L;最适合试管苗生根的培养基为1/2 MS + NAA 0.1 mg/L + 琼脂粉5.5 g/L + 糖20 g/L。

