苦参碱对CT26荷瘤小鼠肿瘤组织中VEGF及HIF-1α水平的影响*
龚 雪,崔换天,郭玮钰,王 丽,边育红,张翟轶
(1.天津中医药大学,天津 301617;2.天津市第二人民医院,天津 300192)
近年来恶性肿瘤患病率持续升高,传统治疗手段(如手术、放疗、化疗)虽有一定优势,但仍存在转移、复发、生存质量降低等诸多问题。苦参碱是中药苦参的主要成分之一,具有抗肿瘤、抗病毒、抗炎等作用[1-3]。此外,苦参碱能减轻放疗、化疗的不良反应,减少肿瘤的复发和转移[4],提高患者生存质量,但其作用机制尚不明确。体外实验研究表明,苦参碱对子宫内膜癌细胞、胃癌细胞的增殖有明显的抑制作用[5-6],且能降低肿瘤细胞中血管内皮生长因子(VEGF)的表达。而VEGF和缺氧诱导因子-1α(HIF-1α)为血管生成的相关因子,其与肿瘤的发生发展密切相关[7-8]。临床研究表明,子宫平滑肌肿瘤患者肿瘤组织中VEGF阳性表达率相较于癌旁组织显著增加[9]。王秀岩等[10]发现膀胱癌患者中VEGF,HIF-1α 阳性表达率分别为 70.5%、57.2%,且两者之间呈正相关。本研究通过建立结肠癌荷瘤小鼠模型,灌胃不同剂量苦参碱,研究苦参碱对荷瘤小鼠的治疗作用,同时考察造模给药后荷瘤小鼠肿瘤组织中VEGF、HIF-1α表达,初步探究其作用机制。
1 资料与方法
1.1 实验动物及瘤株 Balb/c小鼠40只,雄性,体质量(20.0±1.0)g,由北京维通利华实验动物中心提供,许可证号:SCXK(京)2016-0002。饲养于SPF级清洁环境中,恒温恒湿,标准饲料喂养,自由进食,常规适应性喂养7 d后开始造模给药。小鼠结肠癌细胞株CT26(北纳创联生物技术有限公司)。
1.2 主要试剂及仪器 苦参碱标准品(C15H24N2O),分子量248.37(国家标准物质中心);胎牛血清(Biological Industries,货号:04-001-1ACS);RPMI-1640 培养基(HyClone,货号:SH30809.01);双抗(Gibco,货号:15240-096);0.25%胰蛋白酶(Gibco,货号:25200-072);总RNA提取试剂盒(天根生物科技有限公司,货号:DP419-02),反转录试剂盒(天根生物科技有限公司,货号:KR116-02)、荧光定量扩增试剂盒(天根生物科技有限公司,货号:FP205-02);兔抗鼠 VEGF(abcam,货号;ab2349)、兔抗鼠HIF-1α(博奥森生物科技有限公司,货号:bs-20399R),免疫组化二抗(博奥森生物科技有限公司);多功能读扳机(Thermo,型号:5250030);光学显微镜(Olympus,型号:IX2-UCB-2);荧光定量聚合酶链反应(PCR)仪(Bio-Rad)。
1.3 CT26细胞复苏与传代 CT26细胞1支,将细胞放入37℃水浴快速融化,用无菌操作法将细胞悬液转移至15 mL离心管中,加入5 mL RPMI-1640完全培养液(RPMI-1640培养基+10%胎牛血清+1%双抗),离心后将细胞重悬入5 mL完全培养液,接种至25 cm2瓶中,37℃,5%二氧化碳(CO2)培养。隔天换液,至细胞密度80%左右时,用胰酶消化传代。
1.4 荷瘤小鼠模型建立及分组 选取Balb/c小鼠,雄性,体质量(20.0±1.0)g,分别于右腋下接种 0.2 mL经生理盐水稀释的CT26细胞悬液5×106个/mL,接种后培养21 d。将40只小鼠随机分为模型组,阳性药组,苦参碱低剂量组,苦参碱中剂量组,苦参碱高剂量组,于接种7 d后每天分别灌胃生理盐水0.2 mL,环磷酰胺 25 mg/kg,苦参碱 12.5 mg/kg,苦参碱 25 mg/kg,苦参碱 50 mg/kg,连续灌胃 14 d[11-12]。
2 观察指标及检测方法
2.1 荷瘤小鼠一般情况、瘤质量及抑瘤率 各组小鼠均于第14天给药2 h后,称体质量,将小鼠颈椎脱臼处死,处死后剪开右腋下皮肤,分离肿瘤组织,尽量剔除骨头及毛发,保证肿瘤组织的完整性,经生理盐水冲洗后用滤纸吸干,称质量,计算抑瘤率。抑瘤率=(模型组平均瘤质量-实验组平均瘤质量)×100%/模型组平均瘤质量。
2.2 荷瘤小鼠肿瘤组织病理学变化 造模给药后,收集各组荷瘤小鼠肿瘤组织,用福尔马林溶液固定,常规脱水、透明、包埋、切片,苏木精-伊红(HE)染色,光学显微镜下观察各组荷瘤小鼠肿瘤组织病理学变化。每组6个样本,每个样本选取5个增殖最活跃区域,进行核分裂象计数[13]。细胞处于有丝分裂期的组织病理学特征为:核膜消失,染色体呈深染毛刺样,对称或不对称分布于细胞质中,细胞质染色略浅。这样的细胞记为1个核分裂象,计数时,在最活跃区连续计数10个高倍视野(400×),并将所得数值累加。
2.3 荧光定量PCR检测 造模给药后,收集各组荷瘤小鼠肿瘤组织,采用总RNA提取试剂盒(天根生物科技有限公司,货号:DP419-02)提取肿瘤组织中RNA,使用UV法检测每个样品中的总RNA浓度。计算 OD260/280,OD260/280,选取比值在 1.8~2.0 内的样本进行反转录合成cDNA(天根生物科技有限公司,货号:KR116-02),扩增采用SYBR Green Real Time RT-PCR试剂盒(天根生物科技有限公司,货号:FP205-02),运用qPCR法考察各组小鼠肿瘤组织中VEGF、HIF-1α基因表达,采用β-Actin为内参,具体引物序列见表1。
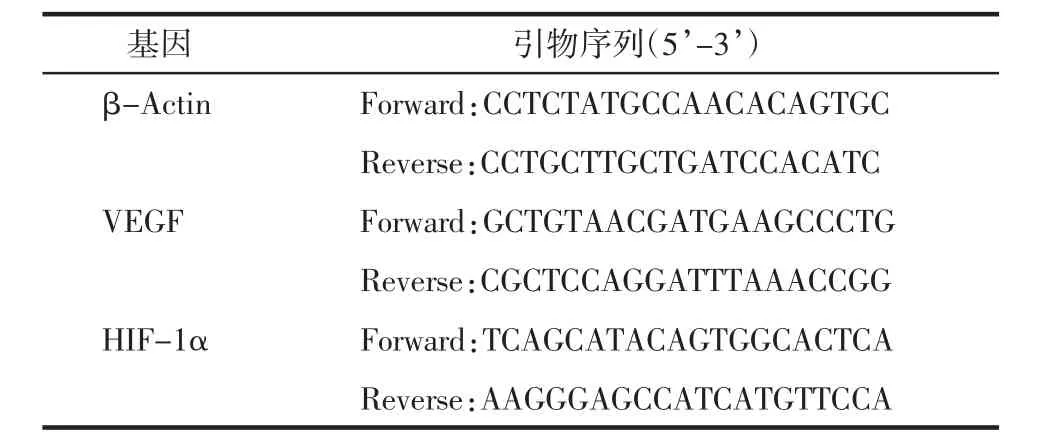
表1 引物序列
2.4 免疫组化造模给药后,收集各组荷瘤小鼠肿瘤组织,用福尔马林溶液固定,常规脱水、透明、包埋、切片,免疫组化法检测各组小鼠肿瘤组织中VEGF(abcam,货号:ab2349)、HIF-1α(博奥森生物科技有限公司,货号:bs-20399R)的表达水平。VEGF定位于细胞质或细胞核,HIF-1α主要表达于细胞质中,细胞核中也有少量表达,镜下观察,图片背景呈蓝紫色,阳性产物呈棕黄色或黄色。400倍镜下进行病理学观察,每张切片随机选择不相重叠的5个视野,利用软件(Image-pro Plus6.0)对阳性区域进行图像处理,计算积分光密度(IOD)[14-15],进行统计分析。
2.5 统计学方法 使用SPSS 21.0软件对实验数据进行统计学分析,计量资料服从正态分布采用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用Dunnett-t检验及LSD-t验,P<0.05 为差异有统计学意义。
3 结果
3.1 苦参碱对结肠癌荷瘤小鼠的治疗作用 各组小鼠在实验过程中均未出现死亡。与模型组相比,阳性药组(P<0.01)、苦参碱低剂量组(P<0.01)、苦参碱中剂量组(P<0.01)、苦参碱高剂量组(P<0.01)小鼠肿瘤重量显著降低;与阳性药组相比,苦参碱低、中、高剂量组各组瘤重差异无统计学意义(P>0.05)。具体见表2。
表2 各组小鼠一般情况、瘤质量及抑瘤率比较(±s)
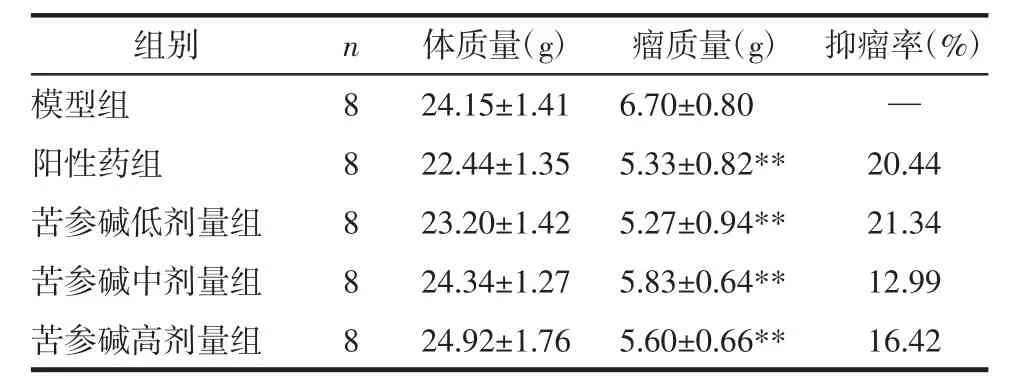
表2 各组小鼠一般情况、瘤质量及抑瘤率比较(±s)
注:与模型组相比,**P<0.01。
组别 瘤质量(g) 抑瘤率(%)模型组 6.70±0.80 —阳性药组 5.33±0.82** 20.44苦参碱低剂量组 5.27±0.94** 21.34苦参碱中剂量组 5.83±0.64** 12.99苦参碱高剂量组 5.60±0.66** 16.42 n 8 8 8 8 8体质量(g)24.15±1.41 22.44±1.35 23.20±1.42 24.34±1.27 24.92±1.76
3.2 给药后各组小鼠肿瘤组织病理学变化 HE染色结果表明,模型组小鼠肿瘤组织中可见大量核分裂象,与模型组相比,阳性药组、苦参碱低剂量组、苦参碱中剂量组、苦参碱高剂量组小鼠肿瘤组织中核分裂象显著减少(P<0.01),细胞坏死程度更为严重;而苦参碱高剂量组核分裂象与阳性药组相比,差异具有统计学意义(P<0.01)。以上结果提示苦参碱具有一定的抗肿瘤作用。具体见图1、表3。
3.3 苦参碱对荷瘤小鼠肿瘤组织中VEGF、HIF-1α mRNA表达水平的影响 荧光定量PCR结果显示,各组小鼠肿瘤组织中VEGF在mRNA的表达水平差别有统计学意义(n=8,F=33.452,P<0.05)。与模型组相比,阳性药组(P<0.01)、苦参碱低剂量组(P<0.05)、苦参碱中剂量组(P<0.01)、苦参碱高剂量组(P<0.01)荷瘤小鼠肿瘤组织中VEGF在mRNA的表达水平均显著下调,具体见图2。
表3 各组小鼠核分裂象计数(±s)

表3 各组小鼠核分裂象计数(±s)
注:每高倍视野(HPF)直径为 0.55 mm;与模型组相比,**P<0.01;与阳性药组相比,##P<0.01。
组别 核分裂象个数(/10HPF)模型组 33.07±4.32##阳性药组 14.13±3.03**苦参碱低剂量组 15.27±3.76**苦参碱中剂量组 13.33±3.96**苦参碱高剂量组 10.73±3.37**##
经不同剂量苦参碱干预后,各组小鼠肿瘤组织中HIF-1α在mRNA的表达水平差别有统计学意义(n=8,F=35.100,P<0.05)。与模型组相比,阳性药组(P<0.05)、苦参碱低剂量组(P<0.01)、苦参碱中剂量组(P<0.01)、苦参碱高剂量组(P<0.01)荷瘤小鼠肿瘤组织中HIF-1α在mRNA的表达水平均显著下调,具体见图3。

图1 造模给药后各组小鼠肿瘤组织HE染色(n=6,标尺:50 μm)

图2 各组小鼠肿瘤组织中VEGF mRNA表达水平(n=8)
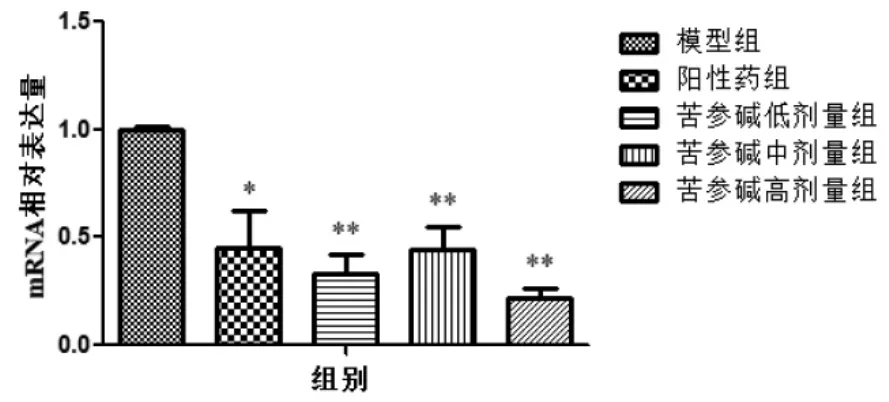
图3 各组小鼠肿瘤组织中HIF-1α mRNA表达水平(n=8)
3.4 苦参碱对结肠癌荷瘤小鼠肿瘤组织中VEGF、HIF-1α水平的影响 各组肿瘤组织免疫组化结果表明,VEGF阳性产物呈棕黄色表达于细胞质/细胞核中,见图4。图像分析结果显示,与模型组相比,阳性药组(P<0.01)、苦参碱低剂量组(P<0.05)、苦参碱中剂量组(P<0.01)、苦参碱高剂量组(P<0.01)VEGF的IOD值显著降低,而苦参碱中、高剂量组的VEGF表达水平与阳性药组相比,也具有统计学差异(P<0.05),具体见表 4。HIF-1α 阳性产物呈棕黄色,主要表达于肿瘤细胞质中,细胞核中也有少量表达,见图5。图像分析结果显示,各给药组HIF-1α表达量较模型组均显著降低(P<0.05),而与阳性药组相比,苦参碱低剂量组 IOD 值差异显著(P<0.05),具体见表4。
4 讨论
现代药理学研究表明,许多中药的活性成分具有抗肿瘤作用[16]。苦参碱是中药苦参中提取的一种生物碱,临床常选取苦参碱/氧化苦参碱注射液治疗消化系统肿瘤[17-18]。有临床研究表明:苦参碱联合化疗治疗晚期结肠癌疗效显著,能减少化疗带来的毒副作用[19];与单纯化疗相比,采用复方苦参注射液联合化疗药物可提高晚期结直肠癌的近期疗效,改善患者生存质量[20]。苦参碱能抑制人结肠癌细胞株体外增殖,其机制可能与阻滞细胞周期、诱导细胞凋亡有关[21],且苦参碱能抑制K-ras基因突变型结肠癌细胞的生长[22]。苦参碱通过抑制p38信号通路抑制结肠癌细胞的增殖和侵袭[11]。除此之外,苦参碱对H22肿瘤细胞生长具有明显的抑制作用,且能提高H22肉瘤小鼠的生存质量[23]。笔者研究发现,灌胃不同剂量苦参碱后,与模型组相比,结肠癌荷瘤小鼠肿瘤重量显著减轻,肿瘤组织形态学有明显改变,肿瘤组织中核分裂象显著减少,提示苦参碱具有一定的抗肿瘤作用。
表4 各组小鼠肿瘤组织中VEGF及HIF-1α表达的比较[±s,IOD(×106)]
注:与模型组相比,*P<0.05,**P<0.01;与阳性药组相比,#P<0.05;与阳性药组相比,##P<0.01。
组别模型组阳性药组苦参碱低剂量组苦参碱中剂量组苦参碱高剂量组n 3 3 3 3 3 VEGF HIF-1α 15.38±1.84## 18.06±1.34##8.37±0.84** 9.42±1.53**9.25±1.45* 14.01±1.02*#5.21±0.89**# 7.68±0.43**3.47±0.43**## 5.94±1.14**
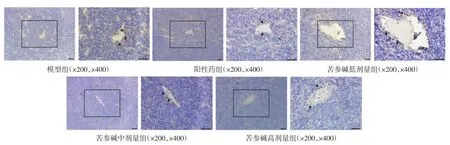
图4 给药后各组小鼠肿瘤组织VEGF免疫组化染色(n=6,标尺:50 μm)
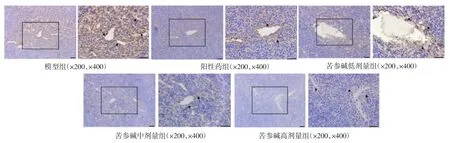
图5 给药后各组小鼠肿瘤组织HIF-1α免疫组化染色(n=6,标尺:50 μm)
临床研究表明,结肠癌患者肿瘤组织中VEGF、HIF-1α水平较癌旁组织表达上调,二者均与结肠癌肿瘤直径、TNM分期及分化程度有关[24],VEGF表达水平与结肠癌病理性转移密切相关[25]。肿瘤细胞生长需要大量的氧气和营养物质以满足其能量代谢和细胞增殖的需要,这个过程离不开血管生成,而VEGF是介导肿瘤血管生成的关键因素[26-28],这对肿瘤的增殖、转移十分重要[29]。已报道,某些中药单体能通过调控VEGF/VEGFR2信号通路抑制结肠癌移植瘤血管生成[30]。HIF-1α是激活VEGF的一个关键转录因子,它位于多个促血管生成基因的上游[31-32]。当肿瘤细胞处于缺氧状态时,细胞表达HIF-1α,HIF-1α能调控VEGF并使其表达上调,从而促进血管新生[33]。此外,肿瘤的缺氧状态能帮助肿瘤细胞抵抗放疗和化疗所产生的细胞毒性[34-35]。
研究结果表明苦参碱可显著降低荷瘤小鼠肿瘤组织中VEGF、HIF-1α mRNA和蛋白的表达,提示苦参碱可能是通过抑制荷瘤小鼠肿瘤组织中VEGF和HIF-1α表达从而发挥抗肿瘤作用。此外,本研究采用环磷酰胺作为阳性药物进行比较,结果显示苦参碱中、高剂量对结肠癌荷瘤小鼠肿瘤组织形态学影响与环磷酰胺处理无显著差异,然而苦参碱能否作为环磷酰胺的替代药物治疗肿瘤有待进一步研究。

