患者血清中TNF-α、IL-6因子的水平与发生肺挫伤的关系
韩遵华,欧阳兴,蒋 亮,段 淼
(遵义市第一人民医院,贵州 遵义 563002)
随着交通事业和工程建设的飞速发展,车祸、坠落所致的多发伤日益增多,肺挫伤的发病率也逐年升高[1]。胸部创伤合并肺挫伤是急诊科常见的胸部损伤,但发病较隐匿,临床工作中需影像学检查明确。肺挫伤可以导致肺毛细血管内皮细胞和肺泡上皮细胞损伤,肺组织氧合能力下降,肺内血流分布异常,容易诱发急性呼吸窘迫综合征的发生[2]。肺挫伤的死亡率居高不下的主要原因是肺挫伤容易导致患者呼吸、循环衰竭,死亡率明显增高[3]。肺挫伤患者血清中炎症因子大量活化是诱发肺血流动力紊乱的主要原因,血清中肿瘤坏死因子-α(TNF-α)是机体中重要的严重炎症介质参与多种炎症细胞的活化,TNF-α可以诱导白细胞介素-6(IL-6)活化诱发大量淋巴因子分泌,促进炎性反应“瀑布”形成[4]。本研究探讨肺挫伤患者血清中炎性因子水平与患者血流动力学变化的关系,并希望筛选出与发生肺挫伤密切相关的几项指标,以指导临床医生重视,现将研究结果报告如下。
1 资料与方法
1.1研究对象:选取2016年7月~2017年7月在我院治疗的胸部损伤患者80例作为研究对象,其中38例肺挫伤患者为肺挫伤组,未发生肺挫伤的42例患者为未发生肺挫伤组。肺挫伤的诊断经影像学证实,符合中华医学会指定呼吸内科分会制定的相关诊断标准。纳入标准:①确诊为胸部损伤;②所有患者知情同意本研究;③依从性好,并能完成随访。排除标准:①合并其他可能影响肺功能水平的疾病,包括支气管哮喘、支气管扩张、慢性支气管炎、慢性阻塞性肺疾病等;②合并其他脏器功能不全,包括心功能不全、肾功能不全、肝功能不全等;③既往有胸部手术或者心脏手术的患者;④妊娠、哺乳或其他认知功能不全的疾病;⑤合并恶性肿瘤的患者。本研究经我院伦理委员会批准,所有患者均知情同意本研究。
1.2研究方法:所有患者入院后给予常规氧疗,经右侧颈内静脉置入肺动脉漂浮导管监测血流动力学指标及氧动力学指标。
1.3观察指标:①血清中炎性因子水平检测:收集患者外周静脉血5 ml,采用酶联免疫吸附法检测血清中sTREM-1水平,试剂盒购于美国ABCAM有限公司,具体操作方法参照试剂盒说明书进行;②血气指标及血流动力学指标测定:所有患者均行右侧颈内静脉置入漂浮导管检测患者血流动力学及氧动力学指标,测定患者肺动脉压(mPAP)、右房压(RAP),心排出血量(CO)、心排血指数(CI);同步测定患者动脉血氧饱和度(SaO2)、混合静脉血氧饱和度(SvO2)、氧输送(DO2)、氧消耗(VO2)、右心室做功指数(RVSWI)、动脉血pH。

2 结果
2.1两组患者一般资料对比:肺挫伤组患者男20例,女18例,平均年龄(43.5±4.5)岁,体重指数(23.5±2.3)kg/m2。未发生肺挫伤组患者男22例,女20例,平均年龄 ( 36.2 ±10.9)岁,体重指数(25.8±3.6)kg/m2。两组患者一般资料对比,差异均无统计学意义(P> 0.05) ,具有可比性。
2.2两组患者各项观察指标水平对比:肺挫伤组患者TNF-α、IL-6、mPAP三项指标明显高于未发生肺挫伤组患者,而CO、SaO2、动脉血pH明显低于未发生肺挫伤组患者,差异均有统计学意义(P< 0.05);CI、SvO2、DO2、VO2、RVSWI两组比较差异无统计学意义(P>0.05)。见表1。
2.3ROC曲线分析:根据组间显著性差异分析,最终选择TNF-α、IL-6、mPAP 3项指标进行判定和区分开肺挫伤组和未发生肺挫伤组。同时对三项指标进行样本间ROC曲线分析,其中面积指标接近0.9的有IL-6(AUC:0.84)、TNF-α(AUC:0.84)、mPAP(AUC:0.82)。见图1。
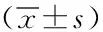
表1 两组患者各项观察指标水平对比
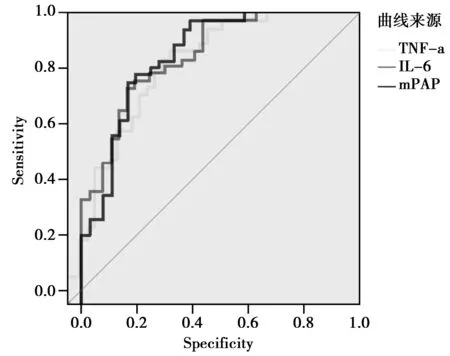
图1 TNF-α、IL-6、mPAP各项指标的ROC分析
3 讨论
多发伤及胸部外伤容易导致肺挫伤, 肺挫伤的主要病理生理机制是肺组织破坏后大量炎性因子释放,加重肺内毛细血管损伤,促进毛细血管内血流异常分布,刺激患者血管内皮损伤[5]。肺挫伤患者遭受暴力作用,导致胸腔容积缩小,胸腔压力增加,胸廓出现严重变形,肺部在这样的挤压和牵拉作用下发生急性肺损伤,进而影响肺通气和换气功能[6]。肺损伤患者容易出现肺动脉高压、肺血管内皮细胞损伤和血小板活化,进而诱发急性呼吸窘迫综合征,急性呼吸窘迫综合征的发生严重影响患者肺通气和换气功能,导致患者呼吸功能衰竭[7-8]。
肺挫伤患者血清中炎性因子水平活化是患者肺功能损伤的主要病理生理机制之一, TNF-α是炎性反应的始动因子,血清中TNF-α水平升高可以刺激炎性细胞活化,导致淋巴细胞等浸润刺激局部炎性因子活化加重肺损伤[9-10]。IL-6是重要的淋巴细胞因子,IL-6大量分泌可以刺激多种炎性细胞聚集、趋化、迁移至损伤部位,而且活化的细胞因子可以加重肺血管内皮损伤[11-12]。本研究探讨血清中TNF-α、IL-6水平与肺挫伤患者血清中血气相关指标的关系,结果发现肺挫伤患者的炎性因子含量增高,肺动脉压力也增高,而且血流动力学结果也提示患者高水平的炎性因子是患者血流动力学不稳定的重要原因,高水平炎性因子患者血流动力状态更差。这提示高炎性因子水平的患者病情预后更差,这可能是由于炎症因子参与肺局部损伤和浸润,刺激血管损伤,加重了病情发展。
另本研究中发现肺挫伤组血氧饱和度较低的患者后期并发了急性呼吸窘迫综合征(ARDS),这可能与患者血氧下降进而诱发机体缺血、缺氧诱发了ARDS等一系列临床症状有关[13-15]。肺挫伤患者ARDS的发生可能与血清中炎症因子水平密切相关,血清中TNF-α、IL-6水平可导致肺血管内皮细胞损伤,诱发低氧血症,进而进一步加重组织缺血缺氧、诱发肺水肿。
综上所述,肺挫伤具有较高发病率,血清中炎症因子活化是肺挫伤的主要病理生理机制,通过本研究结果证实血清中TNF-α、IL-6参与肺损伤的发展,诊断价值较高,动态监测肺损伤患者血清中TNF-α、IL-6水平具有积极重要的临床意义。

