利拉鲁肽对2型糖尿病患者T细胞亚群的影响
曾小兵,朱长东,谢宝强
(赣州市立医院内分泌科 ,江西 赣州 341000)
近年来2型糖尿病(type 2 diabetes mellitus,T2DM)患病率呈现飞速上升趋势,现严重危害人民生命健康。其发病机制主要表为胰岛素抵抗及胰岛素相对缺乏,近年来有研究发现2型糖尿病在发生及发展过程中存在免疫功能紊乱[1]。T细胞亚群是体内最重要的免疫细胞群,监测其变化可在一定程度反应目前机体免疫反应情况。利拉鲁肽(Liraglutide)是人GLP-1的长效类似物,保留了GLP-1的各种生理作用和治疗优势,临床上已用于治疗2型糖尿病多年。最近的研究显示利拉鲁肽能抑制β细胞凋亡、促进β细胞增殖,对多种免疫细胞有调节作用[2]。本研究使用利拉鲁肽治疗初发2型糖尿病患者,观察患者T细胞亚群、血糖、C肽等的变化,探讨利拉鲁肽对2型糖尿病的治疗作用。
1 资料与方法
1.1一般资料:选取2017年9月~2018年2月在我院内分泌科住院初诊T2DM患者60例,随机分为试验组及对照组,每组各30例,全部患者均符合1997年ADA糖尿病诊断标准[3],两组患者一般资料对比差异无统计学意义(P>0.05),有可比性。两组患者肝肾功能正常,无风湿免疫类疾病,无严重心血管及脑血管疾病,依从性良好,认知无障碍。
1.2方法
1.2.1治疗方法:所有患者均给予饮食及运动治疗,由营养师指导患者饮食。两组患者均使用预混胰岛素类似物(门冬胰岛素30、赖脯胰岛素25、赖脯胰岛素50任选其一),试验组在此基础上联合使用利拉鲁肽注射液1.2 mg/d治疗。
1.2.2标本收集和处理:所有对象晨起空腹抽取肘正中静脉血,使用流式细胞仪以免疫荧光法检测CD4+、CD8+计数,并计算其比值。糖化血红蛋白使用糖化分析仪进行检测。所有患者均行OGTT,以测定患者空腹血糖、餐后2 h血糖、空腹C肽、餐后2 h C肽,空腹血糖、餐后2 h血糖、空腹C肽、餐后2 h C肽、LDL-C均使用全自动生化仪检测。

2 结果
2.1治疗前后两组患者糖化血红蛋白、BMI、低密度脂蛋白胆固醇比较:治疗后,试验组患者的糖化血红蛋白、BMI、低密度脂蛋白胆固醇较对照组降低,结果有统计学意义(P<0.05)。见表1。
2.2治疗前后2组患者血糖、C肽比较:治疗后,试验组空腹血糖、餐后2 h血糖较对照组降低,试验组空腹C肽、餐后2 h C肽较对照组升高,试验组治疗后较治疗前空腹血糖、餐后2 h血糖降低,空腹C肽、餐后2 h C肽升高,结果有统计学意义(P<0.05)。见表2。
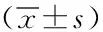
表1 两组治疗前后HbA1c、BMI、LDL-C水平
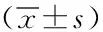
表2 两组治疗前后空腹血糖、餐后2 h血糖、空腹C肽、餐后2 h C肽水平
2.3治疗前后两组CD4+、CD8+、CD4+/CD8+比较:治疗后试验组较对照组CD4+、CD4+/CD8+升高,CD8+降低,试验组治疗后较治疗前CD4+、CD4+/CD8+升高,CD8+降低,差异有统计学意义(P<0.05)。见表3。
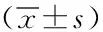
表3 两组治疗前后CD4+、CD8+、CD4+/CD8+水平
3 讨论
正常情况下,人体内存在一定数量的自身反应性T细胞(大多数为CD4+T细胞),同时,免疫系统中也存在一类调节性T细胞(regulatory T cells,Tregs),能以负性调节方式抑制自身反应效应性T细胞,阻止自身免疫性疾病和过敏性疾病的发生,从而维持自身免疫耐受(dominant tolerance)。研究认为,Treg细胞主要是通过抑制性调节CD4+和CD8+T细胞的活化与增值而发挥免疫负调节功能[4]。已知1型糖尿病与细胞免疫和体液免疫异常有关[5],但2型糖尿病长期以来被认为是胰岛素抵抗和胰岛素分泌不足而导致的。近年来,临床研究发现,细胞免疫功能异常是2型糖尿病发病的重要环节[6]。
GLP-1受体广泛分布于胰腺、大脑、心脏、肾脏及胃肠道等[7],在鼠的免疫组织、鼠和人类的T细胞、B细胞和iNKT细胞也有表达[8-9]。GLP-1对鼠[8-10]和人类[11]的T淋巴细胞有调节作用,并能影响T淋巴细胞的迁移。本研究中,实验组及对照组在治疗前的T细胞亚群无明显差异,随着治疗时间的延长,试验组较对照组CD4+、CD4+/CD8+升高,CD8+降低,结果有统计学意义。且试验组本身CD4+、CD4+/CD8+也随治疗而逐渐升高,CD8+逐渐下降。说明利拉鲁肽在体内能够抑制效应性T细胞的增殖,具有免疫负性调节作用,在治疗自身免疫性疾病方面可能具有良好的应用前景。尤其在2型糖尿病发病早期,如果采用利拉鲁肽治疗。一方面能够通过多重机制控制血糖。也能通过促进增殖和抗凋亡作用保护残存胰岛β细胞,另一方面还可能通过抑制自身免疫效应性T细胞的增殖,缓解过强的自身免疫反应,减少效应性T细胞对胰岛β细胞的破坏,发挥免疫保护作用,从而阻止2型糖尿病的进程。

