细菌生物膜与各微生物类群之间的作用关系
夏名轩 金杰人 肖明
摘 要: 从细菌生物膜与真菌、其他细菌、原生动物及噬菌体4个角度对其作用进行了综述。在细菌与真菌之间,生物膜不仅是细菌的拮抗手段,也可介导两者之间的共存。在应对异种细菌时,其作为一种物理防御手段与入侵者竞争。遭受原生动物捕食时,生物膜的致密程度上升以应对原生动物的冲击,或是减少生物膜形成,形成不易被掠食的微菌落。而在抵抗噬菌体侵染方面,生物膜的作用包括使菌体紧密排列,调节本身化学成分变化及群体感应功能,抑制噬菌体感染。
关键词: 细菌; 生物膜; 真菌; 原生动物; 噬菌体
中图分类号: Q 939.9 文献标志码: A 文章编号: 1000-5137(2020)05-0589-07
Study on the relationship between bacterial biofilm and various microbial taxa
XIA Mingxuan, JIN Jieren, XIAO Ming*
(College of Life Sciences, Shanghai Normal University, Shanghai 200234, China)
Abstract: This paper reviews the effects on bacterial biofilms from perspectives of fungi,other bacteria,protozoa and bacteriophages.Between bacteria and fungi,the biofilms are not only means of antagonism of bacteria,but also intermediate coexistence of the two.When dealing with heterogeneous bacteria,it competes with intruders as a physical defender.When it suffers from predators predation the density of biofilms increased to cope with the impact of protozoa,or the formation of biofilms reduced and then the uneasily predated microcolonies formed.In terms of resistance to bacteriophages infection,the role of biofilms includes aligning the bacteria closer,regulating their chemical composition and their quorum sensing,to inhibit bacteriophage infection.
Key words: bacteria; biofilm; fungus; protozoan; bacteriophage
0 引 言
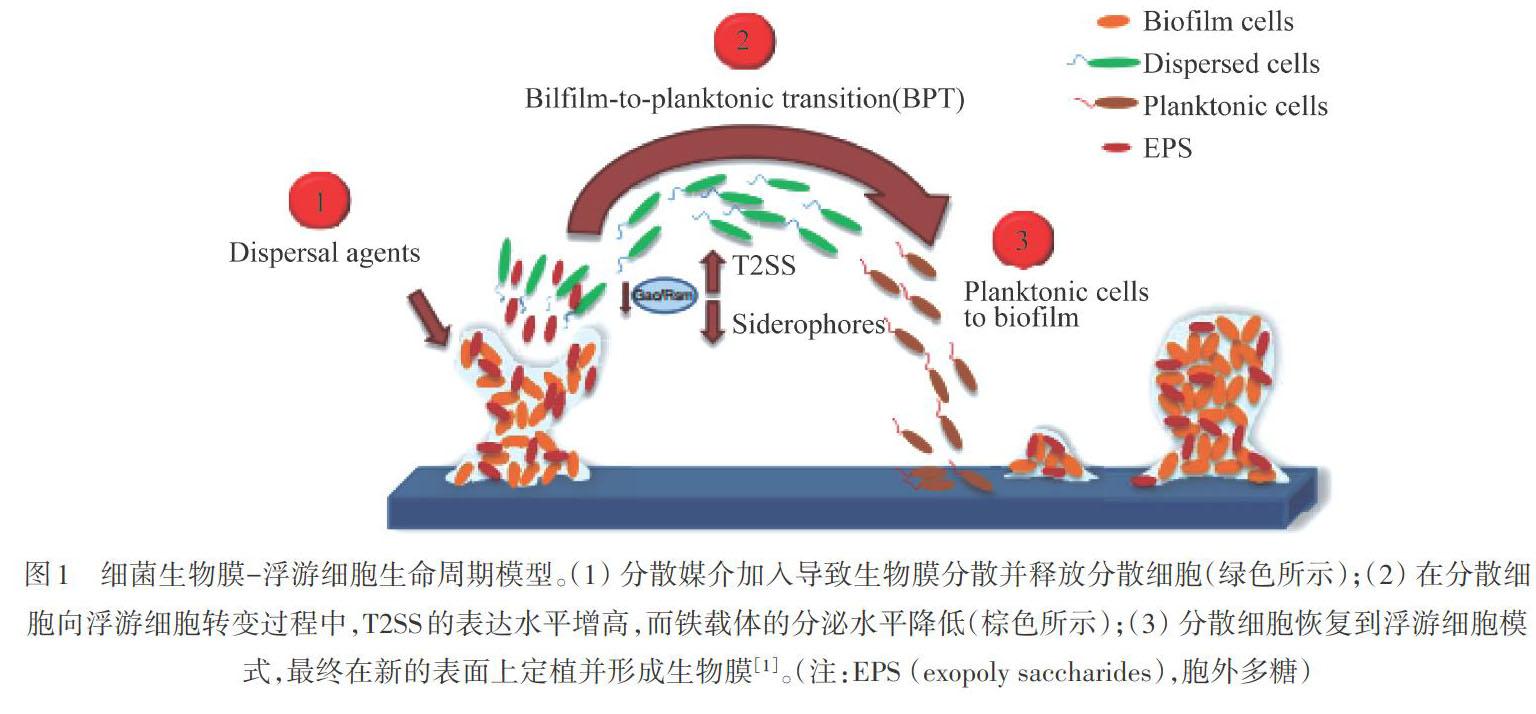
自然環境之中的细菌通常生活在结构复杂并处于动态变化的生物系统中,即生物膜( biofilm)。生物膜通常指附着于有生命或无生命基质表面被细菌胞外大分子包裹的有一定组织的细菌群体,并拥有自身独特的生命周期(图1)[1]。这些细菌胞外大分子的种类会随菌种的变化而异,但一般由蛋白质、胞外多糖、胞外DNA、肽聚糖和磷脂等物质组成[2]。这些胞外大分子的组合统称为细胞外基质(extracellular matrix),所有细菌生物膜的共同特征是存在细胞外基质,其将细胞聚集在一起,为生物膜结构提供稳定性,还可以增强细胞对干旱、渗透压等环境压力的抵抗力,促进营养物质的代谢交换,使细胞更有效定殖于载体表面,并增加水平基因转移的几率[3]。
细菌生物膜对社会生产的影响已经众所周知。在农业上,使用具有生物膜发育等多种促进植物生长特性的植物根际促生菌以减轻农作物所受到的环境胁迫并提高产量[4]。在工业上,某些海洋微生物会在船舶、线缆等物体表面形成致密的生物膜,对海洋环境中服务的基础设施和设备产生严重的材料腐蚀[5]。在医疗卫生上,细菌生物膜的形成不仅与细菌的耐药性有关,近期有研究发现细菌生物膜甚至可能与某些癌症的形成存在关联[6]。
但是以往的研究较少关注细菌生物膜在各微生物类群之间的作用,包括真菌、原生动物甚至是不同种的细菌。不同微生物类群之间通过不断相互作用构成所谓的微生物群落。因此可以说在生物膜中生长的微生物细胞彼此之间,以及与它们所处的环境和生活在同一生态位的其他微生物之间,都处于连续不断的相互接触中。因此,本文作者将重点讨论细菌生物膜在各微生物类群之间所扮演的角色与作用。
1 细菌与真菌
土壤中的细菌与真菌之间发生着包括共生、拮抗在内的各种相互作用。枯草芽孢杆菌(Bacillus subtilis)作为一种植物根际微生物,常被用作生物农药以及生物膜形成的模型[7]。枯草芽孢杆菌ALBA01与土壤真菌Setophoma terrestris相互作用、共同培养后,与单独培养的相比,具有更强的生物膜形成能力。在此过程中,与表面活性素(surfactin,一种细胞外基质成分)合成相关的srfAA基因起着至关重要的作用,该基因的缺失会显著破坏枯草芽孢杆菌ALBA01的抗真菌能力[8]。
随着研究的深入,人们发现细菌生物膜在细菌与真菌之间的作用比以往认为的更加复杂。黑曲霉(Aspergillus niger)是一种常见的植物病原菌,当枯草芽孢杆菌在黑曲霉存在条件下生长时,也可以通过形成类似于生物膜的结构附着和生长在黑曲霉的菌丝上,与真菌发生类似的相互作用。但BENOIT等[9]根据双转录组实验获得的数据,发现枯草芽孢杆菌和黑曲霉在这种相互作用过程中改变了正常代谢。当枯草芽孢杆菌的生物膜附着于黑曲霉菌丝上时,与枯草芽孢杆菌的抗真菌以及相关的抗菌防御机制基因的转录出现了一定水平的降低。同时还发现枯草芽孢杆菌与黑曲霉共培养时,其表面活性素的产量下降。这意味着细菌和真菌之间不仅存在着诸如直接竞争和间接竞争、对抗和营养消耗等对相互作用的种群成员具有负面影响的作用,而且它们在相互拮抗的过程中改变了原先的生长特性,在某些情况下甚至适应或支持彼此,同时提高了群落的适应性。
2 细菌与细菌
以往的研究报道了在芽孢杆菌和其他细菌交互作用中,生物膜中,细胞外基质成分表达的差异转录控制[10],但这些发现仅仅支持了生物膜对芽孢杆菌适应其他种类细菌存在的假设,少有研究直接证明这种细菌结构在调节细菌与细菌相互作用方面的功能意义。
CARLOS等[11]探讨了枯草芽孢杆菌3610生物膜的细胞外基质在预防绿针假单胞菌(Pseudomonas chlororaphis)PCL1606菌落入侵的功能作用。枯草芽孢杆菌的细胞外基质主要由胞外多糖(epsA-O操纵子编码基因合成的组成)、TasA(由三基因操纵子yqxM/tapA-sipW-tasA中编码的一种功能性淀粉样蛋白)以及BslA(参与生物膜上疏水外膜的形成)组成[12]。枯草芽孢杆菌eps,tasA,bslA三基因突变体(称为Δmatrix)菌落与绿针假单胞菌菌落发生相互作用96 h后,绿针假单胞菌菌落能够渗透,并完全定殖于枯草芽孢杆菌菌落中,而这两种细菌的野生型菌落之间仍然保持着明显的界线。这些发现显示细胞外基质具有物理防御作用,而eps和bslA基因对这种相互作用尤为重要。利用磁共振成像和固态核磁共振的结合,发现生物膜细胞外基质的缺失导致细胞集落更小、流动性更强,细胞外基质的缺乏会引起芽孢杆菌菌落生物物理特性的变化,从而破坏其完整性和对入侵的抵抗力,这种变化可能有利于绿针假单胞菌的渗透。
细菌的相互作用是由不同因素的组合来定义的,例如不同代谢途径的激活以及信号化合物、抗生素和群体感应分子的产生和分泌[13]。这些化合物可以通过细菌分泌系统、外排泵、转运体和膜泡排泄到细胞外空间。分泌机制可以是化合物特异性的,也可以是能够分泌广谱化合物的,有些机制需要相互作用的细胞之间紧密的物理连接,比如T6SS(type VI secretion system),这是一种能够将分子直接输送到其他细胞的管状穿刺装置。假单胞菌属的细菌可以利用它们的T6SS操纵和破坏真核宿主细胞[14]。这是已知的细菌和真核细胞相互作用和发病机理的一个重要的机制,但该系统对革兰氏阳性细菌的作用还尚不明确。CARLOS等[11]研究了T6SS在绿针假单胞菌和枯草芽孢杆菌两者菌落的交互作用,发现与枯草芽孢杆菌Δmatrix突变体产生交互作用相比,与野生型的枯草芽孢杆菌作用时假单胞菌的T6SS启动子表达明显升高,表明绿针假单胞菌利用T6SS作为一种强大的攻击策略来与竞争对手竞争,而枯草芽孢杆菌通过拥有完整细胞外基质的生物膜以及产生芽孢来对这种行为作出反击。除此之外,表面活性素也在这种菌落之间的相互作用中扮演着重要的角色。以往的观点认为芽孢杆菌所产生的表面活性素对其他细菌具有抑制作用[15],但实际上,当绿针假单胞菌与无表面活性素产生的ΔmatrixΔsurf菌株交互作用时,与产表面活性素Δmatrix相比,绿针假单胞菌对芽孢杆菌菌落的入侵程度减少了,表面活性素似乎间接促进了PCL1606菌落的传播。绿针假单胞菌可能劫持枯草芽孢杆菌的表面活性素来加速其运动性,并进一步渗透无完整细胞外基质的芽孢杆菌菌落。
3 细菌与原生动物
早期关于原生动物与细菌生物膜的研究集中于废水处理的活性污泥法,SYLVAINE等[16]发现原生动物对细菌的掠食行为可能是污水处理系统中细菌清除的重要生物学机制。KRZYSZTOF等[17]利用激光共聚焦扫描显微镜(CLSM)和数字图像分析技术,研究了原生动物对细菌生物膜形成的影响,发现活性污泥中的细菌生物膜生活在以鞭毛虫(Bodo saltans)为主的原生动物群落的掠食压力之下,活性污泥中的原生动物最初会干扰生物膜的发育,但随后会刺激其生长。
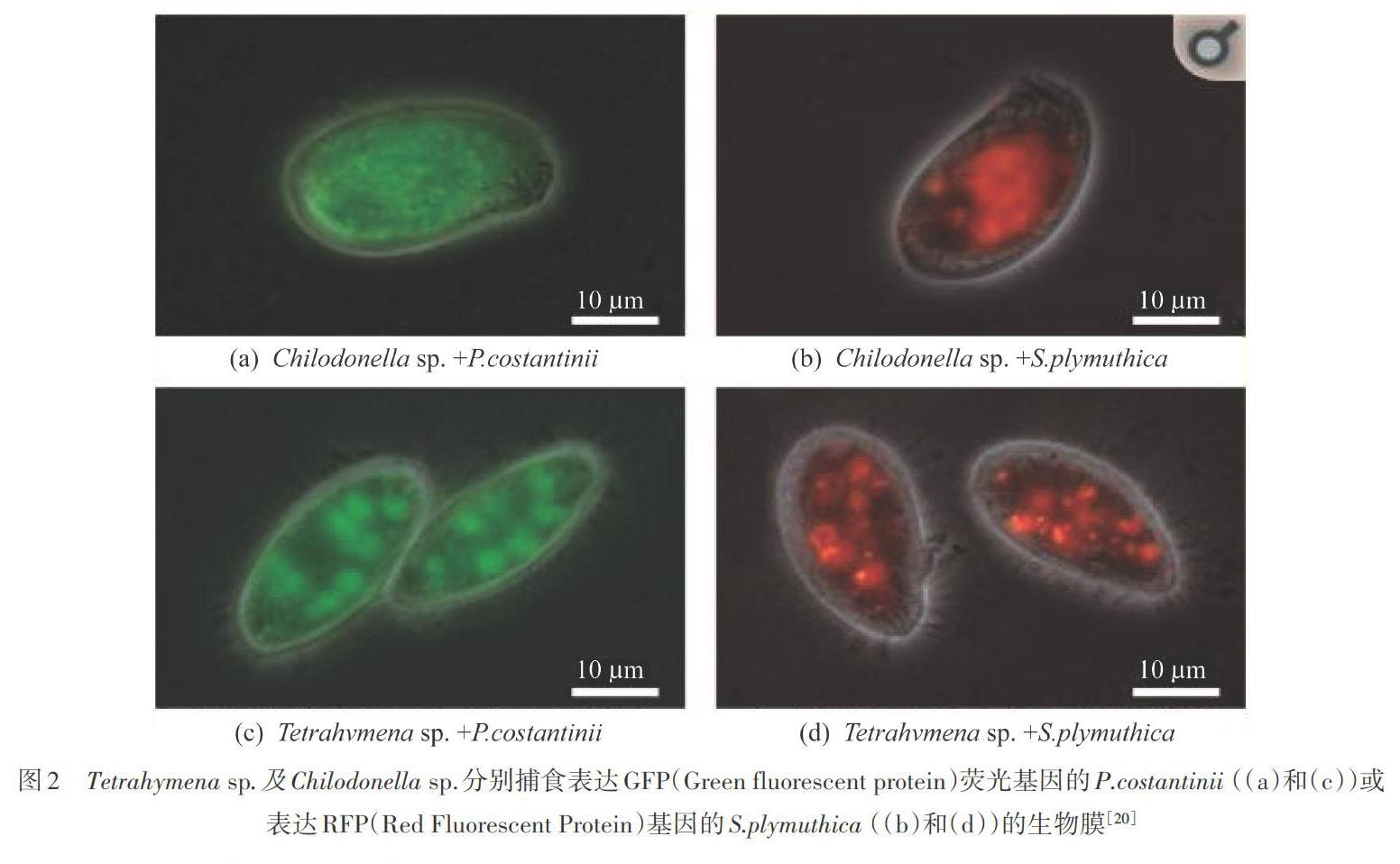
先前的研究表明:原生生物的掠食会改变细菌生物膜的形态,并可能导致诸如微菌落等抗捕食特征的形成[18]。比如细菌Serratia marcescens通过形成小菌落和丝状结构,对鞭毛虫以及阿米巴变形虫的捕食具有抗性[19]。DOPHEIDE等[20]利用两种纤毛虫(Tetrahymena sp.,Chilodonella sp.)研究原生动物对两种细菌(Pseudomonas costantinii,Serratia plymuthica)生物膜的取食作用(图2),通过活体共聚焦掃描显微镜揭示了不同的细菌生物膜针对不同原生动物的捕食表现出的防御策略。S.plymuthica的生物膜细胞在Tetrahymena sp.的捕食作用下更加紧密地聚集在一起,在整个生物膜中形成孔和通道,但没有形成任何明显的抵抗捕食的结构。P.costantinii的生物膜对Tetrahymena sp.捕食的反应与之前的研究一致,P.costantinii的生物膜减少,形成孤立的、不易被掠食的微菌落。Tetrahymena sp.对细菌生物膜的消耗被认为是由于其强大的自由游动的运动能力对细菌生物膜产生冲击,导致附着于生物膜上的细菌细胞的脱出并进入游离状态,随后将其摄入[21]。Chilodonella sp.对S.plymuthica生物膜产生的影响与Tetrahymena sp.不同。Chilodonella sp.的运动捕食行为可能造成S.plymuthica细菌生物膜中细胞的移动,促进了游离细菌而不是生物膜细胞的生长。在Chilodonella sp.对S.plymuthica细菌生物膜发生捕食作用后,S.plymuthica的整体向着微菌落的形态发展,而对于P.costantinii而言,则导致了生物膜中的细胞均匀分散。
SIMONE等[22]使用假单胞菌Pseudomonads与阿米巴变形虫Acanthamoeba castellanii来研究它们对小麦生长和健康的影响。发现在没有阿米巴变形虫的情况下,细菌分离物几乎对植物无有益的作用,一些分离物甚至被病原体利用来加速自身的生长。而与阿米巴变形虫的共接种则抑制了这种关系,致使植物在存在病原体的情况下仍然能生长并减少病原菌的有害影响。一些原生动物如纤毛虫和鞭毛虫对大肠杆菌、军团菌Legionella等细菌具有强力的捕食作用,因此也许能利用这些生物体来作为农作物上人类致病菌的潜在控制剂[23-24]。由于细菌在与植物的相互作用中是以群体而不是以个体为单位的,如植物根际促生菌往往形成生物膜结构,覆盖在植物根际的表面,以此发挥作用。植物根系通过产生根际分泌物能够影响根际的土壤生境,根际分泌物中特定的信号分子吸引植物根际促生菌至植物根际[25],细菌能够沿信号梯度定向游动至根际并定殖,即细菌趋化性(bacterial chemotaxis)[26],这种趋化性对细菌生物膜的形成具有一定影响,比如玉米的根系分泌物能够刺激并促进解淀粉芽孢杆菌(Bacillus amyloliquefaciens)SQR9的tapA-sipW-tasA操纵子表达,帮助其在玉米根系定殖并形成生物膜[27]。除此之外,根际分泌物也有可能对原生动物产生影响,因为原生动物通过某些化学感受器来感知细菌生物膜的某些特定化学信号分子,以此来定位细菌生物膜所在的区域[28],而植物根际分泌物化学成分对于这些化学感受器的影响还尚不明确。
4 细菌与噬菌体
细菌生物膜能够增强菌体对干旱、渗透压等非生物压力的抵抗力,同样,细菌生物膜也对诸如噬菌体这类生物侵染具有抗性,如甲型副伤寒沙门菌(Salmonella paratyphi A)的生物膜形成能力与其噬菌体抗性呈正相关[29]。虽然某些能够诱导解聚酶产生的噬菌体可以通过降解生物膜外聚基质的成分穿透生物膜的内层,但由于噬菌体的识别受体几乎全部位于对应细菌的外部结构上,生物膜中菌体的紧密排列会遮蔽部分噬菌体受体,导致噬菌体侵染效率的下降[30]。此外,某些细菌能够通过改变生物膜的化学成分以阻止噬菌体的吸附,如流感嗜血杆菌(Haemophilus influenza)能够修正lic2A基因并對其重复编码,从而在胞外基质中合成低脂聚糖聚合物,阻碍噬菌体HP1c1的感染[31]。由于细菌生物膜本质上是细菌群体感应(quorum sensing)的产物,因此在噬菌体与细菌生物膜的交互过程中,细菌群体感应的概念被引入其中。在T4噬菌体侵染大肠杆菌的过程中,大肠杆菌群体感应基因ydiV调节菌体脂多糖(LPS)的合成,改变生物膜状态,通过物理阻隔影响噬菌体的吸附和感染,这首次描述了群体感应系统在噬菌体感染细菌生物膜过程中的功能与作用[32] 。
5 讨 论
了解共享生态位的微生物物种之间相互作用的行为和机制是研究微生物种群进化的基础[33]。而在它们的交互作用中,重要的是要理解不同的微生物在生存适应性中使用的潜在策略,以及这些策略如何有益于自身[34]。
本文作者探讨了细菌生物膜在细菌与其他各微生物类群之间所扮演的角色。在细菌与真菌之间,人们先前认为生物膜仅作为一种细菌的拮抗手段来应对真菌的入侵,但更为深入的研究表明其可能作为一种媒介介导两者之间的共存。在应对异种细菌时,生物膜往往作为一种物理防御手段与入侵者竞争,某些细菌的生物膜甚至演化出如T6SS的攻击策略来杀伤对手。遭受原生动物捕食时,不同种细菌的生物膜变化不尽相同,或是增加生物膜的致密程度以应对原生动物的冲击,或是减少生物膜形成,形成不易被掠食的微菌落。而在抵抗噬菌体侵染方面,生物膜的作用更为多样,包括使菌体紧密排列遮蔽部分噬菌体受体,导致噬菌体侵染效率下降;调节本身化学成分变化,影响噬菌体的吸附;通过群体感应功能改变生物膜状态;通过物理阻隔抑制噬菌体感染。
由于相关的文献与资料比较缺乏,目前关于细菌生物膜的研究主要集中于医学领域,比如说生物分子对于细菌生物膜的形成作用[35]以及细菌生物膜产生的耐药性[36]等方面,关于此方面的论述不够详细。值得注意的是,现在关于细菌与植物关系的研究中往往把细菌以个体为单位进行阐述,而事实上,不能忽略细菌整体,即生物膜对于植物的作用。FIROZ等[4]利用具有生物膜形成能力的短小芽孢杆菌(Bacillus pumilus)FAB10菌株缓解盐分对小麦的胁迫并促进其生长,这有力证明了细菌生物膜对植物的正向作用。当然,由于微生物-土壤-植物体系的复杂性,在实际环境中研究细菌生物膜的作用是非常困难的,不仅是在土壤中难以观测到生物膜的具体形态,土壤-植物根系体系还处于动态变化中,这使研究更为困难。
以往关于细菌生物膜的研究往往是在离体条件下,利用延时共聚焦显微镜(Time-lapse confocal microscopy)进行观察,但离体条件存在一定的局限性,无法真实反映细菌生物膜的状况。现在,通过将特定的荧光基因导入细菌细胞,如荧光原位杂交(fluorescencein situhybridization,FISH)技术,再利用共聚焦激光扫描显微镜来对其进行观察,对在生物体中细菌生物膜的形成与发展的认识更为直观[15,37]。此外,在自然条件下,细菌生物膜往往包含若干种细菌,但当前对于细菌生物膜的研究局限于单一菌种的生物膜,不同微生物共同形成的细菌生物膜少有文献论述[38],这是目前研究的短板,希望日后的研究更加重视。
參考文献:
[1] CHUA S L,LIU Y,YAM J K H,et al.Dispersed cells represent a distinct stage in the transition from bacterial biofilm to planktonic lifestyles [J].Nature Communications,2014(5):4462.
[2] FLEMMING H C,WINGENDER J.The biofilm matrix [J].Nature Reviews Microbiology,2010,8(9):623-633.
[3] CASTIBLANCO L F,SUNDIN G W.New insights on molecular regulation of biofilm formation in plant-associated bacteria [J].Journal of Integrative Plant Biology,2016,58(4):362-372.
[4] ANSARI F A,AHMAD I,PICHTEL J.Growth stimulation and alleviation of salinity stress to wheat by the biofilm formingBacillus pumilusstrain FAB10 [J].Applied Soil Ecology,2019,143:5-54.
[5] LI Y F,NING C Y.Latest research progress of marine microbiological corrosion and bio-fouling,and new approaches of marine anti-corrosion and anti-fouling [J].Bioactive Materials,2019,4:189-195.
[6] LI S,PEPPELENBOSCH M P,SMITS R.Bacterial biofilms as a potential contributor to mucinous colorectal cancer formation [J].BBA-Reviews on Cancer,2019,1872(1):74-79.
[7] MIELICH-S?SS B,LOPEZ D.Molecular mechanisms involved inBacillus subtilisbiofilm formation [J].Environmental Microbiology,2015,17(3):555-565
[8] ALBARRACIN ORIO A G,TOBARES R A,PETRAS D,et al.Adaptation of Bacillus subtilisupon interaction withSetophoma terrestrisresults in loss of surfactin and plipastatin production [J/OL].bioRxiv(2018-07-01)[2020-08-01].https://doi.org/10.1101/376590.
[9] BENOIT I,VAN DEN ESKER M H,PATVSHAKULIYEVA A,et al.Bacillus subtilisattachment toAspergillus nigerhyphae results in mutually altered metabolism [J].Environmental Microbiology,2015,17: 2099-2113.
[10] SIM?ES M,SIM?ES L C,PEREIRA M O,et al.Antagonism betweenBacilluscereusandPseudomonasfluorescensin planktonic systems and in biofilms [J].Biofouling,2008,24(5):339-349.
[11] MOLINA-SANTIAGO C,PEARSON J R,NAVARRO Y,et al.The extracellular matrix protectsBacillus subtiliscolonies fromPseudomonasinvasion and modulates plant co-colonization [J].Nature Communications,2019,10(1):1919.
[12] HOBLEY L,OSTROWSKI A,RAO F V,et al.BslA is a self-assembling bacterial hydrophobin that coats theBacillus subtilisbiofilm [J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(33): 13600-13605.
[13] STEMPLER O,BAIDYA A K,BHATTACHARYA S,et al.Interspecies nutrient extraction and toxin delivery between bacteria [J].Nature Communications,2017,8(1):315.
[14] HO B T,BASLER M,MEKALANOS J J.Type 6 secretion system-mediated immunity to type 4 secretion system-mediated gene transfer [J].Science,2013,342(6155):250-253.
[15] BAIS H P,FALL R,VIVANCO J M.Biocontrol ofBacillus subtilisagainst infection ofArabidopsisroots byPseudomonas syringaeis facilitated by biofilm formation and surfactin production [J].Plant Physiology,2004,134(1):307-319.
[16] CHABAUD S,ANDRES Y,LAKEL A,et al.Bacteria removal in septic effluent: influence of biofilm and protozoa [J].Water Research,2006,40(16):3109-3114.
[17] RYCHERT K,NEU T.Protozoan impact on bacterial biofilm formation [J].Biological Letters,2010,47(1):3-10.
[18] B?HME A,RISSE-BUHL U,K?SEL K.Protists with different feeding modes change biofilm morphology [J].FEMS Microbiology Ecology,2009,69(2):158-169.
[19] QUECK S Y,WEITERE M,MORENO A M,et al.The role of quorum sensing mediated developmental traits in the resistance ofSerratia marcescensbiofilms against protozoan grazing [J].Environmental Microbiology,2006,8(6):1017-1025.
[20] DOPHEIDE A,LEAR G,STOTT R,et al.Preferential feeding by the ciliatesChilodonella andTetrahymena spp.and effects of these protozoa on bacterial biofilm structure and composition [J].Applied and Environmental Microbiology,2011,77(13):4564-4572.
[21] PARRY J D.Protozoan grazing of freshwater biofilms [J].Advances in Applied Microbiology,2004,54:167-196.
[22] WEIDNER S,LATZ E,AGARAS B,et al.Protozoa stimulate the plant beneficial activity of rhizosphericPseudomonads[J].Plant and Soil,2017,410(1/2):509-515.
[23] SATO T,TANIYAMA Y,YOSHIDA A,et al.Protozoan predation ofEscherichia coliin hydroponic media of leafy vegetables [J].Soil Science and Plant Nutrition,2019,65(3):234-242.
[24] AMARO F,SHUMAN H.Selection ofLegionellavirulence-related traits by environmental protozoa [M]//BUCHRIESER C,HILBI H.Legionella: Methods and Protocols.New York: Humana Press,2019:55-78.
[25] BARDY S L,BRIEGEL A,RAINVILLE S,et al.Recent advances and future prospects in bacterial and archaeal locomotion and signal transduction [J].Journal of Bacteriology,2017,199(18):e00203-17.
[26] BI S Y,SOURJIK V.Stimulus sensing and signal processing in bacterial chemotaxis [J].Current Opinion in Microbiology,2018,45:22-29.
[27] ZHANG N,YANG D Q,WANG D D,et al.Whole transcriptomic analysis of the plant-beneficial rhizobacteriumBacillus amyloliquefaciensSQR9 during enhanced biofilm formation regulated by maize root exudates [J].BMC Genomics,2015,16(1):685.
[28] MARTEL C M.Prey location,recognition and ingestion by the phagotrophic marine dinoflagellateOxyrrhis marina[J].Journal of Experimental Marine Biology and Ecology,2006,335(2):210-220.
[29] 毛普加,冯梦蝶,洪愉,等.甲型副伤寒杆菌抗噬菌体及生物膜形成基因的筛选及鉴定 [J].生物化学与生物物理进展,2015,42(6):583-588.MAO P J,FENG M D,HONG Y,et al.Screen and identification of genes of Salmonella paratyphi A related to anti-phage and biofilm formation [J].Progress in Biochemistry and Biophysics,2015,42(6):583-588.
[30] RICKARD A H,GILBERT P,HIGH N J,et al.Bacterial coaggregation: an integral process in the development of multi-species biofilms [J].Trends in Microbiology,2003,11(2):94-100.
[31] ZALESKI P,WOJCIECHOWSKI M,PIEKAROWICZ A.The role of Dam methylation in phase variation ofHaemophilus influenzaegenes involved in defence against phage infection [J].Microbiology,2005,151(10):3361-3369.
[32] 趙晓曼.大肠杆菌群体感应基因ydiV在噬菌体感染中的作用研究 [D].昆明:昆明理工大学,2016.
[33] MARTIN M,DRAGO? A,H?LSCHER T,et al.De novoevolved interference competition promotes the spread of biofilm defectors [J].Nature Communications,2017,8(1):15127.
[34] SANTHANAM R,LUU V T,WEINHOLD A,et al.Native root-associated bacteria rescue a plant from a sudden-wilt disease that emerged during continuous cropping [J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(36):E5013-E5020.
[35] SALMAN M,RIZWANA R,KHAN H,et al.Synergistic effect of silver nanoparticles and polymyxin B against biofilm produced byPseudomonas aeruginosaisolates of pus samplesin vitro[J].Artificial Cells,Nanomedicine,and Biotechnology,2019,47(1):2465-2472.
[36] ADAMUS-BIA?EK W,WAWSZCZAK M,ARABSKI M,et al.Ciprofloxacin,amoxicillin,and aminoglycosides stimulate genetic and phenotypic changes in uropathogenicEscherichia colistrains [J].Virulence,2019,10(1):260-276.
[37] BERNARDI S,CONTINENZA M A,AL-AHMAD A,et al.Streptococcus spp.andFusobacterium nucleatumin tongue dorsum biofilm from halitosis patients:a fluorescencein situhybridization (FISH) and confocal laser scanning microscopy (CLSM) study [J].The New Microbiologica,2019,41(2):108-113.
[38] LEE K W K,PERIASAMY S,MUKHERJEE M,et al.Biofilm development and enhanced stress resistance of a model,mixed-species community biofilm [J].The ISME Journal,2014,8(4):894-907.
(责任编辑:顾浩然)

